高速逆流色谱分离制备北五味子中科罗索酸
朱力杰,孟宪军*,李 斌,刘秀英,陶冬冰
(沈阳农业大学食品学院,辽宁 沈阳 110866)
高速逆流色谱分离制备北五味子中科罗索酸
朱力杰,孟宪军*,李 斌,刘秀英,陶冬冰
(沈阳农业大学食品学院,辽宁 沈阳 110866)
建立通过高速逆流色谱从北五味子中快速分离科罗索酸的方法。将北五味子的乙醇提取物经AB-8大孔树脂初步纯化后直接采用高速逆流色谱进行分离,并通过高效液相色谱法考察了粗提物在不同溶剂体系中的分配情况。结果表明,最佳溶剂体系为正己烷-乙酸乙酯-甲醇-水(6∶5∶5∶4,V/V),从150 mg粗提物中一次性分离制备得到6.3 mg纯度为97.6%的科罗索酸。该方法分离效率较高,对科罗索酸在食品医药领域的应用具有重要意义。
高速逆流色谱;科罗索酸;北五味子
北五味子(Schisandra chinensis (Turcz.) Baill)为木兰科五味子属植物,主要分布于东北亚地区[1],在我国以辽宁省出产的质量为最佳,亦有“辽五味”之称[2]。其果实和藤茎作为传统的药材和功能性食品,具有保肝、镇静、催眠、镇痛、保护脑神经细胞、抗衰老、增强免疫、抗肿瘤等多种功效[3]。目前对北五味子化学成分的研究主要集中在木质素[4]、多糖[5]和有机酸[6]类化合物上,对于其三萜类化合物的报道较少且以低纯度提取工艺研究为主。研究发现,北五味子中的三萜类成分——科罗索酸具有很强的生物活性,包括降血糖[7]、抑制癌细胞增殖[8]、诱导癌细胞凋亡[9]、保护细胞损伤[10]等,其结构如图1所示。科罗索酸已进入美国食品和药物管理局的Ⅲ期临床药效学评价[11],作为食品补充剂已在国外得到认可[12],在食品、保健品等工业中具有较好的发展前景[13]。目前,科罗索酸的分离制备往往采用反复柱层析[14]等手段,缺乏快速、简便的方法,限制了其应用。

图1 科罗索酸的化学结构Fig.1 Chemical structure of corosolic acid
高速逆流色谱(high speed counter current chromatography,HSCCC)是Ito等[15]发明的一种新型的液-液分配色谱,与常规固-液色谱分离方法相比较,由于采用液体作为固定相载体,目标化合物在互不相容的两相由于分配系数的不同而得以分离,解决了传统固体载体样品死吸附、变性、峰形拖尾等问题[16],在食品、医药、天然产物等领域有着广泛应用[17-23]。本实验在课题组前期研究[24]的基础上,采用高效液相色谱(high performance liquid chromatography,HPLC)法,准确、快速地测定了北五味子藤茎中的科罗索酸在两相溶剂体系中的分配系数,从而选定了HSCCC的溶剂体系,制备了高纯度的科罗索酸。
1 材料与方法
1.1 材料与试剂
北五味子藤茎(2012年产) 抚顺青松药业有限公司;AB-8大孔树脂 沧州宝恩吸附材料科技有限公司;无水乙醇、正己烷、乙酸乙酯、甲醇等均为分析纯;HPLC分析用的乙腈等均为色谱纯。
1.2 仪器与设备
TBE300B型高速逆流色谱 上海同田生物技术有限公司;HPLC系统(配有1525型溶剂泵系统、2487型紫外-可见光检测器) 美国Waters公司;AM-500MHz型核磁共振谱仪 瑞士Bruker公司;IKA-MS1型旋涡混合仪 德国IKA公司;摇摆式高速中药粉碎机 浙江温岭市创力药材器械厂;DZF-6050型真空干燥箱 上海精宏仪器设备有限公司。
1.3 方法
1.3.1 北五味子粗提物的制备
1.3.2 HPLC分析条件
分析色谱柱:Hypersil ODS-2 C18(150 mm×4.6 mm,5 μm);温度:25 ℃;样品质量浓度:3 mg样品溶于1 mL甲醇;进样体积:15 μL;流动相流速:1 mL/min;流动相:A:水,B:乙腈;检测器:紫外-可见光检测器(200~800 nm,210 nm为检测波长);HPLC梯度洗脱程序为0~20 min,35%~90% B; 20~25 min;90%~95% B;25~30 min,95% B。
1.3.3 分配系数(K)的测定
称取5 mg粗提物粉末,分别溶于不同体积比的正己烷-乙酸乙酯-甲醇-水体系中,采用1.3.2节中的HPLC分析方法,取各体系上、下两相各15 μL,分别进样检测,记录各样品的峰面积。样品在不同溶剂体系中的分配系数按式(1)计算。

式中:K为分配系数;cU为上相中的浓度/(mol/L);cL为下相中的浓度/(mol/L);AU为上相峰面积/(mAU·s);AL为下相峰面积/(mAU·s)。
1.3.4 样品的HSCCC分离
将正己烷-乙酸乙酯-甲醇-水(6∶5∶5∶4,V/V)溶剂体系置于分液漏斗中,摇匀,静置过夜,取上相为固定相,下相为流动相,经超声波脱气后,用5 mL流动相完全溶解样品。开机打开工作站,预热后,以20 mL/min的速度将固定相泵入HSCCC的螺旋柱中。待有固定相流出后,将主机设置为正转(顺时针),转速缓慢调至800 r/min,同时将流动相以5 mL/min的速率泵入。至固定相不再流出时,说明溶剂系统已经达到平衡,将流速降至2 mL/min,平衡基线。用流动相清洗样品环后,将溶解好的样品经由进样阀注入样品环中,同时开始采集数据,检测波长为210 nm,按照色谱峰对目标成分进行收集。
随着我国土地流转的加剧和农业现代化、规模化的发展,传统农资行业销售渠道正面临着翻天覆地的改变,厂家渠道贴地下沉,市场竞争不断加剧,新型农业经营主体和新型服务平台的层出不穷,农资企业在业务拓展上受到越来越多的阻力和挑战。如何在新的农业发展形势下拥抱变化、盘活市场成为肥料生产企业亟待破解的难题。
1.3.5 纯度分析及结构鉴定
采用1.3.2节的HPLC分析方法,根据峰面积归一化法对制备得到的样品进行纯度分析。HSCCC分离得到的样品经核磁共振氢谱(1H-nuclear magnetic resonance,1H-NMR)和核磁共振碳谱(13C-NMR)鉴定,核磁共振过程中溶剂为氘代吡啶(C5D5N),以四甲基硅烷为内标物。
2 结果与分析
2.1 HSCCC溶剂体系的选择

表1 不同体积比的溶剂体系下北五味子粗提物的分配系数Table1 Partitioning coefficients ((K) of the crude extract of Schisannddrraa chineennssiiss (Turcz.) Baill in solvent systems with different volume ratios
选择合适的溶剂体系是能否成功应用HSCCC对目标物进行分离的关键。根据相关原理,通常目标物在溶剂体系中的分配系数在0.5~2之间能达到满意的分离效果。本实验目标产物存在于70%的乙醇洗脱部位,故选用中等偏弱极性的正己烷-乙酸乙酯-甲醇-水体系。样品在该溶剂体系中的分配系数见表1。体积比为5∶5∶5∶5时,样品的分配系数较小,主要溶解于下相中;其余3个体积比的溶剂体系的分配系数均在可分离范围内。故按照1.3.4节的方法,分别进样考察分离效果,HSCCC色谱图见图2。

图2 北五味子粗提物在不同溶剂体系下的HSCCC色谱图Fig.2 HSCCC chromatograms of the crude extract of Schisandra chinensis (Turcz.) Baill in different solvent systems: (a) n-hexane-ethyl acetate-methanol-water (5∶5∶5∶6, V/V), (b) n-hexane-ethyl acetatemethanol-water (6∶5∶5∶5, V/V), and (c) n-hexane-ethyl acetate-methanolwater (6∶5∶5∶4, V/V)
由图2可知,根据HSCCC图谱比较,在体积比为5∶5∶5∶6时,组分1与其他杂质没有分开,且出峰时间较为延后;在体积比为6∶5∶5∶5时,组分1与杂质基本分开,出峰时间有一定提前;在体积比为6∶5∶5∶4时,组分1的分离度和出峰时间均较为适宜。故最终确定溶剂体系为正己烷-乙酸乙酯-甲醇-水(6∶5∶5∶4,V/V)。
2.2 目标物的HSCCC分离
在溶剂体系为正己烷-乙酸乙酯-甲醇-水(6∶5∶5∶4,V/V)条件下,按照1.3.4节的方法进行分离。将150 mg样品用5 mL流动相完全溶解样品后进样。根据HSCCC色谱图收集并鉴定各组分,将组分1按纯度合并,重结晶后得到6.3 mg。
2.3 样品的纯度分析
按照1.3.5节的方法,采用HPLC法对2.2节中分离得到的组分1进行纯度分析,色谱图见图3,利用峰面积归一化法得到组分1的纯度为97.6%。
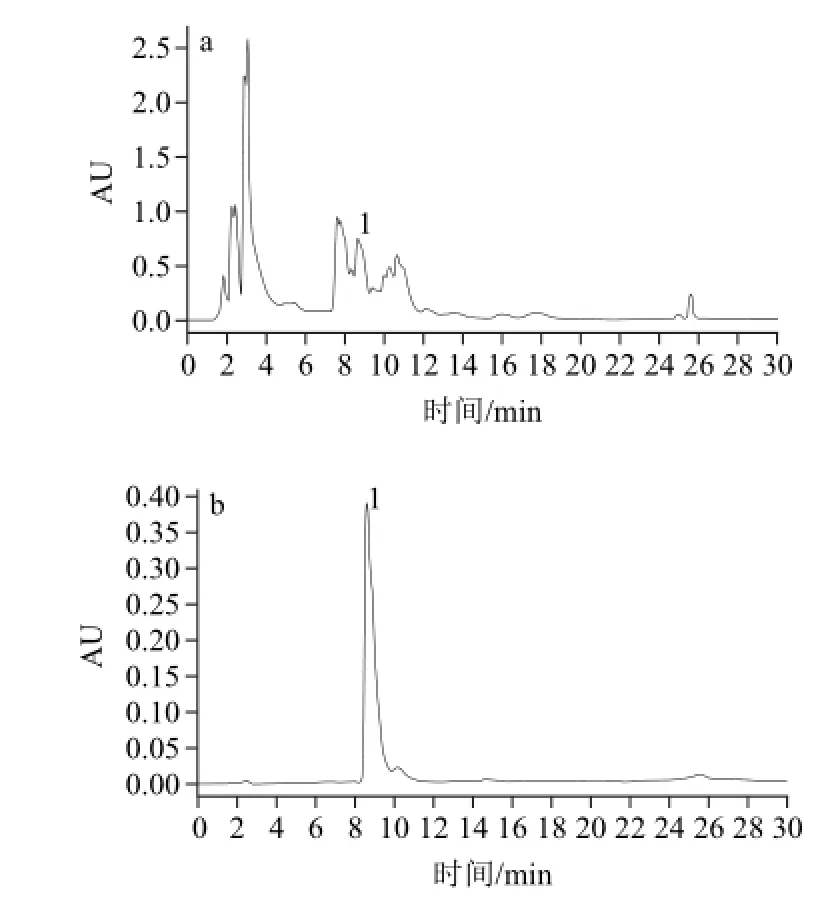
图3 北五味子粗提物(a)、HSCCC分离得到的组分1(b)的HPLC色谱图Fig.3 HPLC chromatograms of the crude extract of Schisandra chinensis (Turcz.) Baill (a) and component 1 from the crude extract (b) by HSCCC
2.4 样品的结构鉴定
HSCCC分离得到的组分1在吡啶中为白色针状结晶。通过核磁共振鉴定,其波谱数据如下:1H-NMR(300 MHz,C5D5N,图4):d 5.48 (1H, t, J=3.0 Hz),3.41(1H, d, J=9.0 Hz),2.63(1H, d, J=11.4 Hz);1.29, 1.22, 1.09, 1.06, 1.05, 1.03, 1.01 (each 3H, s)。13C-NMR(75 MHz,C5D5N,图5):48.0(C-1), 68.6(C-2),83.8(C-3),40.0(C-4),55.9(C-5),18.9(C-6),33.5(C-7),39.9(C-8),48.1(C-9),38.5(C-10),23.8(C-11),125.6(C-12),139.3(C-13),42.6(C-14),28.7(C-15),24.9(C-16),48.0(C-17),53.5(C-18),39.4(C-19),39.4(C-20),31.1(C-21),37.5(C-22),29.4(C-23),17.7(C-24),17.0(C-25),17.5(C-26),23.9(C-27),179.9(C-28),21.4(C-29),17.5(C-30)。与文献[25]对照,将该化合物鉴定为科罗索酸。

图4 组分1的11H-NMR图-NMRFig.4 1H-NMR spectrum of component 1
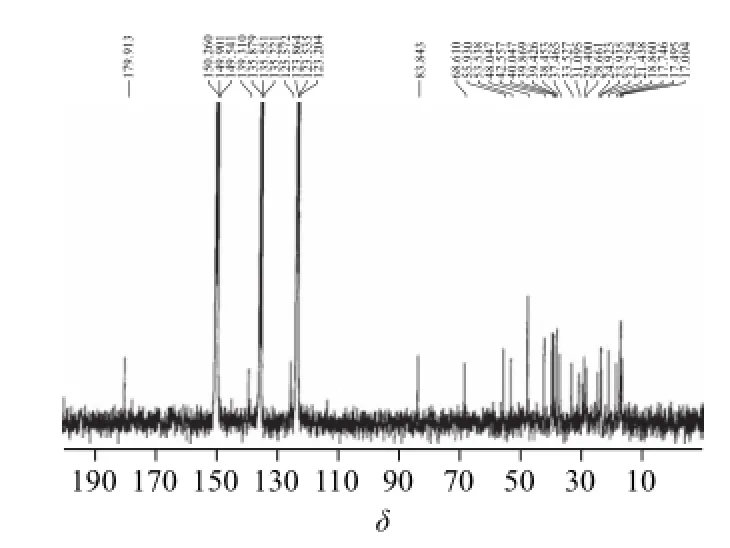
图5 样品11号的1133C--NNMMRR图Fig.5 13C-NMR spectrum of component 1
3 结 论
本研究采用HSCCC,通过正己烷-乙酸乙酯-甲醇-水(6∶5∶5∶4,V/V)溶剂体系从北五味子粗提物中分离得到了科罗索酸。一次进样150 mg粗提物后可以分离出6.3 mg科罗索酸,纯度达97.6%。采用HSCCC对北五味子中科罗索酸的分离目前还未见文献报道,本研究对于拓展北五味子中科罗索酸的在食品、医药等领域的应用前景具有重要意义。
[1] HANCKE J L, BURGOS R A, AHUMADA F. Schisandra chinensis (Turcz.) Baill[J]. Fitoterapia, 1999, 70: 451-471.
[2] 戴好富, 谭宁华, 周俊. 北五味子中的一个新单萜苷[J]. 高等学校化学学报, 2005, 26(9): 1659-1661.
[3] 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J].药物评价研究, 2011, 34(3): 208-212.
[4] 黄晓东, 任旷. 五味子木脂素研究进展[J]. 吉林医药学院学报, 2010, 31(1): 46-49.
[5] 游玟娟, 温拥军. 北五味子多糖提取条件及其抗氧化性能[J]. 食品与发酵工业, 2012, 38(9): 206-210.
[6] 唐苗苗, 刘翼翔, 毛婷, 等. 高效液相色谱法测定北五味子有机酸含量[J]. 食品工业科技, 2012, 33(15): 328-330.
[7] YAMADA K, HOSOKAWA M, FUJIMOTO S, et al. Effect of corosolic acid on gluconeogenesis in rat liver[J]. Diabetes Research and Clinical Practice, 2008, 80: 48-55.
[8] 欧阳慧, 封亮, 徐友华, 等. 不同产地夏枯草中抗非小细胞肺癌成分科罗索酸的差异比较[J]. 中华中医药杂志, 2012, 27(6): 1571-1574.
[9] KYOUNG J N, JIN M C, HOKYOUNG K. Corosolic acid induces apoptotic cell death in human lung adenocarcinoma A549 cells in vitro[J]. Food and Chemical Toxicology, 2013, 56: 8-17.
[10] 沈驹华, 何洁, 韦盛. 科罗索酸对大鼠嗜铬细胞瘤PC12细胞缺氧缺糖损伤的保护作用[J]. 中国临床药理学杂志, 2010, 26(12): 932-935.
[11] JUDY W V, HARI S P, STOGSDILL W W, et al. Antidiabetic activity of a standardized extract (Glucosol) from Lagerstroemia speciosa leaves in type Ⅱ diabetics: a dose-dependence study[J]. Journal of Ethnopharmacology, 2003, 87(1): 115-117.
[12] CALIGIANI A, MALAVASI G, PALLA G, et al. A simple GC-MS method for the screening of betulinic, corosolic, maslinic, oleanolic and ursolic acid contents in commercial botanicals used as food supplement ingredients[J]. Food Chemistry, 2013, 136: 735-741.
[13] 梁茂雨, 陈怡平, 纵伟. 降血糖功能因子科罗索酸研究进展[J]. 中国食物与营养, 2007(5): 17-18.
[14] 王冠. 瑶药白马骨化学成分及生物活性初步研究[D]. 广州: 暨南大学, 2006.
[15] OKA H, HARADA K I, ITO Y. Separation of antibiotics by countercurrent chromatography[J]. Journal of Chromatography A, 1998, 812: 35-52.
[16] 程杰, 符晓晖, 王维娜. 高速逆流色谱在中药分离中溶剂体系的筛选[J]. 中草药, 2008, 39(8): 1272-1275.
[17] 崔恒薇, 李博, 杜琪珍. 高速逆流色谱分离制备常春油麻藤豆荚中丁香脂素[J]. 食品与发酵工业, 2011, 37(5): 186-188.
[18] 钱登勇, 李博, 蒋志国, 等. 高速逆流色谱分离制备胡椒中的胡椒碱[J]. 食品科学, 2011, 32(24): 274-276.
[19] 蒋志国, 陈文学, 刘四新. 高速逆流色谱分离制备白胡椒中单萜类化合物[J]. 食品与发酵工业, 2011, 37(3): 202-205.
[20] 高荫榆, 魏强, 范青生, 等. 高速逆流色谱分离提取天然产物技术研究进展[J]. 食品科学, 2008, 29(2): 461-465.
[21] FRIGHETTO T S, WELENDORF R M, NIGRO E N, et al. Isolation of ursolic acid from apple peels by high speed counter-current chromatography[J]. Food Chemistry, 2008, 106: 767-771.
[22] YANG Yi, GU Dongyu, WU Hankui, et al. Application of preparative high-speed countercurrent chromatography for separation of elatine from Delphinium shawurense[J]. Journal of Liquid Chromatography & Related Technologies, 2008, 31: 3012-3019.
[23] YAO Shun, LUO Jianguang, HUANG Xuefeng, et al. Application of preparative high-speed counter-current chromatography/preparative high-performance liquid chromatography mode in rapid separation of saponins[J]. Journal of Chromatography B, 2008, 864: 69-77.
[24] 孟宪军, 朱力杰, 李斌, 等. 大孔树脂纯化北五味子藤茎中总三萜的研究[J]. 食品工业科技, 2012, 33(4): 339-342.
[25] ZONG Wei, ZHAO Guangyuan. Corosolic acid isolation from the leaves of Eriobotrta japonica showing the effects on carbohydrate metabolism and differentiation of 3T3-L1 adipocytes[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16: 346-352.
Preparative Isolation and Purification of Corosolic Acid from Schisandra chinensis (Turcz.) Baill by High Speed Counter Current Chromatography
ZHU Li-jie, MENG Xian-jun*, LI Bin, LIU Xiu-ying, TAO Dong-bing
(College of Food, Shenyang Agricultural University, Shenyang 110866, China)
An effective and rapid method for the separation of corosolic acid from Schisandra chinensis (S. chinensis) (Turcz.) Baill by high-speed counter-current chromatography (HSCCC) was established. The alcohol extract of S. chinensis (Turcz.) Baill was initially separated using AB-8 macroporous resins and further purified by HSCCC. A high performance liquid chromatography (HPLC) method was used to determine the partitioning coefficient of crude extract in different solvent systems. The results showed a solvent system consisting of n-hexane, ethyl acetate, methanol and water (6:5:5:4, V/V) was the best one for the HSCCC separation. A total of 6.3 mg of corosolic acid with a purity as high as 97.6% was obtained in one step separation from 150 mg of crude extract. The method is of high separation efficiency, and has a great importance for applications of corosolic acid in the food and medical fields.
high-speed counter-current chromatography; corosolic acid; Schisandra chinensis (Turcz.) Baill
TS201.3
A
1002-6630(2014)02-0001-04
10.7506/spkx1002-6630-201402001
2013-05-22
国家自然科学基金青年科学基金项目(31201325);辽宁省教育厅科学研究一般项目(L2011109)
朱力杰(1986—),男,博士研究生,研究方向为功能性食品。E-mail:charleswestwood@163.com
*通信作者:孟宪军(1960—),男,教授,博士,研究方向为果蔬加工与功能性食品。E-mail:mengxjsy@126.com

