HMGB1、NF-κBp65、MMP2在子宫内膜腺癌组织中的表达及相关性研究
刘桂云 滕学芹 于 辉
(德州学院医药与护理学院,山东253023)
子宫内膜癌(endometrialcar cinoma,EC)是原发于子宫内膜(proliferative endometrium)的一组上皮性恶性肿瘤,为女性生殖道三大恶性肿瘤之一,占女性生殖道恶性肿瘤的20%-30%,占女性全身恶性肿瘤的6%[1],其中约90%起源于内膜腺体,又称子宫内膜腺癌。近年来在全世界发病率呈明显上升趋势,2010年美国有43000新发子宫内膜癌患者[2]。近年来肿瘤特异性的调亡抑制因子,如高迁移 率 族 蛋 白 (high-mobility group protein1,HMGB1)、核因子-κB(nuclear factor-kappaB,NF-κBp65)和基质金属蛋白酶(matrix metalloproteinase,MMPs)单个在肿瘤的发生与发展中的作用成为研究的热点,HMGB1、NF-κBp65、MMP2各自也有许多研究成果[3,4],但是三者同时研究还未见报道。本研究采用免疫组织化学二步法对126例标本进行 HMGB1、NF-κBp65、MMP2表达情况检测并分析其在子宫内膜腺癌表达的相关性,探讨HMGB1、NF-κBp65、MMP2在子宫内膜腺癌发生发展过程中的意义,旨在为子宫内膜腺癌的早期诊断及临床治疗提供潜在的新途径。
材料和方法
1.材料
收集2009年1月至2013年6月德州市人民医院妇科手术的子宫内膜组织存档蜡块126个。其中子宫内膜癌66例,年龄范围37-72岁,平均53.9岁;不典型增生性子宫内膜36例,年龄范围47-61岁,平均年龄52岁;选取同期其他原因进行诊断性刮宫获得正常增生期子宫内膜24例,年龄范围33-51岁,平均年龄43.3岁。所有子宫内膜癌标本患者术前均未接受放疗、化疗。
2.HE染色
每个蜡块均制7张切片(5张用于免疫组化染色、2张用于HE染色)常规脱蜡至水,苏木精染色4min,5%盐酸乙醇分化数秒,伊红复染30S,脱水、透明、封片、镜检。
3.免疫组织化学染色
免疫组化染色按二步法试剂盒操作说明进行,直接煮沸法抗原修复37℃温箱孵育,用磷酸缓冲洗液(PBS)代替一抗作阴性对照,用己知子宫内膜癌阳性切片作阳性对照。以便较为确切而客观地反映检测结果。显微镜下观察。
4.诊断分级标准
按国际妇产科联盟(FIGO)1988年手术-病理分期标准,对所有内膜癌病理切片进行详细分级,手术一病理分期I期50例(其中Ia期32例,Ib期18例),Ⅱ期8例,Ⅲ、Ⅳ期8例。FIGO分期:高分化(Gl期)48例,中分化(G2期)12例,低分化(G3期)6例,有淋巴结转移者6例;子宫内膜癌病理组织学分型:腺癌65例,浆液性乳头状囊腺癌1例。
5.统计学分析
HMGB1、NF-κBp65和 MMP2均以细胞浆内有黄色颗粒为阳性细胞。按有无着色及着色深浅依次分级:无着色为(一),淡黄色为(+),黄色为(++),棕黄色为 (+++)。所有数据应用SPSS17.0软件进行χ2检验,校正χ2检验,Fisher′s确切概率等方法进行统计分析。P<0.05具有统计学意义,P<0.01有显著性差异。
结 果
1.HMGB1、NF-κBp65和 MMP2在子宫内膜癌、不典型增生性子宫内膜、正常增生期子宫内膜组织中的表达
1.1HMGB1蛋白在子宫内膜癌、不典型增生性子宫内膜、正常增生期子宫内膜组织中的表达
HMGB1蛋白表达在子宫内膜癌细胞和腺上皮胞核及胞浆中,呈棕黄色。HMGB1在正常增生期子宫内膜中基本呈阴性或弱阳性表达,阳性率为25%。在不典型增生性子宫内膜组织中阳性表达率为55.56%。在子宫内膜癌组织中阳性表达率为78.79%(图1,2)。
统计学结果显示,子宫内膜癌组与正常组比较HMGB1的阳性表达率有明显差异(P<0.05),子宫内膜癌组与不典型增生性子宫内膜组比较HMGB1的阳性表达率有明显差异(P<0.05),见表1。
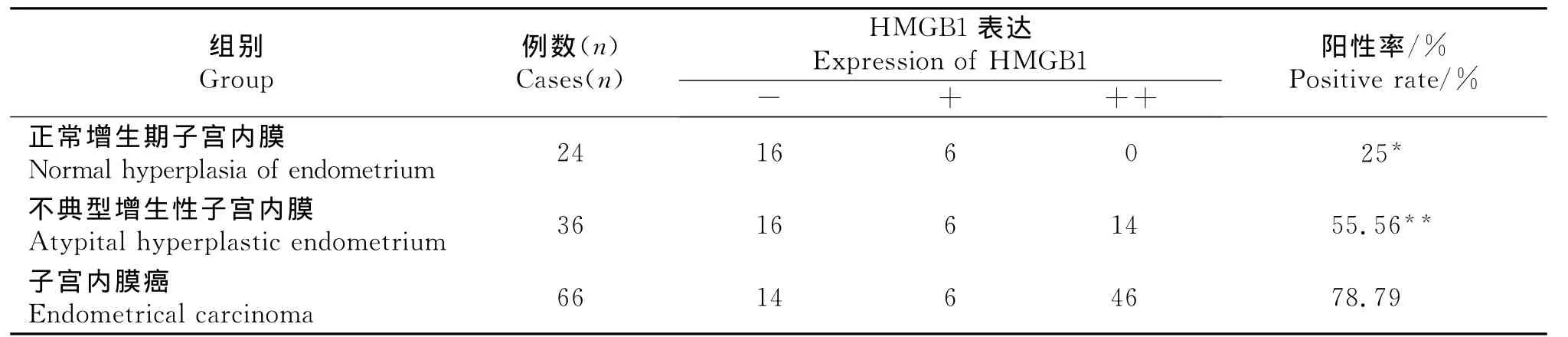
表1 HMGB1在不同类型子宫内膜组织中表达Table 1 HMGB1expression in different types of endometrial tissue
1.2NF-κBp65蛋白在子宫内膜癌、不典型增生性子宫内膜、正常增生期子宫内膜组织中的表达
NF-κBp65蛋白在癌细胞和腺上皮细胞的胞浆和(或)胞核中表达,以胞浆为主(图3,4)。24例正常增生期子宫内膜均为阴性表达;36例不典型增生性子宫内膜中有14例(38.89% )阳性表达;66例子宫内膜腺癌中有42例(63.64%)阳性表达,子宫内膜样腺癌与正常增生期子宫内膜组比较,差异有统计学意义(P<0.05);与不典型增生性子宫内膜比较,差异有统计学意义(P<0.05),见表2。

表2 NF-κBp65在不同类型子宫内膜组织中表达Table 2 NF-κBp65expression in different types of endometrial tissue
1.3MMP2蛋白在子宫内膜癌、不典型增生性子宫内膜、正常增生期子宫内膜组织中的表达
MMP2主要表达于癌细胞和子宫内膜腺上皮细胞的细胞浆,呈淡黄色、黄色或棕黄色颗粒(图5,6)。MMP2在正常子宫内膜组织中的阳性表达率为8.33%;在不典型增生性子宫内膜组织中的阳性表达率为50.00%;子宫内膜癌组织中MMP2的阳性表达率为71.21%,与正常子宫内膜组织相比,差异有显著性差异(P<0.05),见表3。

表3 MMP2在不同类型子宫内膜组织中的表达Table 3 MMP2expression in different types of endometrial tissue
2.HMGB1、NF-κBp65和 MMP2在子宫内膜癌中表达的相关性分析
2.1HMGB1和 NF-κBp65表达的相关性
在本实验研究中66例子宫内膜癌中,其中52例HMGB1阳性表达中,36例NF-κBp65阳性表达,16例NF-κBp65阴性表达;14例 HMGB1阴性表达中6例NF-κBp65阳性表达,8例NF-κBp65阴性表达。NF-κBp65与HMGB1在子宫内膜癌中的表达为正相关关系(r=0.67)。
2.2HMGB1与MMP2表达的相关性
在本实验研究中66例子宫内膜癌中,其中52例HMGB1阳性表达中,37例MMP2阳性表达,15例MMP2阴性表达;14例HMGB1阴性表达中10例MMP2阳性表达,4例 MMP2阴性表达。HMGB1与MMP2在子宫内膜癌中的表达为正相关关系(r=0.41)。
2.3NF-κBp65与 MMP2表达的相关性
在本实验研究中66例子宫内膜癌中,其中42例NF-κBp65阳性表达中,30例MMP2阳性表达,12例MMP2阴性表达;24例NF-κBp65阴性表达中17例MMP2阳性表达,7例MMP2阴性表达。NF-κBp65与MMP2在子宫内膜癌中的表达为正相关关系(r=0.36)。
讨 论
HMGB1包含215个氨基酸残基,因其分子质量小,在聚丙烯酰胺凝胶电泳中有很高的迁移率而得名,是低分子量非组DNA结合蛋白。Fu等[5]经免疫组化及 Western blot分析证实,HMGB1在宫颈鳞癌组织中,尤其是发生转移的宫颈鳞癌组织中呈强阳性表达,可作为宫颈鳞癌浸润、转移及预后的重要判定指标之一。曾有研究结果表明,HMGB1的表达与肺癌组织病理类型和淋巴结转移相关,可作为肺癌转移、治疗和预后判断指标[6],马本红等[7]报道HMGB1在子宫内膜腺癌及癌前病变中表达明显高于正常子宫内膜,差异有统计学意义。本研究HMGB1在子宫内膜癌组织中阳性表达率为78.79%,不典型增生性子宫内膜组织中阳性表达率为55.56%。正常增生期子宫内膜中阳性率为25.00%,不典型增生子宫内膜和子宫内膜腺癌组织免疫组织化学染色阳性率明显高于正常内膜组织,差异显著,这与以上报道一致。这提示HMGB1可能参与了子宫内膜腺癌及癌前病变的发生和发展。
NF-κB是一种多向调节功能的转录因子,同时也是一个复杂的系统,蛋白家族成员较多,其中NF-κBp65表达于大多数恶性肿瘤,包括颈部肿瘤、消化道肿瘤、宫颈及乳腺癌等,与肿瘤的发生、发展有重要的联系[8,9]。严艳等[10]报道 NF-κBp65蛋白在子宫内膜样腺癌、不典型子宫内膜增生及正常增生期子宫内膜组织中的表达率分别为65.8%、36.70%和0.00%,子宫内膜样腺癌中NF-κBp65蛋白的表达率显著高于不典型增生子宫内膜,(P<0.05);我们通过免疫组化法检测核因子-κBp65,发现正常增生期子宫内膜均为阴性表达,不典型增生性子宫内膜中阳性表达率38.89%,与正常增生期子宫内膜组比较,差异有统计学意义(P<0.05);子宫内膜腺癌中阳性表达率为63.64%,与不典型增生性子宫内膜比较,差异有统计学意义(P<0.05)。推测NF-κBp65是子宫内膜癌早期被激活的一种癌蛋白,在子宫内膜癌的早期发挥重要调节作用,广泛参与许多基因的转录调控,在肿瘤的发生、发展中起着关键作用[11]。
Weigel等[12]研究认为与正常及异位的子宫内膜组织比较,子宫内膜癌组织中MMP-9蛋白表达明显增强。Di Nezza[13]研究结果发现 MMP2在正常子宫内膜组织及子宫内膜单纯增生组织中的表达率很低为13.6%,在子宫内膜癌组织中的表达率较之正常子宫内膜组织及子宫内膜单纯增生组织明显增高,为76.7%。本组研究显示,MMP2正常子宫内膜组织中的阳性表达率为8.33%,在不典型增生性子宫内膜组织中的阳性表达率为50.00%,66例子宫内膜癌患者MMP2的阳性表达率为71.21%。在由正常增生期子宫内膜一不典型增生内膜一子宫内膜癌形成的过程中MMP2的表达也呈现逐渐增高的趋势,其差别具有统计学意义,本文与上述文献报道基本一致。提示MMP2的检测可能作为子宫内膜癌早期诊断有价值的分子生物学指标。
HMGB1、NF-κBp65、MMP2之间表达的相关性结果表明:在子宫内膜癌组织中HMGB1与NF-κBp65呈正相关 (P<0.05),HMGB1的高表达伴NF-κBp65的高表达可能提示在子宫内膜组织细胞从正常到癌变的过程中,HMGB1的过表达可增加NF-κB活性,并导致NF-κB的靶基因产物与抗细胞调亡蛋白C-IAP的体外过表达。C-IAP2是一种抗细胞凋亡蛋白,可能是HMGB1激活核因子NF-κB的正调节产物,HMGB1和NF-κBp65共同参与了子宫内膜癌的发生和发展。从试验结果中看出:NF-κBp65与MMP2的表达在子宫内膜癌中也呈正相关,这与 Das[14]报道相符合,NF-κB可以诱导金属蛋白酶MMP2,提高细胞侵袭力,促进肿瘤侵袭、转移。HMGB1蛋白的表达与MMP2的表达在子宫内膜癌中也呈正相关,Volz[15]推测HMGB1发挥作用的方式为与其配体RAGE结合,激活了MAPK信号通路,从而导致细胞内骨架重组,并通过激活细胞外AKT等活性及核因子NF-κB等信号通路,使MMP-2和MMP-9活化,降解细胞外基质,从而促进肿瘤细胞的生长和转移。
总之,HMGB1、NF-κBp65、MMP2与子宫内膜癌的发生、发展密切相关,且在子宫内膜癌的转移、侵袭等活动中发挥重要作用。临床上能够在常规检测ER、PR 的同时,联合检测 HMGB1、NF-κBp65和MMP2,敏感度会明显增高,对于可疑癌早期诊断、判断子宫内膜癌的恶性程度及预测其转归有重要的临床意义。
图 版 说 明
图1 HMGB1在正常增生期子宫内膜中的阴性表达(SP×100)
图2 HMGB1在子宫内膜癌中的阳性表达(SP×100)
图3 NF-κBp65在不典型增生性子宫内的弱阳性表达(SP×100)
图4 NF-κBp65在子宫内膜癌中的阳性表达(SP×100)
图5 MMP2在正常增生期子宫内膜中的弱阳性表达(SP×100)
图6 MMP2在子宫内膜癌中的强阳性表达(SP×100)
EXPLANATION OF FIGURES
Fig.1HMGB1negative expression in normal proliferative endometrium,(SP×100).
Fig.2HMGB1in endometrium cancer compartment positive expression,(SP×100).
Fig.3The weak positive expression of NF-κBp65dysplasia temper in utero,(SP×100).
Fig.4NF-κBp65in endometrium cancer compartment masculine expression,(SP×100).
Fig.5MMP2weak positive expression in normal proliferative endometrium,(SP×100).
Fig.6MMP2strongly positive expression in endometrial carcinoma,(SP×100).

[1]Jemal A,Siegel R,Ward E,et al,Cancer statistics,2009.CA Cancer J Clin,2009,59(4):225-249
[2]Hogberg T,Signorelli M,Deoliveira,CF,et al.Sequential adjuvant chemotherapy and radiotherapy in endometrial cancer-results from two randomised studies.Eur J Cancer,2010,46(13):2422-2431
[3]张婷,夏敏.高迁移率族蛋白B1信号转导通路的研究进展.医学综述,2011,17(2):195-197
[4]Amalinei C,Cianga C,Balan R,et al.Immunohisto-chemical analysis of steroid receptors,proliferation markers,apoptosis related molecules,and gelatinases in non-neoplastic and neoplastic endometrium.Ann Anat,2011,193(1):43-55
[5]Fu X,Du X Q,Hao Q.Expression of HMGB1protein in human cervical squamous epithelium carcinoma.Chin J Clin Oncol,2008,5:53-57
[6]徐圣葆,梅晓冬.HMGB1、VEGF-C在肺癌组织中的表达及临床意义.山东医药,2009,12:50-51
[7]马本红,张贵宇,梁静等.高迁移率族蛋白B1在子宫内膜腺癌中的表达及意义.山东大学学报(医学版),2011,49(61):144-148
[8]Li T,Yang Y,Li X,et al.EGFR-and AKt-mediated reduction in PTEN expression contributes to tyrphostin resistance and is reversed by mTOR inhibition in endometrial cancer cell.Mol Cell Biochem,2012,361(1-2):19-29
[9]Bivona TG,Hieronymus H,Parker J,et al.FAS and NF-kB signalling modulate dependence of lung cancers on mutant EGFR.Nature,2011,471(7339):523-526
[10]严艳,史玉霞,刘铭球.子宫内膜样腺癌组织中NF-KB p65的表达.中华肿瘤防治杂志,2006,13(22):1734-1736
[11]吕坤聚,赵统,蒋悍东,NF-κB、VEGF在非小细胞肺癌中的表达及其与肿瘤血管形成的研究.中国组织化学与细胞化学杂志,2013,22(1):59-62
[12]Weigel MT,Kramer J,Schem C,et al.Differential expression of MMP-2,MMP-9and PCNA in endometriosis and endometrial carcinoma.Eur J Obstet Gynecol Reprod.Biol,2012,160(1):74-78
[13]Pathirage N,Di Nezza LA,Salmonsen LA,et al.Expression of aromatase,estrogen receptors,and their coactivators in patients with endometrial cancer.Fertil Steril,2006,86:469-472
[14]Das UN.Pyruvate is an endogenous anti-inflammatory and anti-oxidant molecule.Med Sci Monit,2006,12(5):RA79-84
[15]Volz HC,Kaya Z,Katus HA,et al.The role of HMGB1/RAGE in inflammatory cardiomyopathy.Semin Thromb Hemost,2010,36(2):185-194

