两种脂肪细胞内脂滴染色方法的比较研究
秦红霞 赵 玲 王宇豪 宁椿游 罗 毅
(四川农业大学动物医学院;1四川农业大学动物科技学院,雅安625014)
前脂肪细胞与体内脂肪沉积以及人类代谢性疾病密切相关[1,2],前脂肪细胞的分化过程一直是生物和医学领域中的研究热点。在前脂肪细胞分化为成熟脂肪细胞的过程中,细胞形态会发生一系列变化,前脂肪细胞首先由成纤维细胞样形状逐渐趋于类圆或圆形,胞体逐渐增大,胞质中开始出现小脂滴,随着分化的进展,胞质内的小脂滴逐渐增多,小脂滴逐渐地融合为较大的脂滴[3],细胞核被推向细胞的边缘,最终为成熟脂肪细胞的形态特征。细胞内脂滴的多少是判定脂肪细胞分化程度的重要指标。脂肪细胞内脂滴的染色有两种方法,即油红O染色和尼罗红荧光染色法。油红O染色法是国内外应用最广泛的一种方法,而国内有关尼罗红染色法用于鉴定脂肪细胞内脂滴的研究还非常有限。迄今为止,有关上述两种染色方法的比较研究仍未见报道。故本实验采用尼罗红染色和油红O染色法分别对脂肪细胞内脂滴进行染色,综合比较两种方法的优劣,旨在探讨科研工作中更优的脂滴染色方法。
材料和方法
1.材料
1.1细胞
3T3-L1前脂肪细胞(购自中国科学院细胞库)
1.2主要仪器
Varioskan全波长酶标仪(Thermo)、CO2培养箱、IX71倒置荧光显微镜(Olympus)、生物安全柜(Thermo)
1.3主要试剂
DMEM高糖培养基(Hyclone)、新生牛血清(Gibco)、油红O(上海生物工程公司)、尼罗红染液(Lonza)、胰岛素(Sigma)、地塞米松(Sigma)、IBMX(Sigma)、罗格列酮(Sigma)
2.方法
2.1 3T3-L1前脂肪细胞的诱导分化
采用经典的"鸡尾酒"法诱导前脂肪细胞,具体操作如下:将3T3-L1前脂肪细胞以5×103个/孔的密度接种于96孔板,待细胞完全融合后2d(此时为诱导分化的0d),换为含有170nM 胰岛素、0.5mM IBMX和1μM地塞米松的诱导分化培养液。2d后,吸弃培养液,加入含170nM胰岛素的维持培养液继续培养2d;其后,换为完全培养液继续培养,每2d换液一次,直至第8d。在细胞内甘油三酯定量检测过程中设立对照组与罗格列酮(RSG)处理组,每个处理组设六个重复。RSG处理组在细胞分化过程中全程加入RSG(终浓度1μM),对照组则加入同体积的PBS。
2.2油红O染色
将诱导分化至第8d的细胞培养板取出,弃去培养液,用0.01mM pH7.4的PBS轻轻洗涤2~3次;用10%Baker's福尔马林钙液固定细胞60min;吸弃固定液,用PBS清洗3遍;加入油红O染液于细胞表面,室温下染色30min;弃染液,并用PBS轻洗3次;将培养板置于倒置显微镜下观察结果,拍照。拍照结束后加入60μL/孔的异丙醇萃取脂滴中的油红O,室温放置20min,吸取萃取出的染液50μL/孔转移至洁净的96孔培养板中,于490nm处测定吸光度值,以相同的方法处理PBS对照组。
2.3尼罗红荧光染色
将诱导分化后8d的3T3-L1细胞取出,弃去培养液,用PBS(pH 7.4)漂洗后,每孔加入200μL PBS;在96孔细胞培养板中每孔加入5μL尼罗红染液,适当振荡。静置10min后,将96孔培养板放入全波长酶标仪中,于激发波长485nm,发射波长572nm下测定荧光强度。然后,将96孔培养板置于倒置显微镜下观察结果并拍照。
3.统计学处理
实验所得数据以mean±sd表示,用SAS 9.0统计软件对数据进行处理,采用t检验进行差异显著性分析。
结 果
1.脂滴的鉴定
当细胞分化至第8d,取出细胞置于倒置显微镜下观察,视野中富含大量类似液泡的圆形脂滴(图1A)。经油红O染色后,脂滴被亲脂的油红O着色成橘红色,从而证明视野中的圆形脂滴非液泡(图1B)。而细胞经尼罗红荧光染色后,经倒置荧光显微镜下观察,发现细胞内脂滴发出桔黄色荧光(图1C);而在明场下观察尼罗红染色后的脂滴则呈浅红色(图1D)。上述结果显示,油红O染色与尼罗红荧光染色均可鉴定脂肪细胞内脂滴的生成情况。
2.细胞内甘油三酯蓄积程度的测定
油红O萃取法和尼罗红荧光检测法均可定量检测细胞内甘油三酯的蓄积程度。为证明上述两种方法对检测结果是否一致,本实验在细胞分化过程中,设立了罗格列酮组和PBS组。罗格列酮是一种PPARγ激动剂,能显著促进细胞内甘油三酯的合成[8]。细胞内甘油三酯测定结果如图2所示,两种染色法检测结果均显示RSG组细胞内甘油三酯的含量均显著高于PBS组(P<0.05),检测结果一致。

图2 两种染色方法细胞中甘油三酯含量测定比较Fig.2Comparison of two staining methods for detection of intracellular triglyceride content
3.两种染色法区别
油红O染色法和尼罗红染色法的区别如表1所示。油红O染色法耗时较长,操作步骤繁琐,但对检测仪器要求不高。相反,尼罗红染色法耗时短,染色步骤简便,但需要能检测荧光信号的仪器设备。
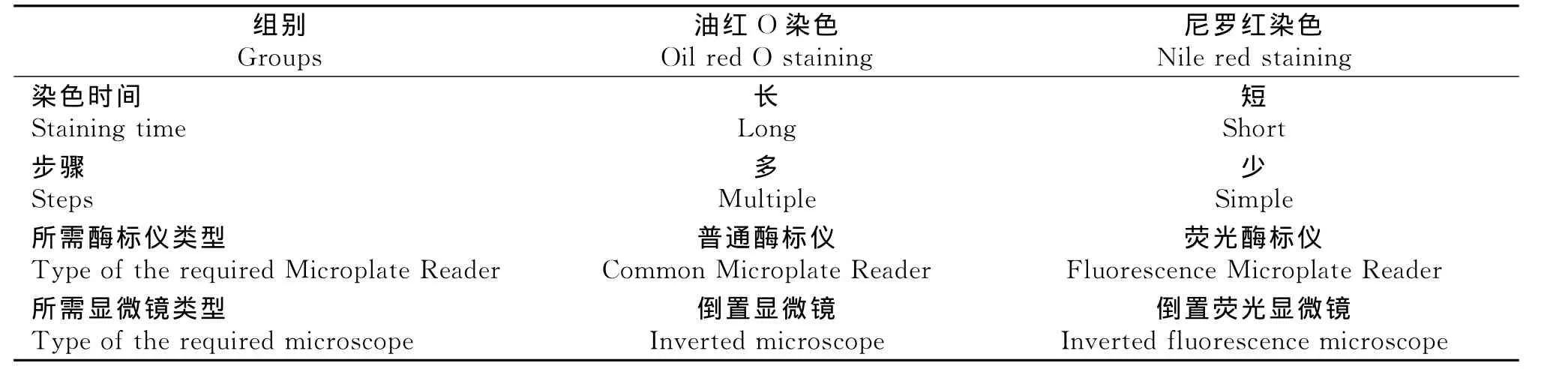
表1 油红O染色法和尼罗红染色法区别Table 1 Difference between Oil Red O staining and Nile Red staining
讨 论
细胞内脂滴的生成情况可判定脂肪细胞的分化程度。传统的脂滴鉴定和定量检测是通过油红O染色法进行的。油红O是一种红色的脂溶性染料,可与组织、细胞中的甘油三酯发生特异性结合,将脂滴染成橘红色。通过萃取脂滴中的油红O染料,再采用分光光度计检测OD值,OD值越大表明甘油三酯含量越高[4],所以该方法还可定量检测细胞内甘油三酯蓄积程度。尼罗红是一种亲脂性的恶嗪类荧光染料,能与细胞内中性甘油三酯结合发出荧光[5],其荧光强度与甘油三酯含量显著相关,故通过荧光显微镜以及荧光酶标仪能观察和测定甘油三酯的多少,从而考察脂肪细胞脂滴的生成情况。本实验结果与已有的文献[6-8]均显示两种染色法都可鉴定或定量检测脂肪细胞内甘油三酯蓄积程度。但油红O染色过程需要固定、洗涤、染色和再洗涤等过程,导致该方法操作过程较为繁琐、耗时较长,染料不易清洗干净,导致染料残留,从而出现实验误差,影响测定结果。与油红O染色法相比,尼罗红染色只需吸弃培养液,加入PBS和染料即可,操作简单、耗时短以及背景更洁净,实验的准确性更高。但尼罗红染色法的应用需要实验室装备荧光显微镜或能检测荧光信号的酶标仪。综合以上实验和论述,油红O染色法和尼罗红染色法用于研究细胞内脂滴的生成情况均能获得较为理想的实验结果,但为了提高实验的准确性,减少实验的误差,并具备实验条件的情况下,推荐采用尼罗红荧光染色法应用于脂肪细胞内脂滴的鉴定和定量测定。
[1]吕慈.脂肪因子Sfrp5与肥胖及其相关代谢紊乱的相关性研究.第三军医大学,2012:5-85
[2]陈瑾,周训伦,陈洁.前脂肪细胞分化与肥胖形成关系初探.中华中医药学刊,2007,25(4):735-736
[3]张高娜,梁正翠.动物脂肪细胞的研究进展.饲料工业,2009,30(2):42-44
[4]Choi BH,Ahn IS,Kim YH,et al.Berberine reduces the expression of adipogenic enzymes and inflammatory molecules of 3T3-L1adipocyte.Experimental & molecular medicine,2006,38(6):599-605
[5]Greenspan P,Mayer EP,Fowler SD.Nile red:a selec-tive fluorescent stain for intracellular lipid droplets.The Journal of cell biology,1985,100(3):965-973
[6]陈小宇,祝爱珍,刘成成等.川续断皂苷Ⅵ对3T3-L1细胞的增殖和分化影响.中国药理学通报,2013,29(8):1150-1154
[7]Xing Y,Yan F,Liu Y,et al.Matrine inhibits 3T3-L1 pre-adipocyte differentiation associated with suppression of ERK1/2phosphorylation.Biochemical and biophysical research communications,2010,396(3):691-695
[8]Toscani A,Soprano DR,Soprano KJ.Sodium butyrate in combination with insulin or dexamethasone can terminally differentiate actively proliferating Swiss 3T3cells into adipocytes.Journal of Biological Chemistry,1990,265(10):5722-5730

