牛支持细胞和成纤维细胞体外培养及pEGFP-N3转染
于娜,杨泽宇,2,林旭,李玉龙,赵洵武,张贵学*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.东北农业大学成栋学院,哈尔滨 150500)
牛支持细胞和成纤维细胞体外培养及pEGFP-N3转染
于娜1,杨泽宇1,2,林旭1,李玉龙1,赵洵武1,张贵学1*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.东北农业大学成栋学院,哈尔滨 150500)
试验以新生牛睾丸组织、牛胎儿皮肤组织为材料,进行支持细胞、成纤维细胞的分离、纯化、鉴定及pEGFP-N3载体转染。结果表明,完善犊牛支持细胞、胎牛皮肤成纤维细胞体外培养体系,细胞纯度可达95%。支持细胞在相同密度下较成纤维细胞能更快完成细胞生长指数期,生长迅速。转染pEGFP-N3载体后,初期EGFP均匀充满胞浆,后期EGFP向细胞核聚集,荧光强度明显高于细胞质中。转染后24、48、72 h,成纤维细胞转染效率高于支持细胞,转染pEGFP-N3的成纤维细胞和支持细胞在转染48 h后达到最大转染效率。转染后成纤维细胞的存活时间明显高于支持细胞,这与支持细胞生物学性质有关。
支持细胞;成纤维细胞;体外培养;pEGFP-N3载体
成纤维细胞以其生长快、体外培养性质稳定,成为转基因克隆动物的首选核供体[1]。睾丸支持细胞是构成血睾屏障主要成员,不仅能分泌多种生长因子、营养因子和免疫保护因子,还能发挥其免疫豁免功能,提高移植成活率[2]。因此,睾丸支持细胞在干细胞研究、细胞移植及核移植领域具有较大潜力。本试验对新生牛睾丸支持细胞和胎牛成纤维细胞进行体外培养并分析,利用脂质体转染法将真核表达质粒pEGFP-N3导入体外培养的支持细胞和成纤维细胞,对EGFP蛋白在细胞中表达作比较,探讨支持细胞、成纤维细胞生物学特性,为筛选转基因牛供体细胞提供理论和技术依据。
1 材料与方法
1.1 材料
真核表达载体pEGFP-N3(由东北农业大学动物遗传育种与繁殖实验室保存)。DMEM、胎牛血清(Gibco);胰蛋白酶(1∶250)、乙二胺四乙酸二钠(Amresco);PBS(无Ca2+,Mg2+PBS,Hyclone);L-谷氨酰胺、DMSO(Sigma);100×双抗、西班牙琼脂糖、胰蛋白酶、胰蛋白胨、酵母提取物、三羟甲基氨基甲烷(Tris)、DNA Marker、凝胶回收纯化试剂盒、质粒小量制备纯化试剂盒(索莱宝生物公司);dNTP、rTaq酶、感受态Top10(TaKaRa);Li⁃pofectamine™2000转染试剂(Invitrogen);苏木紫、伊红、油红O(武汉博士德公司);反转录试剂盒(ABI);无内毒素质粒小提试剂盒(Endo-free Plas⁃mid Mini KitⅡ,OMEGA)。
1.2 方法
1.2.1 支持细胞、成纤维细胞培养与纯化
新生牛放血致死后,用碘酒消毒下腹部,无菌取出双侧睾丸,剪去脂肪垫,用37℃生理盐水冲洗睾丸,然后置于4℃生理盐水中,2 h内送回实验室。胎牛取出后,碘酒消毒皮肤,无菌剪下背部皮肤,37℃生理盐水冲洗,然后置于4℃生理盐水中,2 h内送回实验室。
将新生牛睾丸用生理盐水洗净,剖去结缔组织膜,剪去睾丸白膜,加入少量PBS将组织剪成大小一致的小块,移入盛有PBS的新玻璃皿中拨散,去除血细胞和间质细胞,将曲细精管移入离心管中,加入10倍体积胶原酶Ⅳ,室温消化15 min,至曲细精管彼此分散开;加入5~10 mL PBS,1 000 r·min-1离心5 min,弃上清,重复消化步骤,离心后加入10倍体积0.25%胰酶消化液,室温消化10~15 min;加入等量基础培养液终止消化,1 000 r·min-1离心5 min,弃上清,用PBS重悬细胞,100 μm筛网过滤,离心后弃上清,将细胞沉淀用全培养液悬起,按一定接种密度分装培养瓶中,CO2培养箱中培养。参考李冬旭等[3]、于磊等[4]、郑鹏等[5-6]方法,采用差速贴壁分选支持细胞。
将胎牛皮肤用生理盐水冲洗干净,用手术刀刮去皮肤表面胎毛,加入少量PBS,剪碎组织,用PBS冲洗2~3次,将组织块转入离心管中,消化方法同上,采用不同胰酶消化时间分选成纤维细胞。
1.2.2 绘制细胞生长曲线
将细胞按照1~5×105个·孔-1,接种到24孔板上,以1、2、3、4、5、6和7 d为时间点,在每天同一时间消化3个孔细胞,台盼兰染色,细胞计数仪计数细胞总数、活细胞数、死细胞数、细胞活率。每3 d换1次全培养液,以时间为横坐标,以细胞数、细胞活率为纵坐标,绘制细胞生长曲线。
1.2.3 细胞染色体制备、鉴定和核型分析
取处于对数生长期的支持细胞和成纤维细胞,加入含0.2 μg·mL-1秋水仙素的DMEM/F-12细胞培养基,孵育4 h后,消化、离心、收集细胞。加入0.075 mol·L-1KCl低渗溶液室温处理30 min。Cannoy固定液固定(甲醇∶冰醋酸=3∶1),此固定液现用现配,预固定3 min后,重复固定2~3次,每次固定20 min。然后滴片、染色、显微镜下观察照相并进行核型分析。对支持细胞和成纤维细胞进行HE染色,油红O染色鉴定。
HE染色:细胞弃掉培养基后,利用PBS清洗3次;4%多聚甲醛固定15 min后再用PBS清洗3次;滴加苏木素溶液覆盖标本,染色12 min;自来水洗涤3次;95%酒精30 s;滴加伊红溶液覆盖标本,染色2 min;自来水洗涤3次;观察,照相。
油红O染色:弃掉培养基,PBS清洗3次;10%甲醛固定液,固定30 min;PBS清洗3次;蒸馏水清洗3次;烘箱干燥2 min;0.5%油红工作液,染色40 min;PBS清洗3次;观察,照相。
1.2.4 细胞转染效率、存活时间测定
采用阳离子脂质体介导方法,用除去内毒素的质粒pEGFP-N3转染牛胎儿成纤维细胞和新生牛睾丸支持细胞,以未转染的奶牛胎儿成纤维细胞和睾丸支持细胞作为阴性对照。转染试验在6孔板中进行,质粒样品转染重复6次。转染24、48、72 h后使用荧光显微镜观察EGFP表达情况,同时随机挑取20个视野(×400),分别计数细胞总数和转染阳性细胞数,以检测转染效率。加入适当浓度的G418进行筛选,观察细胞存活时间。
1.2.5 统计学处理
使用Excel 2003和CoStat软件进行统计分析,显著水平为P<0.05,数据以平均值±标准差表示。
2 结果与分析
2.1 支持细胞、成纤维细胞体外培养特性
睾丸支持细胞折光性强,细胞胞体伸展,其四周多有突起,形态不规则,此后胞质逐渐增大,折光性减弱,2~3 d铺满培养皿底壁。支持细胞传代后生长较快,约2 d即可增殖一代(见图1A)。胎牛皮肤成纤维细胞在1~24 h内逐渐贴壁,形状由圆形变成长梭形或多角形,胞质弱嗜碱性,胞核较大呈椭圆形,染色质疏松着色浅,核仁明显。为典型的成纤维细胞形态,大量细胞聚集时,呈现细线型和旋涡型生长,2~4 d可长满整瓶(见图1B)。

图1 细胞体外培养(×100)Fig.1 Cells culture in vitro(×100)
2.2 细胞生长曲线
支持细胞的总细胞数、活细胞数、死细胞数见图2A,细胞活率生长曲线见图2C。第1天细胞生长处于潜伏期,总细胞数、活细胞数、死细胞数处于最低水平;2~3 d细胞生长处于指数增长期,细胞快速增殖,第3天细胞活率、活细胞数达到最大,从第4天起,细胞活率下降,死细胞数快速增加。
胎牛皮肤成纤维细胞的总细胞数、活细胞数、死细胞数见图2B,细胞活率生长曲线见图2C。第1天细胞生长处于潜伏期,总细胞数、活细胞数、死细胞数处于最低水平;2~5 d细胞生长处于指数增长期,细胞快速增殖,第4天细胞活率达到最大,第5天细胞总数和活细胞总数达到最大,死细胞数在第7天增大到最大。
支持细胞和成纤维细胞在体外培养时,都存在短暂的潜伏期,进入对数生长期,之后进入平台期,生长曲线类似S型,符合体外培养细胞正常生长增殖规律。支持细胞在相同密度下较成纤维细胞能更快的进入细胞生长指数期,生长迅速。
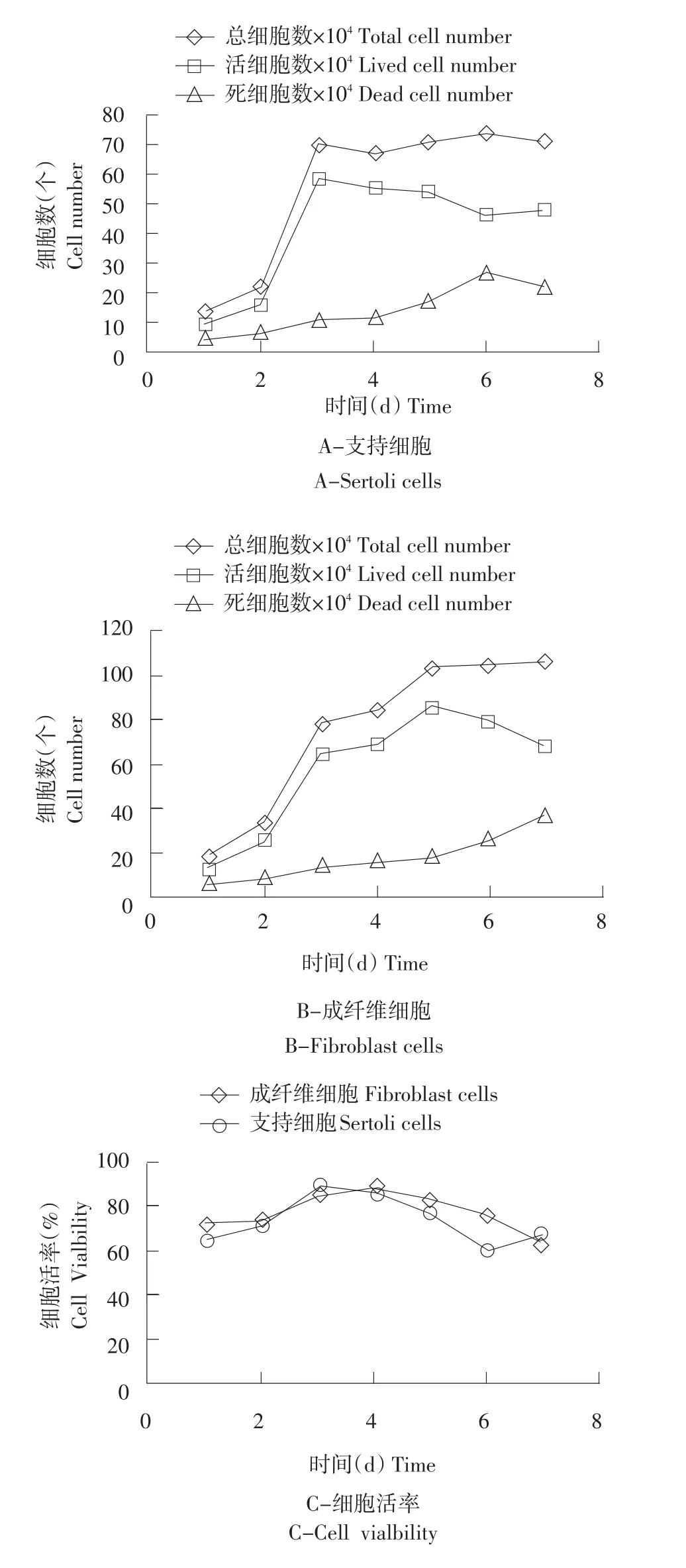
图2 细胞生长曲线Fig.2 Cells growth line
2.3 染色体核型分析
对支持细胞和成纤维细胞染色体核型进行检测,结果表明体外培养的睾丸支持细胞和成纤维细胞均含有正常的二倍体核型,共计60条染色体(见图3)。
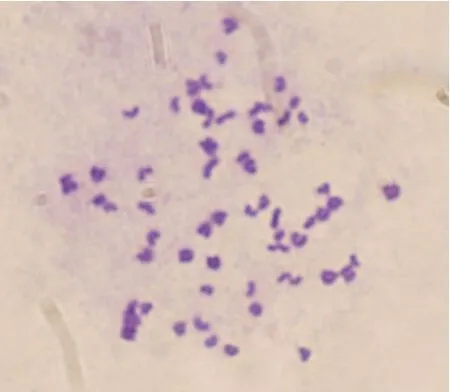
图3 细胞染色体核型分析(×1000)Fig.3 Karyotype analysis(×1000)
2.4 细胞鉴定
HE染色结果表明,成纤维细胞呈长梭形,胞质染色较淡,而细胞核染色较深,呈圆形或椭圆形位于细胞质中央或偏位(见图4A)。支持细胞形态不规则,胞质完全铺开,染色较淡,而细胞核染色较深,呈圆形或椭圆形位于细胞质中央或偏位,核仁明显(见图4B)。油红O染色表明,油红O染色可见成纤维细胞不能被染色(见图4C),支持细胞核周围分布的许多圆形或卵圆形的脂质小滴呈红褐色,而细胞其他部分不着色(见图4D)。
2.5 细胞转染形态学观察及转染后EGFP表达效率
荧光显微镜下观察真核表达载体pEGFP-N3转染胎牛成纤维细胞和新生牛睾丸支持细胞,转染细胞均有荧光表达(见图5)。

图4 细胞鉴定(×200)Fig.4 Identification of cells(×200)
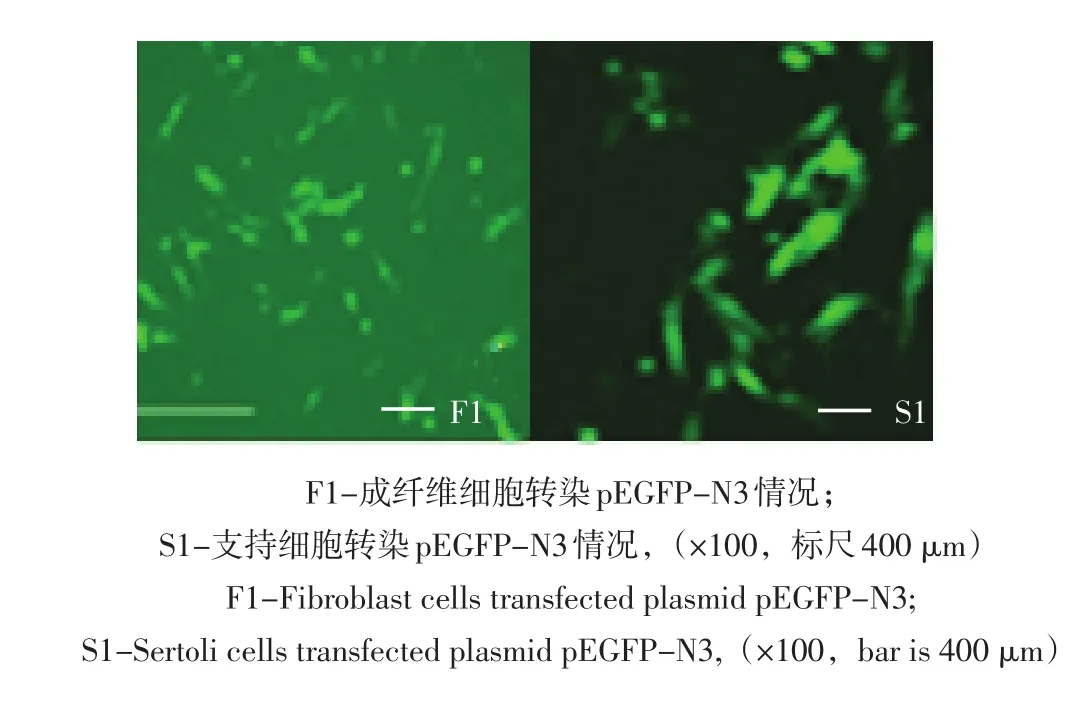
图5 不同时间转染效率的荧光观察Fig.5 Observation of the cells transfection effciency
pEGFP-N3质粒转染犊牛睾丸支持细胞和胎牛成纤维细胞后初期EGFP大多均匀地充满胞浆(见图6-1),个别细胞EGFP充满整个细胞(见图6-2),后期随着细胞分裂生长,EGFP向细胞核聚集(见图6-3),在细胞核中出现的比例越来越大且荧光强度明显高于细胞质中(见图6-4)。
图7表明,转染24、48、72 h后,成纤维细胞转染效率都高于支持细胞,二者差异显著(P<0.05);转染pEGFP-N3的成纤维细胞在转染48 h后达到最大转染效率29.69%±1.32%,转染效率明显高于转染24和72 h,差异显著(P<0.05),转染pEGFP-N3的支持细胞在转染48 h后达到最大转染效率9.62%± 0.12%,转染效率与转染24和72 h相比,差异显著(P<0.05)。
图8表明,转染后成纤维细胞存活时间可达到(47.5±4.62)d,明显高于支持细胞存活时间(23.5± 3.94)d,二者差异显著(P<0.05)。
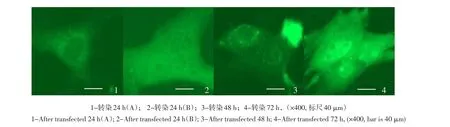
图6 转染pEGFP-N3-HNP1质粒荧光蛋白EGFP表达情况(×400)Fig.6 Observe of the EGFP fluorescence expresstion at different times(×400)
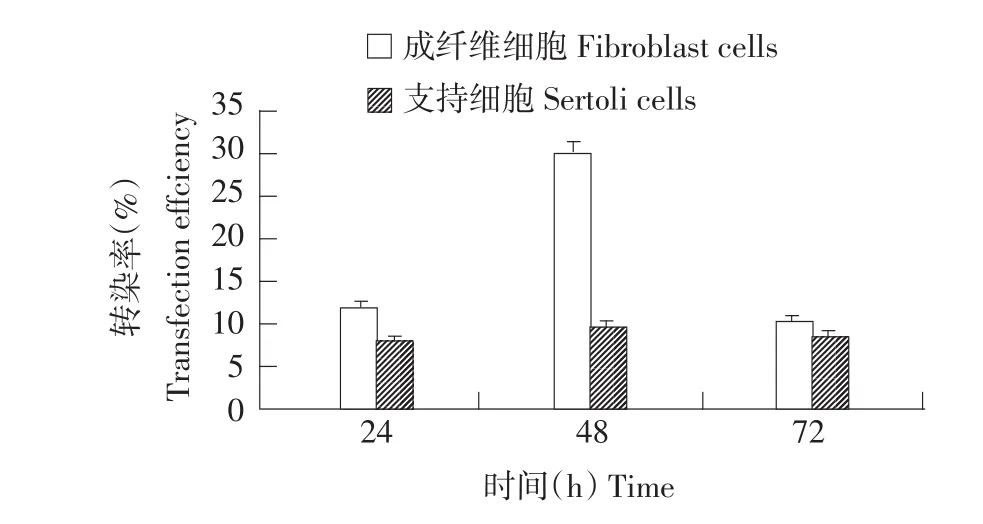
图7 不同时间细胞转染效率Fig.7 Cells transfection effciency in different time
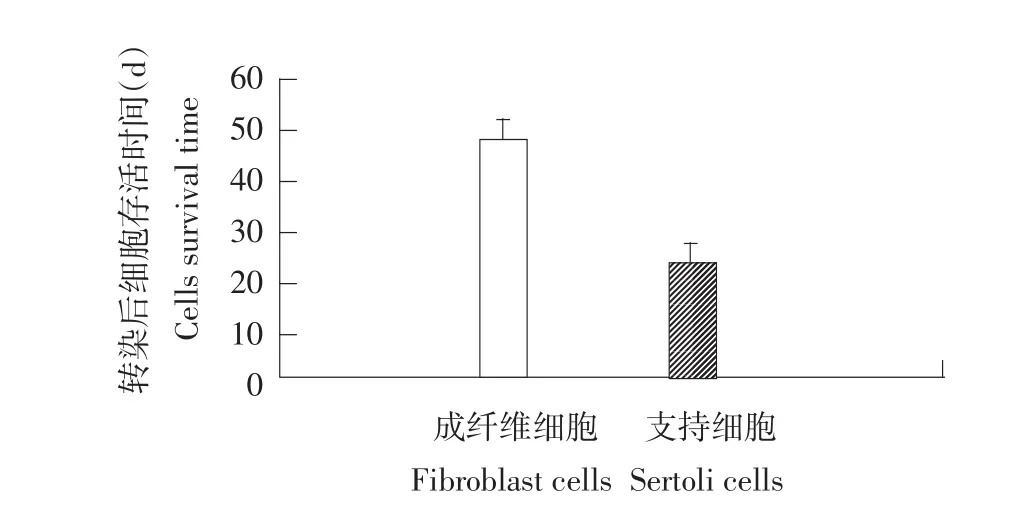
图8 细胞存活时间Fig.8 Transfection effeciency to cells survival time
3 讨论与结论
犊牛睾丸支持细胞是研究雄性动物血睾屏障的良好研究体系,关于EGFP转染犊牛睾丸支持细胞分布及效率研究较少见。试验结果显示初期EGFP均匀充满胞浆,后期EGFP向细胞核聚集,在细胞核的荧光强度明显高于细胞质中。质粒pEGFP-N3含有高效功能强大的启动子SV40和PC⁃MV,具有很强复制能力,大量复制,然后pEG⁃FP-N3被进入细胞核转录mRNA,mRNA出细胞核进入细胞质进行蛋白质合成,因此,初期主要分布在细胞质中,在核膜周围富集。随着转染时间推移和细胞分裂,EGFP在细胞核内富集,似乎EGFP倾向于细胞核内富集。pEGFP-N3质粒转染48 h的转染效率显著高于24和72 h的细胞,表明pEGFP-N3质粒转染犊牛睾丸支持细胞和胎牛成纤维细胞的效率与细胞生长期有关,生长48 h的犊牛睾丸支持细胞和胎牛成纤维细胞,可能由于其正处于生长对数期,包括EGFP在内的蛋白质合成较为活跃,因而EGFP表达较高,72 h时EGFP表达情况变化不大,但由于未转染的细胞较阳性细胞生长快速,细胞总数增加,造成72 h时,细胞转染效率反而低于48 h。
转染24、48、72 h后,转染pEGFP-N3的成纤维细胞转染效率都高于支持细胞,显然,支持细胞抗转染能力高于成纤维细胞。由图8可知,转染后,成纤维细胞存活时间明显高于支持细胞存活时间,显然细胞内外源蛋白对支持细胞伤害比成纤维细胞大。这与支持细胞特殊生理功能密不可分。哺乳动物的曲细精管腔主要由睾丸支持细胞组成,相邻支持细胞基底部、血管内皮基膜、结缔组织和曲细精管基膜牢固紧密连接形成血睾屏障,血睾屏障能阻止外来的抗原进入睾丸[7],推测支持细胞有较强的抗转染能力。一旦外源蛋白进入细胞,支持细胞分泌各种炎症因子[8],引起炎症反应,推测进入细胞内的外源蛋白对支持细胞伤害比成纤维细胞大。影响细胞转染效率的因素很多,如EGFP基因表达随DNA、脂质体量增加而增加,延长细胞暴露时间反而使转染效率下降,转染细胞数适当时转染效率较高[9]。在今后研究中,可根据上述影响外源基因转染效率的参数进一步优化pEG⁃FP-N3质粒转染犊牛睾丸支持细胞和胎牛成纤维细胞的条件,为开展目标蛋白质在犊牛睾丸支持细胞和胎牛成纤维细胞中的功能研究提供理论依据。
本试验结果表明,完善犊牛支持细胞、胎牛皮肤成纤维细胞体外培养体系,转染pEGFP-N3载体后,细胞48 h转染效率最高,初期EGFP均匀地充满胞浆和胞核,后期EGFP向细胞核聚集,在细胞核处荧光强度明显高于细胞质中。支持细胞抗转染能力高于成纤维细胞,转染后存活时间低于成纤维细胞,这可能和支持细胞特性有关。
[1]邵晓云,徐绍业.水牛胎儿成纤维细胞体外培养体系的初步建立[J].四川动物,2010,29(2):288-291.
[2]余晓晖,胡云飞.睾丸支持细胞的生物学特性及研究进展[J].中国组织工程研究与临床康复,2010,14(44):8311-8314.
[3]李冬旭,郑鹏,于磊,等.新生牛睾丸生殖细胞体外培养[J].繁殖生理,2011,47(13):29-31.
[4]于磊,郑鹏,荣恩光,等.新生牛睾丸支持细胞的体外培养及鉴定分析[J].吉林农业大学学报,2013,35(1):63-66.
[5]郑鹏,李冬旭,田亚光,等.新生牛睾丸细胞的分离纯化与冷冻保存[J].东北农业大学学报,2010,41(2):96-100.
[6]郑鹏,于磊,田亚光,等.新生牛雄性生殖干细胞的分离纯化与培养[J].东北农业大学学报,2012,43(12):32-38.
[7]Arambepola N K,Bunick D,Cooke P S.Thyroid hormone and fol⁃licle-stimulating hormone regulate Müllerian-inhibiting sub⁃stance messenger ribonucleic acid expression in cultured neona⁃tal rat sertoli cells[J].Endocrinology,1998,139(11):4489-4495.
[8]Koji T.Male germ cell death in mouse testes:Possible involve⁃ment of fas and fas ligand[J].Med Electron Microsc,2001,34(4): 213-222.
[9]Li Y,Wu K.Optimization of Parameters of exogene ransfection of bovine fetal fibroblasts in vitro mediated by Liposome[J].Heredi⁃tas,2002,24(6):653-655.
Bovine sertoli cells and fibroblast cells culturein vitroand their transfection with the plasmid pEGFP-N3
YU Na1,YANG Zeyu1,2,LIN Xu1,LI Yulong1, ZHAO Xunwu1,ZHANG Guixue1(1.School of Animal Science and Technology,Northeast Agricultural University,Harbin 150030,China;2.School of Chengdong,Northeast Agricultural University,Harbin 150500,China)
The newborn calf testicles and embryo skin were used in this experiment,the sertoli cells and fibroblast cells were transfected with the plasmid pEGFP-N3 by Liposome-mediated.The results showed that the purity of the cells was up to 95%.The early EGFP was evenly filled in cytosol after transfection.Later,EGFP was gathered in the nucleus and the fluorescence intensity in the nucleus became more higher in the cytoplasm.The results showed that transfection efficiency of fibroblast cell was higher than sertoli cells.The transfection efficiency of fibroblast cells and sertoli cells was significantly different after transfection at 24,48 and 72 h.Both cells got the highest transfection efficiency at 48 h.After transfecting, the life of fibroblast cells was obviously longer than sertoli cells.It may be due to the inimitable physiological function of sertoli cells and high tansfectiion efficiency of fibroblasts.
fibroblast cells;sertoli cells;in vitroculture;pEGFP-N3 plasmid
S823.3
A
1005-9369(2014)09-0089-06
2014-02-04
黑龙江省农业科学院博士基金项目(LRB04-185)
于娜(1982-),女,博士,研究方向为动物遗传育种与繁殖。E-mail:yuna1982_2003@163.com
*通讯作者:张贵学,教授,博士生导师,研究方向为动物繁殖。E-mail:gxzhang@neau.edu.cn
时间2014-9-18 10:42:53[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140918.1042.005.html
于娜,杨泽宇,林旭,等.牛支持细胞和成纤维细胞体外培养及pEGFP-N3转染[J].东北农业大学学报,2014,45(9):89-94.
Yu Na,Yang Zeyu,Lin Xu,et al.Bovine sertoli cells and fibroblast cells culturein vitroand their transfection with the plasmid pEGFP-N3[J].Journal of Northeast Agricultural University,2014,45(9):89-94.(in Chinese with English abstract)

