三种IBV检测方法比较研究
潘龙,李广兴*,聂思静,蔡皓璠,李兰兰
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江职业学院农牧工程系,哈尔滨 150080)
三种IBV检测方法比较研究
潘龙1,李广兴1*,聂思静1,蔡皓璠2,李兰兰1
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江职业学院农牧工程系,哈尔滨 150080)
IBV属于冠状病毒γ群,可引起鸡呼吸道疾病,对IBV诊断方法研究广泛,建立多种方法,而噬菌体展示技术广泛用于蛋白质研究中。使用分子生物学技术和噬菌体展示技术筛选到能与IBV S1蛋白特异性结合噬菌体建立三种IBV检测方法,Real-Time PCR、RT-PCR和噬菌体ELISA。结果表明,三种方法都可有效检测出传染性支气管炎病毒(IBV),证明三种方法可靠性,对这三种方法的灵敏性进行比较,敏感性上实时Real-Time PCR法最敏感,依次为RT-PCR和噬菌体ELISA技术,检测极限分别为7.64×101、7.64×103、1.21×105copies·μL-1,证明筛选的IBV S1蛋白特异性亲和噬菌体可用于IBV病毒诊断,具有较高特异性和敏感性,为IBV诊断提供新方法。Real-Time PCR、RT-PCR和噬菌体ELISA三种方法各具特点,可满足不同检测需要。
IBV;Real-time PCR;RT-PCR;噬菌体ELISA
鸡传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis vi⁃rus,IBV)引起鸡急性、高度接触传染性、病毒性呼吸道疾病。IBV损害肾脏和生殖系统,引起雏鸡死亡、蛋鸡产蛋量和蛋品质下降[1],由于IBV经常和其他病毒和细菌同时发生,常引起混合感染和继发感染。
IBV属于冠状病毒科(Coronaviridae),冠状病毒属(Coronavirus),γ冠状病毒群,为外被囊膜单股正链RNA病毒。病毒基因组由单股不分节段的正链RNA组成,长约27.6 kb。含四种结构蛋白,即纤突(Spike,S)糖蛋白、核(Nucleocapsid,N)蛋白、膜(Membrane,M)糖蛋白和小膜(Small envelope,E)糖蛋白。
鸡传染性支气管炎病毒血清型复杂[2],不同血清型间抗原性差异较大,存在特殊遗传变异方式,因此不易诊断[3]。快速准确检测IBV对其进行诊断,成为预防和控制传染性支气管炎关键。目前常规检测IBV技术主要有病毒分离、血清学试验和分子生物学试验等方法[4]。本试验建立荧光定量PCR(Real time PCR),RT-PCR(Reverse transcrip⁃tion PCR)和噬菌体ELISA三种IBV检测方法,并进行比较研究,评价三种方法优缺点,为IBV临床诊断提供参考依据。
1 材料与方法
1.1 荧光定量PCR引物设计、合成
根据传染性支气管炎病毒Beaudett株(GenBank中登录号为AJ311317)的N基因序列,利用Oli⁃go6.0软件设计一对引物。上游引物p1(5'GAA⁃CAGGACCAGCCGCTAA 3'),下游引物p2(5'GAG⁃GAATGAAATCCCAACG 3'),扩增片段189 bp,由哈尔滨博仕生物技术服务有限公司合成。
1.2 病毒和噬菌体
传染性支气管炎病毒Beaudett株由东北农业大学动物医学学院病理解剖教研室保存,新城疫病毒(NDV)、传染性喉气管炎病毒(ILTV)、传染性法氏囊病毒(IBDV),禽流感病毒抗原(AIV)均为疫苗株,IBV S1蛋白结合噬菌体由东北农业大学动物医学学院病理解剖教研室淘选保存,测定的氨基酸序列为HWDPFSLSAYFP。
1.3 病毒RNA提取和cDNA合成
参照TRIzol试剂(Invitrogen公司)使用说明书提取病毒总RNA,提取的总RNA溶于10 μL无RNA酶的dH2O中,反转录参照TAKARA公司M-MLV反转录说明书进行,得到cDNA-20℃备用。
1.4 阳性标准品制备
将病毒培养物反复冻融3次,离心取上清,按上述方法提取总RNA,按以上条件反转录,PCR反应体系25 μL:上下游引物1 μL,dNTPs 2 μL,10×Buffer 2.5 μL,cDNA 2 μL,ExTaqTM DNA聚合酶0.25 μL,ddH2O 16.5 μL;反应条件:95℃预变性5 min;变性:94℃30 s;退火:55℃30 s;延伸:72℃30 s,30个循环,最后再72℃延伸10 min。RT-PCR产物经琼脂糖凝胶电泳鉴定,回收目的DNA片段,将目的片段与pMD18-T载体16℃连接过夜,转化JM109感受态细胞,经质粒PCR鉴定阳性命名为pMD-N1,nano2000紫外分光光度计测定浓度,根据公式:(6.02×1023copies·mol-1)×(浓度g·μL-1)/(MW g·mol-1)=copies·μL-1计算其拷贝数,置-20℃备用。
1.5 荧光定量PCR方法建立
1.5.1 荧光定量PCR反应条件建立
开始10倍梯度稀释质粒pMD-N1标准品进行Real-time PCR扩增,反应体系为20 μL:5×Gold⁃en HS SYBR Green qPCR Mix 4 μL,50×ROX Refer⁃ence Dye 0.4 μL,上下游引物(10 μmol·L-1)各0.5 μL,DNA模板1 μL,ddH2O Up to 20 μL。反应条件使用两部法:Stage 1:95℃15 min;Stage 2:95℃10 s,60℃30 s;每个循环退火延伸结束时检测荧光信号,共40个循环,绘制标准曲线。
1.5.2 敏感性试验
将质粒标准品经10倍梯度稀释浓度从108到1 copies·μL-1,按上述体系进行Real-time PCR反应,确定检测病毒最小拷贝数,同时用常规RTPCR进行扩增,扩增产物用琼脂糖凝胶电泳鉴定。
1.5.3 特异性试验
对传染性支气管炎病毒(IBV)、新城疫病毒(NDV)、传染性法氏囊病毒(IBDV)、禽流感病毒(AIV)、传染性喉气管炎病毒(ILTV),分别取等量样品提取病毒RNA(或DNA),后用随机引物反转录,采用所建立的IBV Real-time PCR方法进行检测。
1.5.4 重复性试验
为评估Real-time PCR检测方法组内和组间试验的重复性、稳定性,应用10倍梯度稀释标准品进行Real-time PCR检测,各取5个浓度重复3次,依据检测结果计算Ct平均值和变异系数(CV),通过CV评价试验稳定性。
1.6 噬菌体ELISA诊断方法建立
1.6.1 抗原的最佳工作量
用碳酸盐缓冲液稀释IBV病毒Beaudette株,1∶10~640倍稀释,包被反应板,每孔100 μL。按常规程序测定阴、阳性噬菌体浓度,试验用噬菌体投入1∶10倍稀释,M13多抗1∶1 000,酶标抗体1∶5 000倍稀释,其他按常规步骤进行测定。
1.6.2 封闭液浓度
使用1%、3%、5%BSA封闭液,封闭1 h,选择P/N值最高,且P值接近1的浓度为最佳封闭浓度。
1.6.3 最佳M13抗体稀释度及工作时间确定
将M13噬菌体多抗1∶500、1∶1 000、1∶2 000倍稀释,作用时间分别为1 h,其他按常规步骤进行测定。
1.6.4 酶标二抗的最佳稀释度、作用时间及显色时间确定
酶标二抗1∶3 000、1∶4 000、1∶5 000、1∶6 000倍稀释,采用不同作用时间,其他按常规步骤进行。
1.6.5 特异性试验
将传染性法氏囊病毒、新城疫、禽流感、传染性支气管炎、传染性喉气管炎等禽病病原,病毒滴度均>105EID50,做10-1~10-8倍稀释,用建立的噬菌体ELISA方法确定诊断方法特异性。
2 结果与分析
2.1 标准品制备
通过RT-PCR扩增除IBV Beaudett株N基因目的片段,长度为189 bp,连接pMD18-T载体后进行鉴定,证明所克隆的基因为IBV Beaudett株N基因。提取pMD18-N质粒经DNA经紫外分光光度计测定结果为:质粒浓度为235 ng·μL-1,根据公式换算成拷贝数为7.64×1010copies·μL-1。
2.2 荧光定量PCR方法建立
2.2.1 荧光定量PCR标准曲线建立
IBV S1基因扩增产物进行琼脂糖凝胶电泳鉴定,大小为189 bp(见图1)。通过Real-time PCR,得到检测IBV扩增曲线(见图2)和标准曲线(见图3)。IBV Real-time PCR标准品具有良好的线性关系(相关系数R2=0.9995;扩增效率E=101.99)熔解曲线为单一峰值。

图1 IBV-N基因RT-PCR产物电泳图谱Fig.1 Electropherogram of IBV-N

图2 Real-time PCR扩增曲线Fig.2 Dynamic curve of Real-time PCR
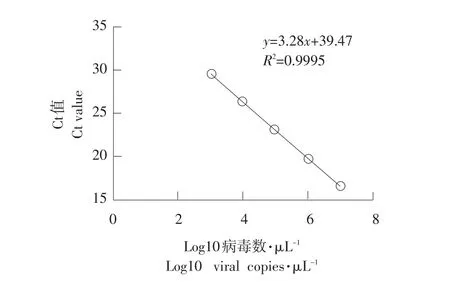
图3 Real-time PCR标准曲线Fig.3 Standard curve of Real-time PCR
2.2.2 荧光定量PCR的敏感性
经过检测,确定Real-time PCR检出的最低限为7.64×101copies·μL-1,常规RT-PCR检测极限为7.64×103copies·μL-1(见图4)。
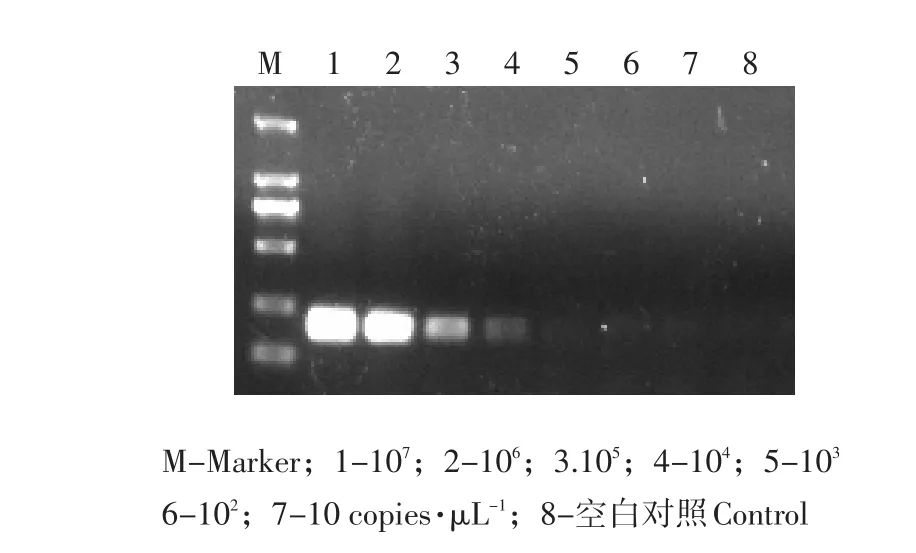
图4 常规PCR灵敏度检测Fig.4 Sensitivity of PCR detection
2.2.3 荧光定量PCR的特异性
根据熔解曲线的结果表明,只有IBV才能扩增出特异性峰值,而对其他禽源病毒(NDV、ILTV、IBDV、AIV)检测结果未扩增出特异性峰值,均为阴性(见图5)。
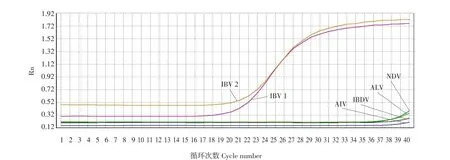
图5 Real-time PCR的特异性结果Fig.5 Specificity of Real-time PCR
2.2.4 荧光定量PCR的重复性
荧光定量PCR的重复性见表1。
取5个10倍梯度稀释的标准品分别做3个批内重复和批间重复试验,将试验结果进行统计分析,批内变异系数(CV0)0.1%~0.8%,批间变异系数(CV)0.7%~1.6%。

表1 荧光定量PCR的重复性Table 1 Reproducible of Real-time PCR
2.3 噬菌体ELISA检测方法的建立
2.3.1 噬菌体最佳工作量的确定
将IBV抗原以1∶10倍稀释包被ELISA板,噬菌体1∶20、1∶40、1∶80、1∶160倍稀释时,P/N分别为1.79、2.12、1.83、1.38,确定P/N最大,且P值接近1的为最佳稀释浓度,同时将1∶40倍的噬菌体进行滴度测定,确定最佳的噬菌体投入量为4×1011个·孔-1。
2.3.2 最适封闭液及封闭时间的确定
使用含1%、3%、5%BSA PBST封闭后的P/N值分别为3.17、3.56、3.30,确定最适封闭液为含3%BSA的PBST。
2.3.3 最佳M13抗体稀释度及工作时间的确定
M13噬菌体多抗最佳稀释度P/N分别为3.13、3.71、3.65,最佳作用时间P/N分别为2.98、3.73、 3.70,确定最佳M13抗体稀释度为1∶1 000,作用时间为1 h。
2.3.4 酶标二抗稀释度及工作时间的确定
酶标二抗稀释度的P/N值分别为3.59、3.79、3.42、3.39,作用30、60、90 min,测得P/N值分别为2.56、3.81、3.49。依据以上结果,选择1∶4 000作为二抗最佳稀释度;1 h作为最佳作用时间。
2.3.5 交叉试验
应用建立起的噬菌体ELISA诊断方法,对鸡传染性法氏囊病毒、新城疫、禽流感、鸡传染性支气管炎、鸡传染性喉气管炎等病毒进行检测,10-4倍稀释时P/N仍然>2,证明该诊断方法与上述病毒交叉反应弱,特异性比较强,用Real-time PCR测定原始病毒液中IBV病毒的拷贝数,计算10-4倍稀释时的拷贝数为1.21×105copies·μL-1(见图6)。
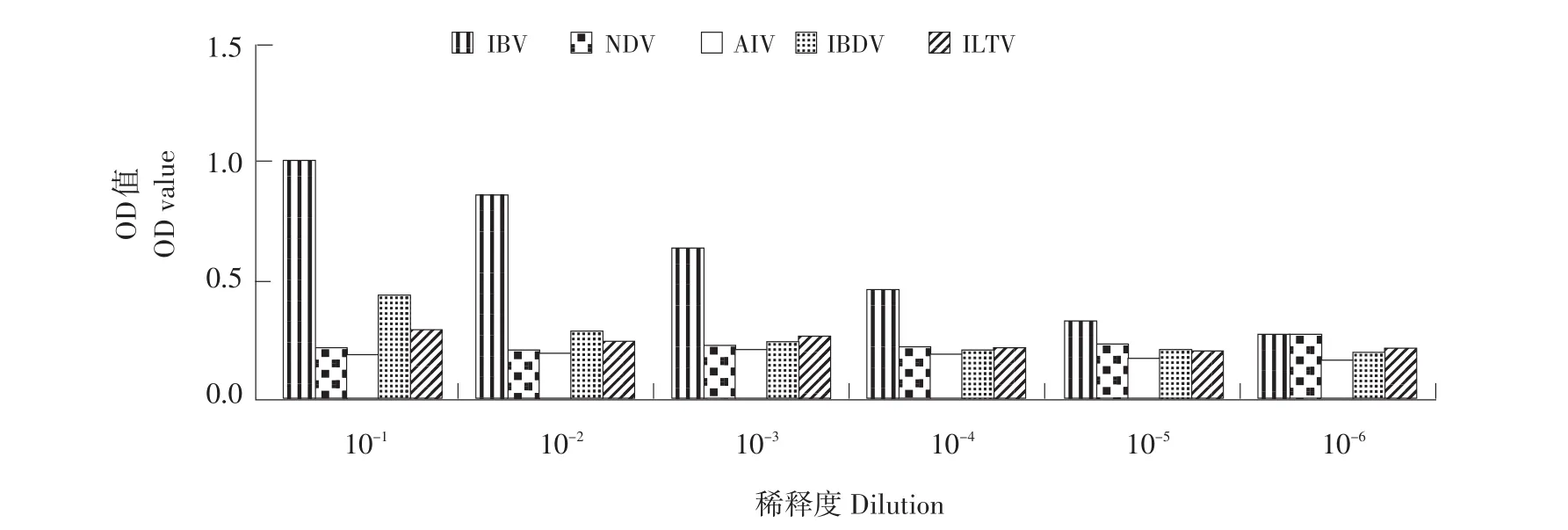
图6 噬菌体ELISA检测方法的敏感性试验Fig.6 Phage ELISA of the sensitivity of the detection method
3 讨论与结论
Real-time PCR技术具有自动化程度高,反应快速、重复性好、灵敏度高、特异性强、结果清晰等特点,可精确到几个拷贝数,广泛应用于各种传染病诊断和疗效评价,肿瘤标志物及瘤基因检测实现肿瘤病诊断、遗传基因检测实现遗传病诊断[5]。应用于动物疾病检测禽流感、新城疫、口蹄疫、猪瘟、沙门菌、大肠埃希菌等诊断,在食品安全领域广泛,也是相关分子生物学研究中进行定量研究重要方法,随着生物芯片技术和荧光探针定量技术结合,Real-time PCR在医学检测及其他各个领域中应用前景更加广阔。
相对于Real-time PCR技术,RT-PCR技术历史更长,其检测灵敏程度无Real-time PCR高,但其在设备投入和成本方面具有优势,可进行大量样本检测,受样本保存时间影响小[6],而ELISA技术由于其对设备要求低,易于操作,不需要昂贵的实验设备可以广泛应用于基层现场的病原检测,特别是对新鲜病原材料检出率高[7]。
噬菌体展示技术作为新兴研究方法和工具,在研究蛋白质结构上已被广泛应用,已开发出单链丝状噬菌体展示系统、λ噬菌体展示系统、T4噬菌体展示系统等数种噬菌体展示系统。噬菌体展示技术具有高通量淘选、模拟表位筛选、易于纯化等显著优点[8]。
本试验在建立Real-time PCR法时构建重组质粒作为标准品直接将待检目的片断克隆到T载体中,最大限度保证标准品与检测样品间扩增效率一致性。建立扩增曲线和标准曲线具有良好线性
关系(相关系数R2=0.9995;扩增效率E=101.99)。特异性试验结果由熔解曲线分析显示与其他禽源病毒不发生交叉反应,在40个循环内无引物二聚体等非特异扩增,表明该方法具有高度稳定性。重复性试验结果变异系数批内为0.1%~0.8%,批间为0.7%~1.6%,表明该方法具有良好重复性。该方法可检测到初始模板中7.64×101copies·μL-1病毒核酸,而常规RT-PCR检测极限为7.64×103copies·μL-1,敏感性高于常规RT-PCR 100倍,与其他研究结果相同[9]。噬菌体展示技术在病毒学研究中发挥重要作用[10],可用于病毒受体研究[11-12],筛选的特异性噬菌体也可用于病原诊断[13],本试验所建立的噬菌体ELISA法在10-4稀释时能特异性检测到IBV病毒,具有较高特异性,证明所筛选具有特异性结合能力噬菌体在病原诊断领域应用前景良好,所建立三种方法可靠性稳定,检测敏感性顺序为Re⁃al-time PCR、RT-PCR和噬菌体ELISA,可根据需要选择不同的检测方法,当检测样品数量很大时可优先选择RT-PCR法,而在检测新鲜病料时,可选用噬菌体ELISA法,该法操作更简便,特别适合在试验条件较差基层初步筛使用。
[1]Lim T H,Lee H J,Lee D H,et al.An emerging recombinant clus⁃ter of nephropathogenic strains of avian infectious bronchitis virus in Korea[J].Infect Genet Evol,2011,11(3):678-685.
[2]Worthington K J,Currie R J,Jones R C.A reverse transcrip⁃tase-polymerase chain reaction survey of infectious bronchitis vi⁃rus genotypes in Western Europe from 2002 to 2006[J].Avian Pathol.2008,37(3):247-257.
[3]Ji J,Xie J,Chen F,et al.Phylogenetic distribution and predomi⁃ nant genotype of the avian infectious bronchitis virus in China during 2008-2009[J].Virol J,2011(8):184.
[4]李中华,史惠,周毅,等.鸡传染性支气管炎实验室诊断方法研究进展[J].动物医学进展,2008(1):95-99.
[5]朱捷,杨成君,王军.荧光定量PCR技术及其在科研中的应用[J].生物技术通报,2009(2):73-76.
[6]刘思国,江国托,康丽娟,等.PCR方法快速检测鸡传染性支气管炎病毒[J].动物医学进展,1999(3):30-33.
[7]黄溢泓,韦正吉,李志源,等.五种禽呼吸道病病原多重PCR检测方法的建立和应用[J].中国兽医科学,2010(2):164-168.
[8]Smith G P.Filamentous fusion phage:Novel expression vectors that display cloned antigens on the virion surface[J].Science, 1985,228(5):1315-1317.
[9]刘乔然,刘胜旺.鸡传染性支气管炎病毒Real-time PCR方法的建立及其对感染鸡体内病毒的检测[J].中国预防兽医学报. 2008(8):637-641.
[10]Sun E C,Zhao J,Yang T,et al.Identification of a conserved JEV serocomplex B-cell epitope by screening a phage-display peptide library with a mAb generated against West Nile virus capsid pro⁃tein.[J].Virol J,2011(8):100.
[11]Moreland N J,Susanto P,Lim E,et al.Phage display approaches for the isolation of monoclonal antibodies against dengue virus en⁃velope domainⅢfrom human and mouse derived libraries[J].Int J Mol Sci,2012,13(3):2618-2635.
[12]Xue M,Shi X,Zhang J,et al.Identification of a conserved B-cell epitope on reticuloendotheliosis virus envelope protein by screen⁃ing a phage-displayed random peptide library[J].PLoS One, 2012,7(11):49842.
[13]Wu D,Li G,Qin C,et al.Phage displayed peptides to avian H5N1 virus distinguished the virus from other viruses[J].PLoS One, 2011,6(8):23058.
Comparative study on three kinds of detection methods of avian infec⁃tious bronchitis virus/
PAN Long1,LI Guangxing1,NIE Sijing1,CAI Haofan2,LI Lanlan1(1. School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;2.Department ofAnimal Husbandry andAgriculture,Heilongjiang Polytechnic,Harbin 150080,China)
Avian infectious bronchitis virus(IBV),which belongs to group γ coronavirus,leads to chicken respiratory disease—infectious bronchitis(IB)and causes enormous economic loss.Latest researches on IBV diagnostic methods are undertaken very extensively,and rapid and specific diagnostic methods have obvious significance on the comprehensive prevention of IB.In this paper,molecular biology and phage display technique were used to establish three kinds of IBV diagnostic methods,i.e.,real time quantitativepolymerasechainreaction(qRT-PCR),reversetranscriptionPCR(RT-PCR),and phage-mediated enzyme-linked immunosorbent assay(phage-mediated ELISA),and their characteristics were comparatively studied.The results showed that these three methods had the reliability to assay IBV specifically,and they could detect IBV at least 7.64×101,7.64×103,1.21×105copies·μL-1,respectively,in which qRT-PCR had the highest sensitivity.Furthermore,the high affinity phages to IBV S1 protein were employed with phage display technique to develop phage-mediated ELISA,and it had very good specificity and sensitivity for IBV diagnosis,and it is suitable to utilized veterinary clinic application.
infectious bronchitis virus;Real-time PCR;RT-PCR;phage-mediated ELISA
S852.31
A
1005-9369(2014)09-0100-06
2014-07-19
黑龙江省自然科学基金项目(ZJN0702-01);国家自然科学基金项目(31172295,31272569)
潘龙(1979-),男,博士研究生,研究方向为动物病理学。E-mail:panlong79@126.com
*通讯作者:李广兴,教授,博士生导师,研究方向为动物病理学。E-mail:ligx@neau.edu.cn。
时间2014-9-18 10:48:03[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140918.1048.012.html
潘龙,李广兴,聂思静,等.三种IBV检测方法比较研究[J].东北农业大学学报,2014,45(9):100-105.
Pan Long,Li Guangxing,Nie Sijing,et al.Comparative study on 3 kinds of detection methods of avian infectious bronchitis virus[J].Journal of Northeast Agricultural University,2014,45(9):100-105.(in Chinese with English abstract)

