双搅拌釜中油酸臭氧氧化裂解的传质-反应动力学
聂 勇 金林刚 宋一凡 梁晓江 卢美贞 计建炳
(浙江省生物燃料利用技术研究重点实验室 浙江工业大学化工学院,杭州 310014)
壬二酸(Azelaic acid)是一种重要的精细化工中间体, 广泛应用于高分子材料合成、医药、香料、电容器制造、润滑剂等工业生产中[1]。制备壬二酸的方法主要有3类:1)以不饱和脂肪酸(油酸、亚油酸、蓖麻油酸)为原料,利用氧化剂(高锰酸钾[2]、臭氧[3]、双氧水[4]等)进行氧化裂解制取壬二酸;2)采用微生物发酵氧化法,将烷烃转化为相应的二元酸[5];3)以壬二醛(醇)为原料,氧化制取壬二酸[6]。工业上制备壬二酸常采用臭氧氧化法,其优点主要体现在反应条件温和、选择性好、产品收率高、无污染等。我国油脂原料种类很多,可用来生产油酸的植物油有菜籽油、棉籽油、大豆油、米糠油等;动物油有猪、牛、羊油等。因而,采用臭氧为氧化剂对可再生资源油酸进行氧化生产壬二酸,不仅提高了天然资源利用水平,而且避免了环境污染。
油酸臭氧氧化法制取壬二酸为两步反应:油酸首先与臭氧反应生成臭氧氧化物,进一步与氧气反应裂解生成壬二酸[3]。两步反应均为气液传质-反应过程,前人研究主要集中在工艺参数对反应过程的影响[7-9],在动力学方面的基础研究鲜有报道。
本研究拟在双搅拌釜内探讨油酸臭氧氧化法制壬二酸的传质-反应动力学,研究结果将为油酸氧化裂解制取壬二酸的气液反应器设计提供依据。
1 材料与方法
1.1 试剂和仪器
油酸(高纯):西普化工有限公司;冰醋酸(分析纯):杭州化学试剂有限公司;碘化钾(分析纯):西陇化工有限公司。
双搅拌釜JCH-501:华东理工大学;气相色谱仪GC9790:福立分析仪器有限公司;臭氧发生器:杭州金海电子电器有限公司。
1.2 试验装置
试验装置如图1所示。

注:1 空气泵;2 氧气;3 氮气;4 调节阀;5 臭氧发生器;6 转子流量计;7 三通;8 超级恒温槽;9 缓冲瓶;10 皂膜流量计;11 液体入口;12 调速电机;13 磁力传动装置;14 搅拌桨;15 吸收腔体;16 液体出口;17 转速调节器。
图1 油酸臭氧氧化裂解试验动力学测定装置图
2 油酸臭氧氧化反应动力学区域的确定
在研究气液传质-反应体系时,首先应确定该反应所属动力学区域[10]。动力学区域体现了化学反应对气液传质-反应过程的影响,其分类主要根据化学反应的快慢确定。表1示出了气液传质-反应的主要影响因素与动力学区域的关系,通过对表1中各因素影响的分析,可确定气液传质-反应的动力学区域。

表1 气液传质-反应的影响因素与动力学区域的关系
注:动力学区域 A 瞬时反应;B 界面瞬时反应;C 快速反应;D 快速拟m级反应;E 中速反应;F 拟m级中速反应;G 慢速反应;H 液相主体的极慢速反应。表中“+”表示受此因素的影响;“-”表示不受此因素的影响;“?”表示有可能受此因素的影响,但速率方程不变。
油酸臭氧氧化法制取壬二酸包括两步气液传质-反应,为了确定第一步臭氧化反应的动力学区域,设计的影响因素试验如表2所示。试验条件为:T=305 K,Pin=40 Pa ,cBL=0.50 mol·L-1,nL=70 r·min- 1,VL=200 mL,表2中吸收速率为测定5次平均获得。
从表2可看出:油酸溶液体积的变化对臭氧气体吸收速率没有影响,依据表1可排除区域E~H;通过改变液相搅拌速度nL来改变液相传质系数kL,结果表明液相传质系数对吸收速率也没有影响,由此可进一步排除区域A和C;改变油酸溶液浓度cBL,结果表明吸收速率随之变化,故可排除区域B,因而可确定在本试验条件下,臭氧化反应的动力学区域为D,即快速拟m级反应。

表2 臭氧氧化油酸的试验值
同理,按照上述方法确定第二步臭氧化物氧气氧化裂解反应的动力学区域, 设计的影响因试验如表3所示。试验条件为:T=363 K,Pin=200 Pa,cBL=0.50 mol·L-1,nL=70 r·min-1,VL=200 mL。
根据上述判断方法,由表3的数据可知臭氧化物吸收氧气反应的动力学区域亦为快速拟m级反应。

表3 氧气裂解臭氧化物的试验值
3 反应级数及反应速率常数的确定
根据两步反应的特征,油酸吸收臭氧的反应方程式可表示为:
C18H34O2+O3→C18H36O5
(1)
臭氧氧化物吸收氧气的反应方程式表示为:
C18H36O5+O2→H3C(CH2)7COOH+HOOC(CH2)7COOH
(2)
2个反应中,与气相溶质(臭氧或氧气)的界面浓度ci相比,反应体系中液相反应物(油酸或臭氧氧化物)的浓度cBL足够大。因而,在吸收过程中可认为cBL基本不变,2个反应的反应速率可简化为:
R=k2cBci≈k2cBLci=k1ci
(3)
式中:k1=k2cBL为拟一级反应速率常数;k2为二级反应速率常数。
根据Danckwerts理论,对于快速拟m级反应的传质速率可表示为:
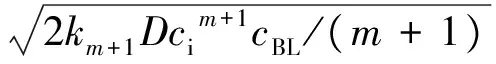
(4)
式中:N′为传质速率;D为扩散系数;m为反应级数;km+1为反应速率常数。依据上述快速拟m级反应的传质速率方程,确定反应级数及反应速率常数前需确定气相溶质的界面浓度ci。
应用界面上的相平衡关系式(5)和传质速率关联式(6)可得到气相溶质的界面浓度ci计算式(6),如下所示:
ci=HPi
(5)
式中:H为溶解度系数;Pi为溶质气体在界面处的分压。
N′=kGPG-Pi
(6)
式中:kG为气相传质系数;PG为溶质气体在气相主体中的分压。

(7)
气相、液相传质系数可以根据传质系数与搅拌速度的关系获得,具体参见文献[11]。本试验中气相传质系数kG,O3=6.49×10-6mol·m-2·s-1·Pa-1(305 K) ,kG,O2=7.72×10-6mol·m-2·s-1·Pa-1(363 K);液相传质系数kL,O3=2.85×10- 5m·s- 1(305 K) ,kL,O2=3.11×10- 5m·s-1(363 K)。
在双搅拌釜内,当气相搅拌速度为120~800 r·min-1、液相搅拌速度为100~187 r·min- 1时,其串联全混流反应器的级数为1[10]。本研究中,气相搅拌转速为300 r·min- 1,液相150 r ·min- 1,因而,可将搅拌釜的气、液相出口组成作为釜内气、液相的主体浓度,即有PG=Pout。
对于给定初始浓度的液相反应物, 改变气体溶质进口浓度, 测得气体溶质出口浓度, 通过物料衡算可获得相应的吸收速率N′, 从而根据式(7)确定气体溶质界面浓度ci。图2和图3分别示出了两步反应过程中臭氧界面浓度和氧气界面浓度对吸收速率的影响。从图2和图3可看出,两步气液反应中吸收速率与气体界面浓度呈线性关系,表明两步反应均可视为气体溶质的拟一级反应,则式(4)中m=1。由此可得到试验条件下油酸吸收臭氧的臭氧化反应的平均二级反应速率常数k2=2.32×104m3·kmol- 1·s-1,臭氧化物吸收氧气的裂解反应的平均二级反应速率常数k2= 2.06×104m3·kmol-1·s-1。

图2 臭氧界面浓度对吸收速率的影响

图3 氧气界面浓度对吸收速率的影响
4 增强因子的研究
化学反应吸收过程中, 增强因子E集中体现了化学反应对传质的影响,因而对增强因子E的研究是十分必要的,在实际应用中也是很有意义的。通常,伴有气液传质-反应的传质速率表达式为[10]:

(8)
利用测得的试验数据可进一步由式(8)获得试验条件下的增强因子,两步反应的增强因子的试验值分别如图4和图5结果所示。从图4~图5可看出,2个反应的增强因子E均随着吸收液浓度cBL的增大而增大。借助Danckwerts理论式(4)拟合两步反应中E与cBL1/2的关系得:油酸臭氧化反应中E=402.7cBL1/2(R2=0.98);臭氧化物吸收氧气裂解反应中E=346.6cBL1/2(R2=0.95)。

图4 增强因子与油酸浓度平方根的关系

图5 增强因子与臭氧氧化物浓度平方根的关系
5 快速拟一级反应的验证
对于双分子二级反应,其增强因子按非稳态模型的普遍表达式为[10]:

(9)
式中:γL为膜内转化系数(即八田数Ha);r为扩散系数比;S为计量浓度比。
二级反应可作为拟一级反应的条件是:
r1/2S/γL≥10
(10)
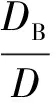
(11)
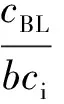
(12)
(13)
对于第一步臭氧化反应,以进口臭氧分压为 50 Pa为例,在 305 K试验条件下,计算结果如表4所示。从表4可看出,本试验条件下满足条件(10),即验证了油酸臭氧化反应为快速拟一级反应。
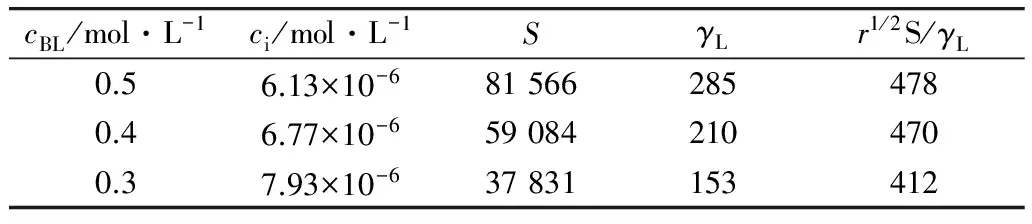
表4 油酸臭氧化快速拟一级反应的验证
对于第二步臭氧化物裂解反应,以进口氧气分压为 360 Pa为例,在 363 K试验条件下,计算结果如表5所示。从表5可看出,本试验条件下满足条件(10),即验证了臭氧化物裂解反应亦为快速拟一级反应。
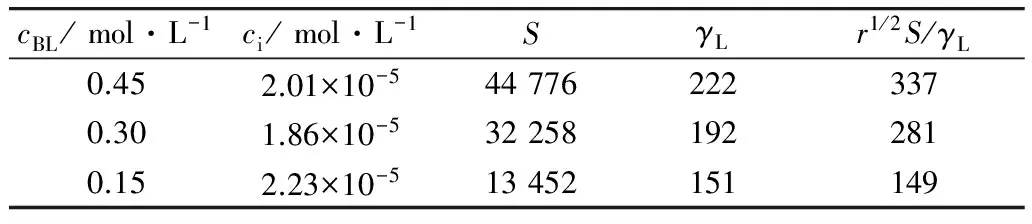
表5 臭氧化物裂解快速拟一级反应的验证
6 结论
在双搅拌釜内,研究了油酸臭氧氧化法制取壬二酸两步气液反应的传质-反应动力学,结果表明:
6.1 第一步臭氧化反应为快速拟一级反应,当温度为305 K时,该反应的二级反应速率常数k2=2.32×104m3·kmol-1·s-1,增强因子E与液相油酸浓度cBL的关系为:E=402.7cBL1/2(R2=0.98)。
6.2 第二步臭氧氧化物氧气氧化裂解反应也为快速拟一级反应,当温度为363 K时,该反应的二级反应速率常数k2=2.06×104m3·mol-1·s-1,增强因子E与臭氧氧化物浓度cBL的关系为:E=346.6cBL1/2(R2=0.95)。
6.3 通过对二级反应可作为拟一级反应条件的核算,进一步验证了两步气液反应为快速拟一级反应。
[1]孙自才,张亚刚,吾满江·艾力,等. 混合溶剂下油酸臭氧化催化氧化裂解合成壬二酸的工艺研究[J]. 中国油脂,2006,31(3): 40-42
[2]Garti I, Avni E. Permanganate oxidation of oleic acid using emulsion technology[J]. Journal of the American Oil Chemists’ Society, 1981, 58(8): 840-841
[3]Goebel C G, Brown A C, Owhlschlaeger H F, et al. Method for Making azelaic acid: US, 2813113[P].1957-11-12
[4]Noureddini H , Kanabur M. Liquid-phase catalytic oxidation of unsaturated fatty acids[J]. Journal of the American Oil Chemists’ Society, 1999, 76 (3): 305-312
[5]Picataggio S, Rohrer T, Deanda K, et al. Metabolic engineering of candida tropicalis for the production of long-chain dicarboxylic acids[J]. Nature Biotechnology, 1992, 10(8): 894-898
[6]Matsumoto M, Tamura M, Yoshimura N. Process for producing 1, 9-nonanedial: US, 4510332[P]. 1985-04-09
[7]Lazim N A, Asim N, Rani M, et al. Investigation of nanoscale tungsten(VI) oxide as a catalyst for the ozonolysis of oleic acid[J]. European Journal of Scientific Research, 2008, 24(4): 463-467
[8]王书谦,李英春. 壬二酸制备工艺的改进[J]. 应用化工,2005,34(1): 48-50
[9]王亚勤. 油酸臭氧氧化制备壬二酸的工艺及反应器研究[D]. 杭州: 浙江工业大学,2010
[10]谭天恩,金一中,骆有寿. 传质-反应过程[M]. 杭州: 浙江大学出版社,1990
[11]施耀. 利用工业废料在旋流板塔内烟气脱硫的基础研究[D]. 杭州: 浙江大学,1991.
Mass Transfer and Reaction Kinetics of Oleic Acid Ozonolysis and Oxidative Cracking in Double-Stirred Cell
Nie Yong Jin Lingang Song Yifan Liang Xiaojiang Lu Meizhen Ji Jianbing
(Zhejiang Province Key Lab of Biofuel, College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014)

