阳极氧化法制备具有可见光光催化活性的二氧化钛
李 丹,伍 林,童 坤,欧阳兆辉,易德莲,大津直史,小宫谷真司
(1.武汉科技大学 应用化学研究所,湖北 武汉430081;2.日本北见工业大学生物材料大学院,日本 北海道 北见市0900061)
二氧化钛因光催化活性较高、成本低、无毒性和环境友好等特性,成为最有潜力的光催化剂之一[1],其作为环境净化媒介[2-3]及抗菌涂层[4-7]更是受到研究者的广泛关注。二氧化钛作为一种半导体,在不同形态下均具有较宽的能带间隙,通常来说二氧化钛的光催化活性只有在能带间隙较宽的紫外光下才能激发。自然状态下太阳光是最常见的较强光源,而紫外光只占其中很小一部分。因此,为了有效利用自然光源,研究人员都致力于调节二氧化钛能带间隙至可见光区域,以利用可见光激发二氧化钛的光催化活性,达到自动降解污染物、净化环境的目的。
阳极氧化法是一种有效地在金属表面形成其氧化物的工业技术手段,也是一种极其简单易行并可控的二氧化钛合成方法。通过采用不同的电解质溶液,可以轻易地引入不同的离子[8]。目前研究涉及到的阳极氧化体系多为水溶液[9-10],而对于黏性溶液体系的研究并不多。如Ohtsu等[11]采用硝酸溶液作为电解质溶液引入氮原子,合成的二氧化钛具有优良的光催化活性,但表面十分粗糙。Raja等[12]以乙二醇作为电解质溶液得到了光滑的金属表面。
为得到可见光诱导光催化活性好、表面光滑的二氧化钛,作者在此采用3种不同的电解质溶液制备二氧化钛,并对其光催化性能进行了比较。
1 实验
1.1 材料、试剂与仪器
钛片(纯度99.9%),20mm×10mm×1mm;铂片,20mm×10mm×1mm。
电解质溶液:1mol·L-1硝酸铵乙二醇溶液(记为1-M ANEG);0.1mol·L-1硝酸铵乙二醇溶液(记为0.1-M ANEG);0.1mol·L-1硝酸铵水溶液(记为0.1-M ANA)。
JCM-5000NeoScope型扫描电子显微镜,日本JEOL;MiniFlexⅡ型X-射线衍射仪,日本Rigaku;UV-2400PC型紫外吸光光度计,日本Shimadzu。
1.2 方法
取钛片用平均粒径为40nm的胶体二氧化硅悬浮液进行化学研磨;然后在超声微波仪中用蒸馏水彻底洗净。以此钛片为底板,与铂片分别作为阳极与阴极,进行阳极氧化反应。
阳极氧化过程中,设定直流电流为0.4A,恒电流模式,反应持续30min,让对应电压随反应自然变化。当阳极氧化反应完成后,用蒸馏水对样品进行超声微波洗涤。洗涤后自然风干,风干后将样品在450℃下高温煅烧5h,自然冷却。
1.3 表征分析
样品的表面形貌用扫描电子显微镜(加速电压为10kV)进行观察,样品的晶型结构采用X-射线衍射仪进行观察。
1.4 光催化活性的测定
样品的光催化活性通过甲基蓝分解测试进行评价。在进行甲基蓝分解测试前,用紫外光照射试样表面90min,以去除试样表面的污染物。然后将样品浸入10mg·L-1甲基蓝溶液24h使其达到饱和吸附。用紫外吸光光度计,每20min测一次样品的吸光度,持续监测3h。根据吸光度随时间的变化作图,取斜率得出甲基蓝分解速率。实验用紫外光波长370nm,可见光波长420nm,光照强度1mW·cm-2。
2 结果与讨论
2.1 阳极氧化过程分析
图1是30min内阳极氧化反应过程中的电压变化曲线。
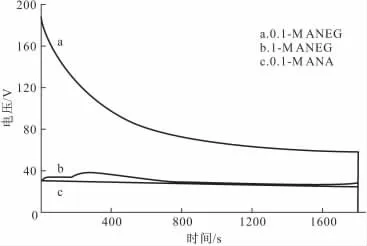
图1 不同电解质溶液中阳极氧化电压-时间曲线Fig.1 The voltage variation curves with time during anodic oxidation in various electrolyte solutions
由图1可知:3种电解质溶液中0.1mol·L-1硝酸铵乙二醇溶液体系不含水,硝酸铵浓度适中,开始到达的电压最高,然后快速下降,至30min时接近稳定,且最终电压为最高;1mol·L-1硝酸铵乙二醇溶液体系的整体电压为次高,电压变化很小,在前500s内缓慢上升后又平缓下降,至30min时电压也已恒定;在唯一含水体系0.1mol·L-1硝酸铵水溶液中,恒定电流模式下,电压在极化反应开始瞬间达到常数值,持续反应30min,电压一直保持稳定且为最低。表明,不同钛片在不同电解质溶液中发生阳极氧化反应的过程有较大差异,这对所制备的氧化膜的性能很可能产生影响。
2.2 数码相机及扫描电镜分析
图2为数码相机拍摄,在不同电解质溶液中阳极氧化后钛片呈现的直接目视效果。
由图2可知:对于1mol·L-1硝酸铵乙二醇溶液中的样品,由于体系不含水,阳极氧化后表面呈深铁灰色,目测比较光滑;对于0.1mol·L-1硝酸铵乙二醇溶液中的样品,阳极氧化后表面呈现浅铁灰色,目测也较为光滑;对于0.1mol·L-1硝酸铵水溶液中的样品,体系为非黏性溶液,阳极氧化后表面有明显的白色粉末生成,边角有轻微化学腐蚀(反应中也观测到反应速度极快),另外,钛片表面明显密集分布着小孔。由数码相片可以看出黏性体系中阳极氧化后的钛片明显比水溶液体系中阳极氧化后的钛片光滑。

图2 不同电解质溶液中阳极氧化后钛片表面的数码相片Fig.2 Photographs of Ti layers anodized in various electrolyte solutions
为了进一步确认且更清晰地观察钛片表面的形貌,用扫描电子显微镜观察样品的表面情况,扫描电镜照片见图3。

图3 不同电解质溶液中阳极氧化后钛片表面的扫描电镜照片Fig.3 SEM Images of Ti layers anodized in various electrolyte solutions
由图3可知:1mol·L-1硝酸铵乙二醇溶液和0.1mol·L-1硝酸铵乙二醇溶液中阳极氧化的钛片明显比0.1mol·L-1硝酸铵水溶液中阳极氧化的钛片光滑得多。这可能是因为,在黏性溶液体系硝酸铵乙二醇溶液中,阳极氧化的钛片表面反应缓慢,得以形成光滑的表面,而在水溶液体系中,阳极氧化反应迅速,不断有产物生成、剥落,最终形成如图3c、f所示表面形态。
2.3 X-射线衍射分析
图4是在不同电解质溶液中阳极氧化后钛片表面的X-射线衍射图谱。
由图4可知,在3种不同电解质溶液中阳极氧化后的钛片表面均在25.3°和27.5°处出现典型的二氧化钛峰,这说明3种电解质溶液中均反应生成了二氧化钛。不同的是,电解质溶液为0.1mol·L-1硝酸铵水溶液时,只能检测到锐钛矿型二氧化钛的特征峰,这说明在0.1mol·L-1硝酸铵水溶液中仅生成了锐钛矿型的二氧化钛;而在另外两种黏性硝酸铵乙二醇溶液体系中,均检测到锐钛矿型和金红石型二氧化钛的特征峰,这说明在硝酸铵乙二醇溶液中生成了锐钛矿型和金红石型二氧化钛。由于25.3°处波峰强度明显弱于27.5°处波峰,表明检测到的金红石型二氧化钛明显多于锐钛矿型二氧化钛,可以推断在黏性体系硝酸铵乙二醇溶液中,钛片阳极氧化生成的产物大部分为金红石型二氧化钛,小部分为锐钛矿型二氧化钛。

图4 不同电解质溶液中阳极氧化后钛片的X-射线衍射图谱Fig.4 XRD Patterns of Ti layers anodized in various electrolyte solutions
2.4 光催化活性分析
为了有效评价所制备二氧化钛的光催化活性,在紫外光和可见光下对不同电解质溶液中制得的二氧化钛样品进行甲基蓝分解测试,结果见图5。
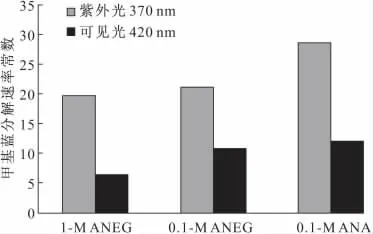
图5 3种二氧化钛作催化剂,甲基蓝溶液在紫外光和可见光照射下的分解速率常数Fig.5 The decomposition rate constant of MB under UV or visible-light illumination catalyzed by three kinds of TiO2
由图5可知:在紫外光下,0.1mol·L-1硝酸铵水溶液中制备的二氧化钛的甲基蓝分解速率常数明显较大;而在可见光下,对于浓度不同的硝酸铵乙二醇溶液,浓度低的电解质溶液中制得的二氧化钛具有更大的甲基蓝分解速率常数,即具有更好的光催化活性;对于浓度相同、分散介质不同的硝酸铵溶液,即0.1mol·L-1硝酸铵乙二醇溶液和0.1mol·L-1硝酸铵水溶液中制得的二氧化钛达到了几乎相等的甲基蓝分解速率常数,即具有相当的光催化活性。
3 结论
(1)在黏性介质中进行钛的阳极氧化反应,钛片表面的反应较在水介质中更加平缓,得到的金属表面更光滑。
(2)在硝酸铵乙二醇溶液中进行阳极氧化所制备的二氧化钛大部分为金红石型、小部分为锐钛矿型;而在硝酸铵水溶液中所制备的二氧化钛全部为锐钛矿型。
(3)硝酸铵乙二醇黏性体系可以在满足较高可见光光催化活性的同时,保有相较于硝酸铵水溶液中更加光滑美观的表面,可以作为开发新型光催化型金属表面的一个新的技术方向。
(鸣谢:感谢日本北见工业大学大津直史实验室的研究成员为本研究的顺利进行提供了宝贵资源和意见,特别感谢大津直史老师的悉心指导!)
[1]Fujishima A,Rao T N,Tryk D A.Titanium dioxide photocatalysis[J].Journal of Photochemistry and Photobiology,2000,1(1):1-21.
[2]Matthews R W.Photooxidation of organic impurities in water using thin films of titanium dioxide[J].Journal of Physical Chemistry,1987,91(12):3328-3333.
[3]Ohko Y,Hashimoto K,Fujishima A.Kinetics of photocatalytic reactions under extremely low-intensity UV illumination on titanium dioxide thin films[J].Journal of Physical Chemistry,1997,101(43):8057-8062.
[4]Yu J C,Ho W K,Lin J,et al.Photocatalytic activity,antibacterial effect and photoinduced hydrophilicity of TiO2films coated on a stainless steel substrate[J].Environmental Science and Technology,2003,37(10):2296-2301.
[5]Ohko Y,Utsumi Y,Niwa C,et al.Self-sterilizing and self-cleaning of silicone catheters coated with TiO2photocatalyst thin films:A preclinical work[J].Journal of Biomedical Materials Research,2001,58(1):97-101.
[6]Yao Y,Ohko Y,Sekiguchi Y,et al.Self-sterilization using silicone catheters coated with Ag and TiO2nanocomposite thin film[J].Journal of Biomedical Research,2008,85(2):453-460.
[7]Kim B,Kim D,Cho D,et al.Bactericidal effect of TiO2photocatalyst on selected food-borne pathogenic bacteria[J].Chemosphere,2003,52(1):277-281.
[8]Aladjem A.Anodic oxidation of titanium and its alloys[J].Journal of Materials Science,1973,8(5):688-704.
[9]Kuromoto N K,Sim o R A,Soares G A.Titanium oxide films produced on commercially pure titanium by anodic oxidation with different voltages[J].Materials Characterization,2007,58(2):114-121.
[10]Sul Y T,Johansson C B,Jeong Y.The electrochemical oxide growth behaviour on titanium in acid and alkaline electrolytes[J].Medical Engineering & Physics,2001,23(5):329-346.
[11]Ohtsu N,Kanno H,Komiya S,et al.Fabrication of visible-lightresponsive titanium dioxide layer on titanium using anodic oxidation in nitric acid[J].Applied Surface Science,2013,270:513-518.
[12]Raja K S,Gandhi T,Misra M.Effect of water content of ethylene glycol as electrolyte for synthesis of ordered titania nanotubes[J].Electrochemistry Communications,2007,9(5):1069-1076.

