生防细菌TF28抗菌蛋白的分离纯化及理化特性
孟利强,李晶,赵晓宇,张淑梅,曹旭,陈静宇,沙长青
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院高技术研究院,哈尔滨 150020;3.黑龙江省科学院,哈尔滨 150080)
生防细菌TF28抗菌蛋白的分离纯化及理化特性
孟利强1,2,李晶1,2,赵晓宇1,2,张淑梅1,2,曹旭1,2,陈静宇1,沙长青2,3*
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院高技术研究院,哈尔滨 150020;3.黑龙江省科学院,哈尔滨 150080)
为得到生防细菌TF28产生的抗菌蛋白,明确其蛋白理化特性。采用硫酸铵分级盐析法得到抗菌蛋白粗提物,采用Q Sepharose Fast Flow阴离子交换层析及Superdex 75分子筛凝胶层析方法进行分离纯化。获得单一抗菌活性蛋白P28,纯度达到94.48%,经检测该抗菌蛋白分子质量为36.8 ku。该抗菌蛋白具有一定的热稳定性和酸碱稳定性;经蛋白酶K在37℃处理30 min活性降低为原有活性的75.1%,对紫外线、胰蛋白酶不敏感。结果表明,经过分离纯化得到一种抗菌活性蛋白P28,该抗菌蛋白具有一定的热稳定性和酸碱稳定性,对蛋白酶K具有一定的耐受性,对紫外线、胰蛋白酶不敏感。
生防;抗菌蛋白;拮抗作用;分离纯化;理化特性
从生防细菌发酵液中提取分离抗菌物质并将其应用于植物病害防治是目前生物防治的重要途径[1-3]。生防细菌TF28是从大豆根部分离出的一株拮抗内生细菌,前期研究发现该菌产生的抗菌蛋白具有广谱高效抑菌活性[4]。经鉴定,该菌属于解淀粉芽孢杆菌(Bacillus amyloliquefaciens),是一类可产生丰富胞外拮抗物质的革兰氏阳性细菌,从中分离出具有较好生防应用价值的拮抗物质,并对其进行开发利用逐渐成为应用研究的热点[5-7]。
本研究主要对TF28菌株所产生的抗菌蛋白进行分离、纯化和分析,并对其理化性质进行研究,为进一步研究该蛋白的分子遗传基础、和研制该菌株抗菌蛋白生物农药提供理论基础[8-9]。
1 材料与方法
1.1 试验材料
拮抗菌株解淀粉芽孢杆菌TF28及立枯丝核菌(Rhizoctonia solani f.sp.vedolens)为黑龙江省科学院微生物研究所分离保存。
1.2 试验方法
1.2.1 硫酸铵分级盐析条件确定
分级沉淀方法参照文献[4],设置分级浓度为20%、40%、60%、80%、100%,确定抗菌蛋白的硫酸铵盐析的最适饱和度。
1.2.2 Q Sepharose Fast Flow阴离子交换层析
抗菌粗蛋白经过离子交换层析进一步分离,本研究使用ÄKTApurifier蛋白分离纯化系统的阴离子交换柱Q Sepharose Fast Flow,上样体积为100 μL,室温下流速为0.5 mL·min-1,收集流出峰;然后采用阶梯梯度洗脱,洗脱缓冲液为2 mol·L-1的NaCl(pH 7.6),洗脱浓度分别为10%、20%、30%、40%、50%,收集各洗脱峰;浓缩各洗脱峰样品,采用杯碟法[10]检测其抑菌活性,并用SDS-PAGE电泳检测样品蛋白组成。
1.2.3 Superdex 75分子筛凝胶层析
收集活性峰进行分子筛凝胶层析,使用ÄKTApurifier蛋白分离纯化系统,室温,流速0.4 mL·min-1,待基线走平后,手动上样,上样体积100 μL,收集各个吸收峰;样品浓缩、检测及活性峰SDS-PAGE电泳检测(同1.2.2)。
1.2.4 抗菌蛋白纯度检验
采用高压液相色谱(HPLC)反相C18柱,对分子筛层析分离得到的活性峰组分进行纯度检验,固定相为Symmetry C18,(4.6×250 mm,5 μL),流动相为0.1%三氟乙酸(TFA)水溶液(A相)和0.1%三氟乙酸(TFA)乙睛溶液(B相);洗脱速度0.8 mL· min-1,检测波长280 nm,温度25℃;使用A、B混合液为流动相,其中B液含量从5%~95%逐渐升高,洗脱时间为50 min。
1.2.5 抗菌蛋白P28的理化特性
热稳定性:将抗菌蛋白分别置于50、70、90和100℃水浴30 min,然后分别采用杯碟法测定其活性。
pH稳定性:将抗菌蛋白pH分别调至2.0、4.0、6.0、8.0、70.0、12.0,置4℃过夜,再将各自pH值调回中性后测定其抑菌活性。
紫外线、蛋白酶稳定性测定方法参照文献[4],其中蛋白酶选用胰蛋白酶、蛋白酶。
2 结果与分析
2.1 硫酸铵分级盐析条件确定
盐析粗蛋白经透析、浓缩后测定抗菌活性,结果如图1所示,当硫酸铵盐析饱和度为20%、60%、80%、100%时,粗提物抑菌活性较弱,当硫酸铵盐析饱和度为40%时,粗提物抑菌活性最强,由此确定20%~40%硫酸铵饱和度为沉淀抗菌蛋白的最佳硫酸铵饱和度。

图1 最佳硫酸铵盐析饱和度的确定Fig.1 Determination of optimum ammonium sulfate saturation
2.2 Q Sepharose Fast Flow阴离子交换层析
将Q Sepharose Fast Flow阴离子交换柱平衡后,手动上样100 μL,先收集洗脱峰,之后待基线走平后,开始洗脱,采用阶梯梯度洗脱,洗脱缓冲液(pH 7.6)盐浓度由低到高,分别为10%、20%、30%、40%、50%、100%,收集各洗脱峰,结果如图2。浓缩各峰并测定其活性,流出峰没有抑菌活性,洗脱峰活性如图3,10%的洗脱峰活性很弱,20%、30%、40%的洗脱峰活性相对较强,而50%的洗脱峰活性相对较弱。据此洗脱条件可以优化为:先用10%梯度的洗脱液洗脱出现Ⅰ峰,然后用40%梯度洗脱液洗脱出现Ⅱ峰,最后用50%梯度洗脱出Ⅲ峰,结果如图4。
分别收集Ⅰ、Ⅱ和Ⅲ峰,浓缩并做活性检测,结果如图5,Ⅰ峰和Ⅲ峰活性很弱,Ⅱ峰活性很强。
2.3 阴离子交换层析活性峰SDS-PAGE电泳检测
采用SDS-PAGE电泳检测上述活性峰Ⅱ,结果如图6,Ⅱ峰相对于粗提物的带型有所减少,共有5~6条可见带,分别分布在各个区域,分子质量各异,该步骤达到初步分离效果。

图2 Q Sepharose Fast Flow阶梯梯度洗脱峰Fig.2 Gradient elution peak of Q Sepharose Fast Flow

图3 阶梯梯度洗脱各峰抗菌活性Fig.3 Antibacterial activity of gradient elution peaks

图4 Q Sepharose fast flow三步梯度洗脱曲线Fig.4 Three-step gradient elution curves of Q Sepharose Fast Flow

图5 洗脱峰抗菌活性比较Fig.5 Comparison of the antibacterial activity

图6 离子交换活性峰SDS-PAGE电泳检测Fig.6 Testing elution curves by SDS-PAGE electrophoresis
2.4 Superdex 75分子筛凝胶层析
收集阴离子交换层析后的Ⅱ峰,浓缩至合适浓度后,用Superdex 75分子筛凝胶层析,进一步分离纯化,上样缓冲液为0.05 mol·L-1的磷酸缓冲液,0.15 mol·L-1NaCl,pH7.0,层析结果见图7。
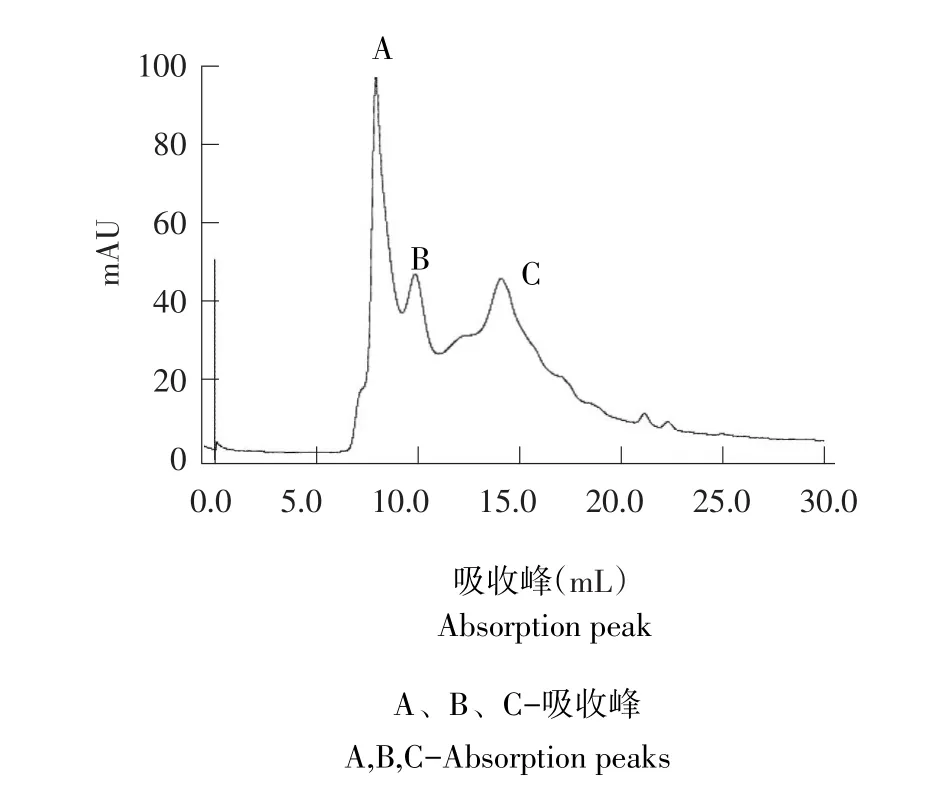
图7 Superdex 75凝胶层析分离曲线Fig.7 Separation curve gel chromatography Superdex 75
由层析图谱可知,有3个主要吸收峰,A、B、C,将3个峰收集浓缩,测定活性,结果如图8,A峰活性最强,B峰和C峰活性很弱。
2.5 Superdex 75分子筛凝胶层析活性峰SDSPAGE电泳检测
取A峰抗菌蛋白进行SDS-PAGE电泳检测,结果如图9,样品为单一条带,说明该抗菌蛋白经过分子筛分离纯化后纯度达到电泳级水平,分子质量为36.8 ku,命名为P28。
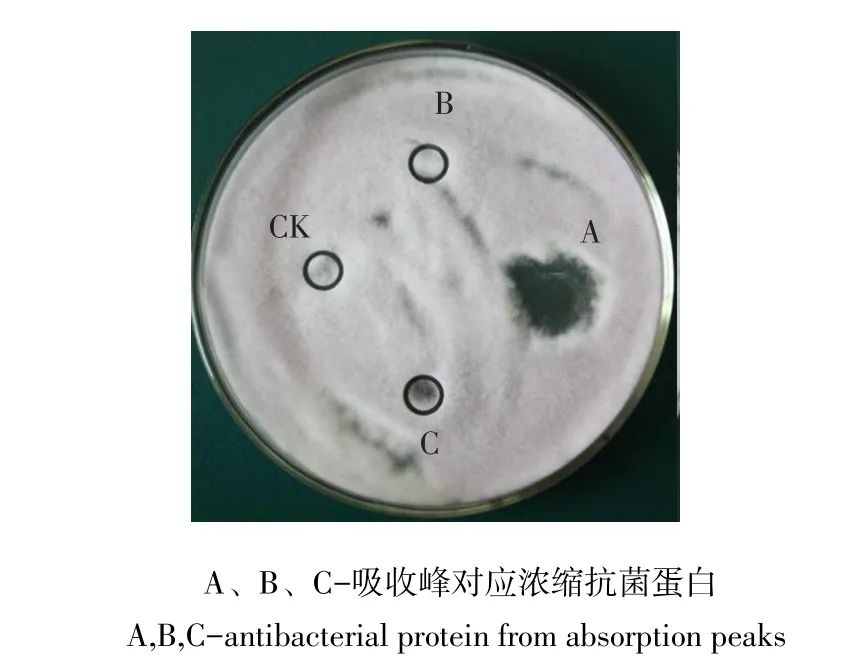
图8 凝胶层析各峰活性比较Fig.8 Comparison of the antibacterial activity
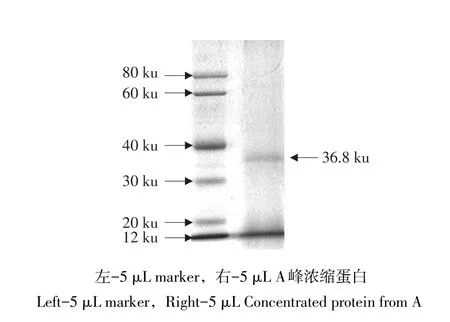
图9 凝胶层p析ea单k峰电泳检测Fig.9 Testing single curve by SDS-PAGE electrophoresis
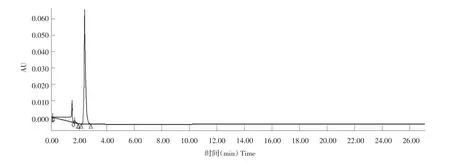
图10 抗菌蛋白纯度高效液相色谱检测Fig.10 Testing the purity quotient of antibacterial protein by HPLC
2.6 抗菌蛋白纯度检验
采用高效液相色谱技术检测抗菌蛋白的纯度,固定相Symmetry C18柱子,待走平基线后,按试验方法自动上样,开始洗脱,结果见图10和表1。

表1 高效液相色谱纯度检测数据Table 1 Testing data of purity quotient by HPLC
由图10和表1可知,在保留时间2.428 min时出现目的蛋白P28,纯度到达94.48%,样品中仅有少量杂质存在。
2.7 抗菌蛋白P28的理化特性
抗菌蛋白分别于不同温度下处理30 min,活性变化如表2。
经70、90和100℃处理30 min活性下降较为明显,抑菌率分别为原有的84.2%、72.2%和64.7%,而50℃处理30 min该蛋白活性仅降低3.8%。由此可见,该抗菌蛋白对温度不敏感。
将抗菌蛋白分别调至不同的pH,活性变化如表3所示,抗菌蛋白活性在pH 4~10范围时,活性变化较小,活性在pH 2和pH 12时分别降低15.4%和16.9%,可见该抗菌蛋白对pH不敏感。
紫外线的稳定性:紫外线照射对该抗菌蛋白活性无明显影响。
蛋白酶的稳定性:胰蛋白酶对该抗菌蛋白活性无影响,蛋白酶K使该蛋白活性降低24.9%。
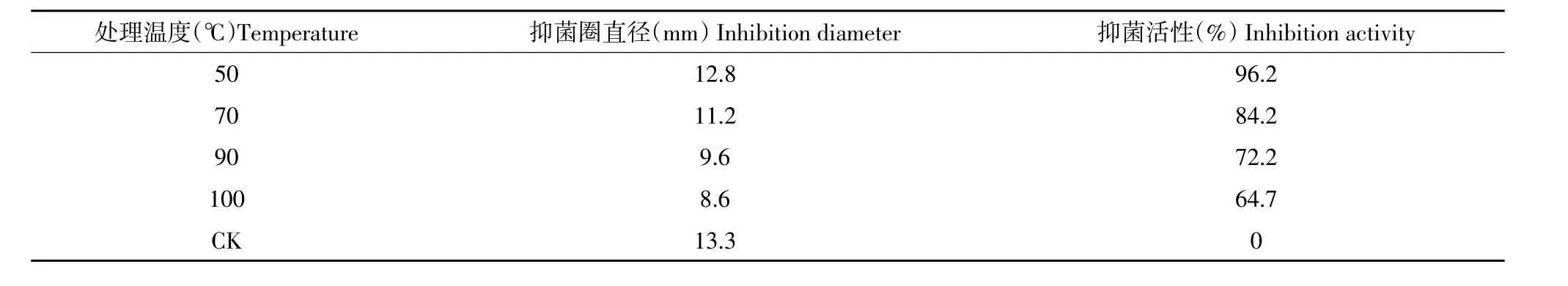
表2 抗菌蛋白的热稳定性Table 2 Thermal stability of antibacterial protein

表3 抗菌蛋白的pH稳定性Table 3 pH stability of antibacterial protein
3 讨论与结论
利用拮抗菌防治植物病害备受关注,拮抗菌产生的抗菌物质在防治植物病害中具有重要作用,了解拮抗菌及其抗菌物质的特性是生物防治得以实现的前提条件[11-12]。张双凤等从拮抗菌LC-105的发酵液中分离纯化出一种对棉花黄萎病大丽轮枝菌具有抑制作用的抗菌蛋白质[13]。齐爱勇等B21菌株产生的抗菌蛋白经过层析纯化,得到一种单一蛋白,分子质量为43 ku[14]。
解淀粉芽孢杆菌TF28是从大豆根部分离出的一株内生细菌,具有良好的试验室生测活性,能对多种植物病原菌的生长起到抑制作用,是一株具有良好开发前景的生防细菌[4,15]。为进一步明确解淀粉芽孢杆菌TF28的生防机制,本文通过硫酸铵分级沉淀方法得到TF28菌株的抗菌粗蛋白,再通过阴离子交换层析和分子筛凝胶层析分离纯化得到一种活性蛋白P28,SDS-PAGE电泳检测该蛋白显示为单一条带,分子质量为36.8 ku,同时采用高压液相色谱检测其纯度为94.48%。此抗菌蛋白不同于已报道的任何一种抗菌蛋白,是否是一种新的抗菌蛋白,尚待于深入研究确认。本研究选用立枯丝核菌作为抗菌蛋白的活性检测的指示菌,而对其他植物病原菌尚未涉及。对该抗菌蛋白的抑菌谱、抑菌机理以及该蛋白的结构种类进行研究,可为该抗菌蛋白的分离纯化试验奠定基础。
研究抗菌蛋白P28的理化特性发现,该抗菌蛋白的热稳定性表现为:70、90和100℃处理30 min抗菌活性均有所下降,但均能保持在60%以上,而50℃处理30 min该蛋白活性仅降低3.8%;对pH不敏感,活性仅在pH 2和pH 12时降低15.4%和16.9%;对紫外线和胰蛋白酶不敏感,经蛋白酶K 37℃下处理30 min,其抑菌活性降低,但仍能保持原有活性的75.1%。抗菌蛋白P28显示其具有较稳定的理化特性,可为进一步开发成为生物农药提供有力保障,也展示了其良好的应用潜质。
[1]程亮,游春平,肖爱萍,等.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5):732-737.
[2]彭兵,张树斌,贾宇,等.枯草芽孢杆菌菌株A抗菌蛋白的分离纯化及抗真菌机理[J].中国农业科学,2011,44(1):67-74.
[3]任嘉红,吴小芹,刘辉,等.吡咯伯克霍尔德氏菌JK-SH007抗菌蛋白的分离纯化[J].微生物学通报,2010,37(6):872-880.
[4]孟利强,李晶,张淑梅,等.解淀粉芽孢杆菌TF28抗菌粗蛋白的初步研究[J].中国林副特产,2011,(5):10-13.
[5]车晓曦,李社增,李校堃,等.1株解淀粉芽孢杆菌发酵培养基的设计及发酵条件的优化[J].安徽农业科学,2010,38(18): 9402-9405.
[6]张少飞,李敏,邢志国,等.产抑菌物质SDLH菌株的鉴定及发酵产物稳定性研究[J].生物技术,2009,19(5):56-61.
[7]Wu W S,Wu H C,Li Y L.Potential of Bacillus amyloliquefaciens for control of Alternaria cosmosa and A.patula of Cosmos sulfu⁃rous(Yellow Cosmos)and Tagetes patula(French Marigold)[J]. Journal of Phytopathology,2007(12):670-675.
[8]Sutyak K E,Wirawan R E,Aroutcheva A A.Isolation of the Bacil⁃lus subtilis antimicrobial peptide subtilosin from the dairy prod⁃uct-derived Bacillus amyloliquefaciens[J].Journal of Applied Mi⁃crobiology,2008,106(6):1067-1074.
[9]纪兆林,唐丽娟,张清霞,等.地衣芽孢杆菌W10抗菌蛋白的分离纯化及其理化性质研究[J].植物病理学报,2007,37(3): 260-264.
[10]梁启美,齐东梅,贾洁,等.棉花黄、枯萎病拮抗菌的筛选及抗菌蛋白B110-a的初步测定[J].植物保护,2005,31(5):35-39.
[11]李晶,杨谦,赵丽华,等.生防枯草芽孢杆菌B29菌株抗菌物质的初步研究[J].中国生物工程杂志,2008,28(2):59-65.
[12]Chao S H,Cheng T H.Characterization of a novel pepf-like oligo⁃peptidase secreted by Bacillus amyloliquefaciens 23-7A[J].Appl Envir Microbiol,2006.72(1):968-971.
[13]张双凤,张爱民,赵钢勇,等.棉花黄枯萎病拮抗菌株的筛选及抗菌蛋白的分离纯化研究[J].华北农学报,2009,24(z2):229-232.
[14]齐爱勇,魏东盛,刘大群,等.枯草芽孢杆菌B21抗菌蛋白的分离纯化及特性研究[J].河北农业大学学报,2011,34(3):56-59.
[15]Zhang,F,Luo,S Y,Ye,Y B et al.The antibacterial efficacy of an aceraceous plant[Shantung maple(Acer truncatum Bunge)] may be related to inhibition of bacterial beta-oxoacyl-acyl carrier protein reductase(FabG)[J].Biotechnology and Applied Biochem⁃istry,2008,51(2):73-78.
Isolation,purification and characterization of antifungal protein from Antagonistic bacterium TF28 strain
Meng Liqiang1,2,Li Jing1,2,Zhao Xiaoyu1,2,Zhang Shumei1,2,Cao Xu1,2,Chen Jingyu1,Sha Changqing2,3(1.Institute of Microbiology of Heilongjiang Academy of Sciences,Harbin 150010,China;2.Institute of Advanced Technology of Heilongjiang Academy of Sciences,Harbin 150020,China;3.HeilongjiangAcademy of Sciences,Harbin 150080,China)
This paper aimd to get antifungal proteins isolated from strain TF28 and studies the physicochemical characteristics of the antifungal proteins.Isolation and purification were completed by ammonium sulfate precipitation and chromatography.A single antifungal protein named P28 was obtained with purity 94.48%and molecular weight 36.8 ku.In addition,the antibacterial protein has certain thermal and acid-base stability.The original antibacterial could be lowered by 24.9%after it was treated by proteinase K for 30 min at 37℃and it was not sensitive to UV and trypsin.The antibacterial protein P28 was isolated and purified that had certain thermal and acid-base stability,and was tolerant to protease K to some extent,and not sensitive to ultraviolet and trypsin.
probiotics;classify;mechanism of action;application
Q819
A
1005-9369(2014)02-0083-06
2012-10-24
黑龙江省科学院青年创新基金项目(2011HK009)
孟利强(1983-),男,助理研究员,硕士,研究方向为农业微生物、抗菌物质提取,E-mail:mengliqiang 83420@163.com
*通讯作者:沙长青,研究员,硕士生导师,研究方向为生物技术及微生物学,E-mail:shachangqing@vip.163.com
时间2014-1-17 16:37:49[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140117.1637.007.html
孟利强,李晶,赵晓宇,等.生防细菌TF28抗菌蛋白的分离纯化及理化特性[J].东北农业大学学报,2014,45(2):83-88.
Meng Liqiang,Li Jing,Zhao Xiaoyu,et al.Isolation,purification and characterization of antifungal protein from Antagonistic bacterium TF28 strain[J].Journal of Northeast Agricultural University,2014,45(2):83-88.(in Chinese with English abstract)

