TEAD1在小鼠围着床期子宫中的表达研究
倪华,贲文锐,李文萍,李瑞婷,靳方圆
(东北农业大学生命科学学院,哈尔滨 150030)
TEAD1在小鼠围着床期子宫中的表达研究
倪华,贲文锐,李文萍,李瑞婷,靳方圆
(东北农业大学生命科学学院,哈尔滨 150030)
采用Real-time PCR和原位杂交检测TEAD1在围着床期小鼠子宫及人工诱导蜕膜化组织中的表达情况。Real-time PCR结果显示,在妊娠1~8 d的小鼠子宫中,TEAD1 mRNA的表达随妊娠天数的增加逐渐增强;原位杂交结果显示,TEAD1 mRNA强表达于5~8 d小鼠子宫蜕膜细胞及胚胎上,TEAD1 mRNA强表达于人工诱导蜕膜化组织中。推测TEAD1参与调节子宫基质蜕膜化过程,在胚胎着床过程发挥重要作用。
TEAD1;胚胎着床;蜕膜化;小鼠
胚胎着床是指活化胚泡与处于接受态子宫相互作用,导致胚胎滋养层与子宫内膜建立紧密联系过程,此过程中子宫内膜细胞进行增殖分化与凋亡,其中基质细胞分化成蜕膜细胞为胚胎正常着床提供空间[1-2]。
TEA结构域家族(TEA domain family)是一类具有TEA/ATTS结构域转录因子[3],TEAD(TEA/ ATTS domain)最初被确定为一种有能力结合SV40增强子并激活其转录的核蛋白质[4],在哺乳动物中有4个基因编码4个同源TEAD家族成员,被命名为TEAD1~4,每个基因拥有不同的但不相互排斥的表达模式[5]。TEAD1~4从植入前胚胎到成年组织广泛表达,调节骨骼和心肌的发育、骨骼肌的再生、神经嵴发育等过程[6]。其中TEAD1能够促进心肌特异性基因的表达,TEAD1突变小鼠因遭受严重的心脏缺陷而胚胎致死[5],TEAD1也参与调节小鼠成肌细胞系C2C12的分化过程[7],Landin等研究表明,TEADs蛋白参与细胞增殖和凋亡途径[8],推测TEADs在小鼠胚胎着床中起重要作用。目前,TEADs在小鼠子宫中研究未见报道,本研究采用Real-time PCR技术和原位杂交技术分析TEAD1 mRNA在早期妊娠小鼠子宫中表达规律,探讨其在小鼠胚胎着床过程中的作用,为进一步探索TEADs胚胎着床分子机制提供依据。
1 材料与方法
1.1 试剂
TRIzol reagent、PGEM-T Vector System I载体购于Promega公司;Taq DNA聚合酶购于北京天根生化科技有限公司;Prime Script RT reagent Kit购于TaKaRa公司;Maxima SYBR Green/ROX qPCR Master Mix(2X)购于Thermo公司;DIG RNA Label⁃ing Kit(SP6,T7)、抗地高辛抗体购于Roche公司;引物合成和测序由上海生工生物工程有限公司完成;荧光定量PCR仪为ABI PRISM 7300。
1.2 动物
健康成年昆明白近交系雌雄小鼠,6~10周龄,性成熟,体重为20~30 g。自由饮食和饮水,正常光照,室温22℃。
1.3 动物模型及取材
1.3.1 早期妊娠
每天15:00~16:00,挑选自然发情的成年雌鼠与雄鼠进行合笼,在次日上午9:00前检查阴道栓,有栓者当天定为妊娠第1天,分别在各试验日上午9:00收集妊娠第1~8天的小鼠子宫,液氮速冻后-80℃冰箱中冻存待用。
1.3.2 人工诱导蜕膜化
于上午9:00,取假孕第4天的雌鼠,向其一侧子宫角中注射25~50 mL芝麻油,以诱导小鼠子宫发生蜕膜化反应;另一侧子宫角不注射芝麻油,作为阴性对照。假孕第8天,处死小鼠,取子宫,通过观察形态变化及称重确定是否发生蜕膜化,分别收集人工诱导蜕膜化的子宫角及其阴性对照侧子宫角,取材方法与早期妊娠模型取材方法相同。
1.4 方法
1.4.1 Real-time PCR
常规Trizol法提取各组小鼠子宫内膜总RNA,在紫外分光光度计上检测度,OD260/OD280比值为1.8~2.0,可用于后续试验,各组RNA保存于-80℃冰箱备用。反转录反应合成TEAD1的cDNA链保存在-20℃冰箱中备用。
参照GenBank设计TEAD1(NM_001166584.1)和GAPDH(NM_008084.2)跨内含子引物引物序列,TEAD1的sense:5′CGCCTTCTTCCTCGTCAA 3′,antisense:5′TCGCATACTCCGTCTCTAC 3′;GAP⁃DH sense:5′TCTCCTGCGACTTCAACA 3′,anti⁃sense:5′TGTAGCCGTATTCATTGTCA 3′。反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火/延伸60 s,40次循环。
1.4.2 原位杂交
参照GenBank设计TEAD1序列(NM_001166 584.1),设计跨内含子引sense 5′CCATCCAGC⁃CAGCAGTCACA 3′,antisense:5′GAACCTCGCATA CTCCGTCTCTAC 3′,PCR反应后,回收产物经连接、转化,质粒由上海生工测序,用SP6/T7聚合酶体外转录正义、反义地高辛标记的RNA探针,于-80℃冻存备用。
将妊娠1~8 d及人工诱导蜕膜化的小鼠子宫制成冰冻切片,原位杂交方法见参考文献[9]。原位杂交时取出切片,经4%多聚甲醛固定、1% Triton-X100透膜、预杂交液(5XSSC,50%去离子甲酰胺)预杂交15 min、滴杂交液(5XSSC,50%去离子甲酰胺,0.02%BSA,0.25 mg·mL-1tRNA,10%硫酸葡聚糖,200~500 ng·mL-1的探针)杂交过夜、SSC梯度洗涤、1%Blocking Solution封闭、碱性磷酸酶标记的抗地高辛抗体孵育过夜、滴加NBT/BCIP显色,出现棕褐色阳性信号时停止显色,甲基绿对染后拍照。
1.4.3 统计学分析
实时定量所得各组CT值经过2-ΔΔCT计算相对表达量,采用SPSS16.0软件进行统计学分析,数据以平均值±标准差()表示,均数比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 Real-time PCR结果
Real-time PCR所得各组CT值经过2-ΔΔCT计算相对表达量,并用SPSS16.0软件进行分析,数值以表示(见表1)。Real-time PCR检测结果显示TEAD1 mRNA在妊娠小鼠D1、D2、D4、D5非着床位点(D5NI)、D5着床位点(D5I)和D8子宫内膜中均有表达,表达量随妊娠天数增加而增强,其中除D4与D5NI无显著差异外,各组之间比较均有显著差异,有统计学意义(P<0.05),D5NI显著低于D5I,D8显著高于其他组(见图1)。
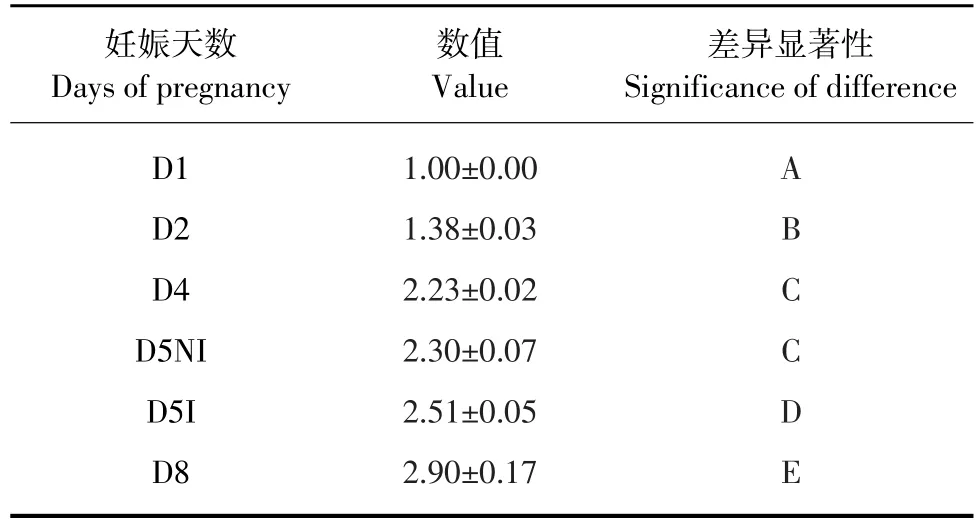
表1 TEAD1 mRNA在小鼠早期妊娠子宫中的相对表达及方差分析Table 1 Relative expression and analysis of variance of TEAD1 mRNA in pregnant mice uterus
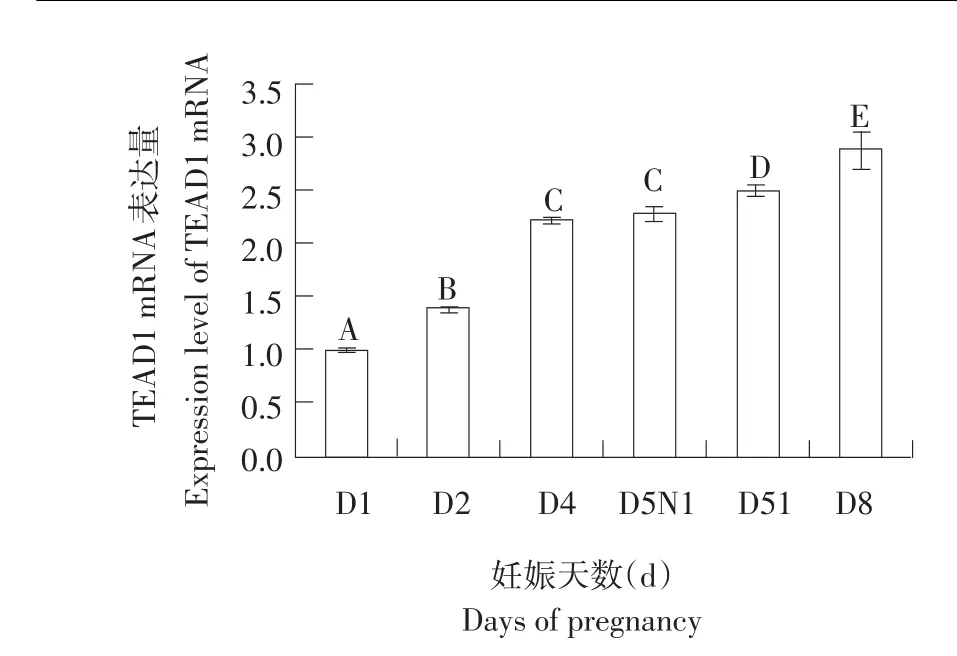
图1 TEAD1 mRNA在早期妊娠小鼠子宫中的表达Fig.1 Expression of TEAD1 mRNA in mouse uterus during early pregnancy
2.2 探针制备
2.2.1 扩增片段测序结果分析
含有重组质粒的菌液交由上海生工测序,用DNAMAN 6.0软件对测序结果与目的基因全序列拟进行比对分析。TEAD1扩增片段与已知的TEAD1 mRNA序列的相似比为100%,表明插入片段为TEAD1片段。
2.2.2 插入方向鉴定
目的基因克隆片段在连接到pGEM-T质粒载体过程中方向随机。采用上游引物、下游引物、T7引物和SP6引物,其中两种引物任意配对组成6种引物组合,使用PCR方法快速鉴定克隆质粒。将克隆片段的正义链插入载体中T7序列下游,反义链插入SP6序列下游,定义为正向插入,则电泳时对应于上游引物-SP6、下游引物-T7将扩增有条带;反之定义为反向插入。PCR结果显示上游引物-T7、下游引物-SP6出现扩增条带,表明TEAD1的克隆片段成功插入pGEM-T载体且为反向插入(见图2)。选用T7聚合酶制备反义cRNA探针,SP6聚合酶制备正义探针。
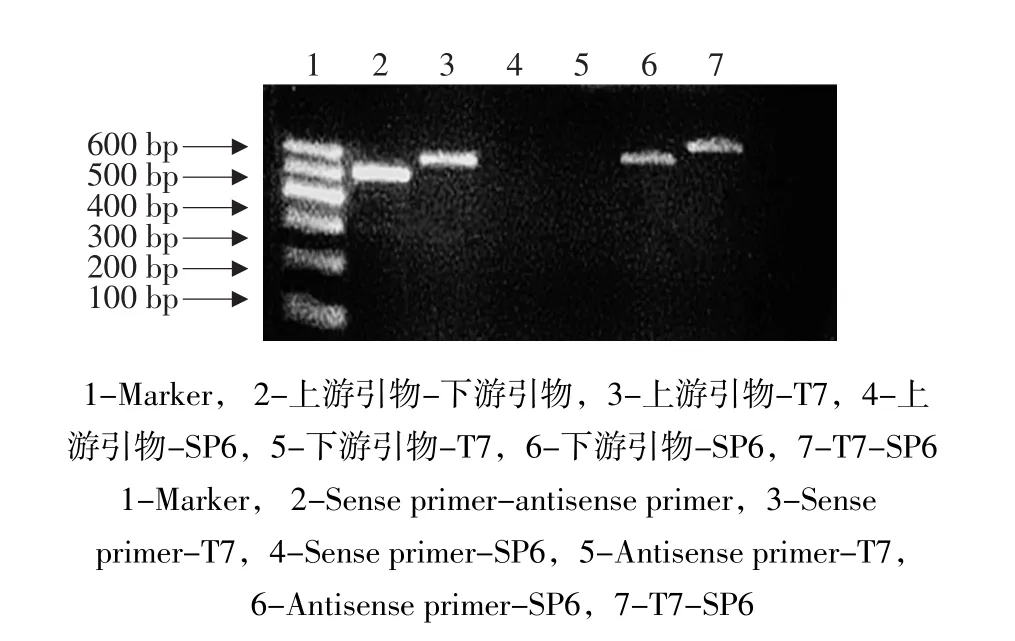
图2 TEAD1扩增片段插入方向的鉴定Fig.2 Identification of the inserting direction of TEAD1 cDNA fragments
2.3 人工诱导蜕膜化组织的鉴定
假孕第8天上午9:00,将一侧子宫角注油的小鼠处死,取出子宫,观察其形态变化,结果发现,注油一侧子宫膨胀变粗,而未注油一侧未发生变化,证明小鼠子宫人工诱导蜕膜化成功(见图3)。
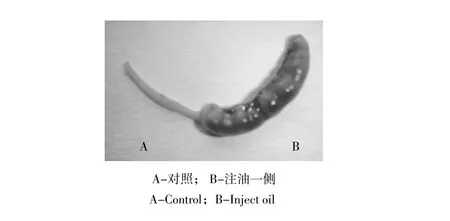
图3 人工诱导蜕膜化子宫Fig.3 Uterus of artificial decidualization
2.4 TEAD1 mRNA在子宫中表达的分析
TEAD1 mRNA在早期妊娠小鼠子宫中表达强度结果见表2,将信号强度分为阴性(-)、弱阳性(+)、阳性(++)和强表达(+++)4个等级,定位结果见图4。结果显示,在妊娠D1~D4及D5非着床位点,均未检测到TEAD1 mRNA阳性信号。在D5着床位点围绕胚胎周围的蜕膜细胞检测到明显的TEAD1 mRNA阳性信号,D6~D8子宫中TEAD1 RNA出现在蜕膜细胞区,随着妊娠进行,强度呈逐渐增强趋势。TEAD1 mRNA也强表达人工诱导蜕膜化组织中,而在蜕膜对照子宫中未检测到阳性信号。
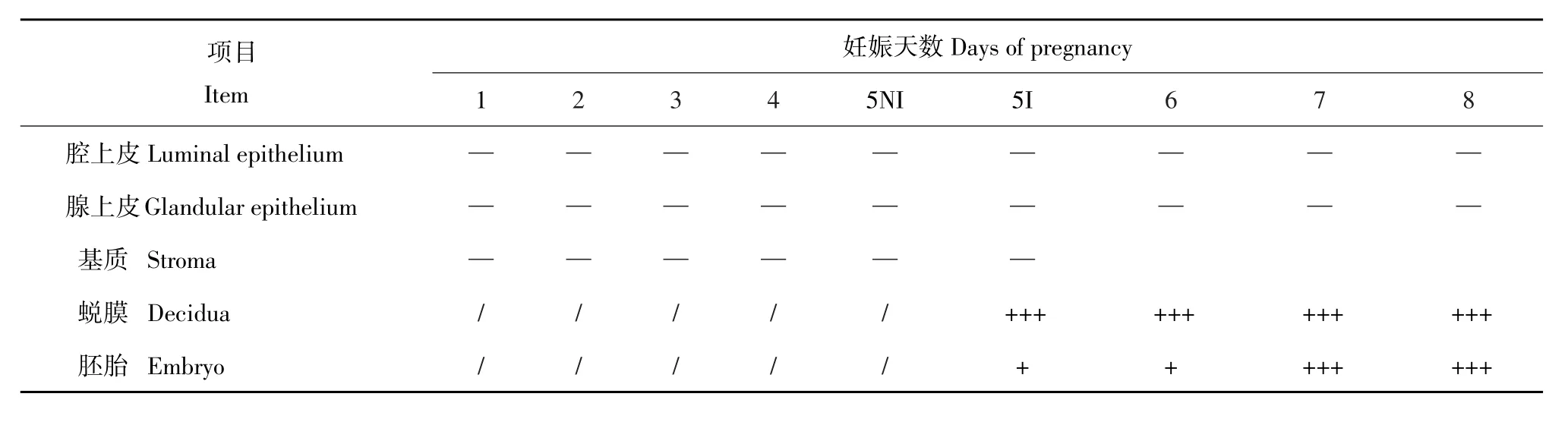
表2 TEAD1 mRNA在早期妊娠小鼠子宫中的表达Table 2 Expression of TEAD1 mRNA in mouse uterus during early pregnancy
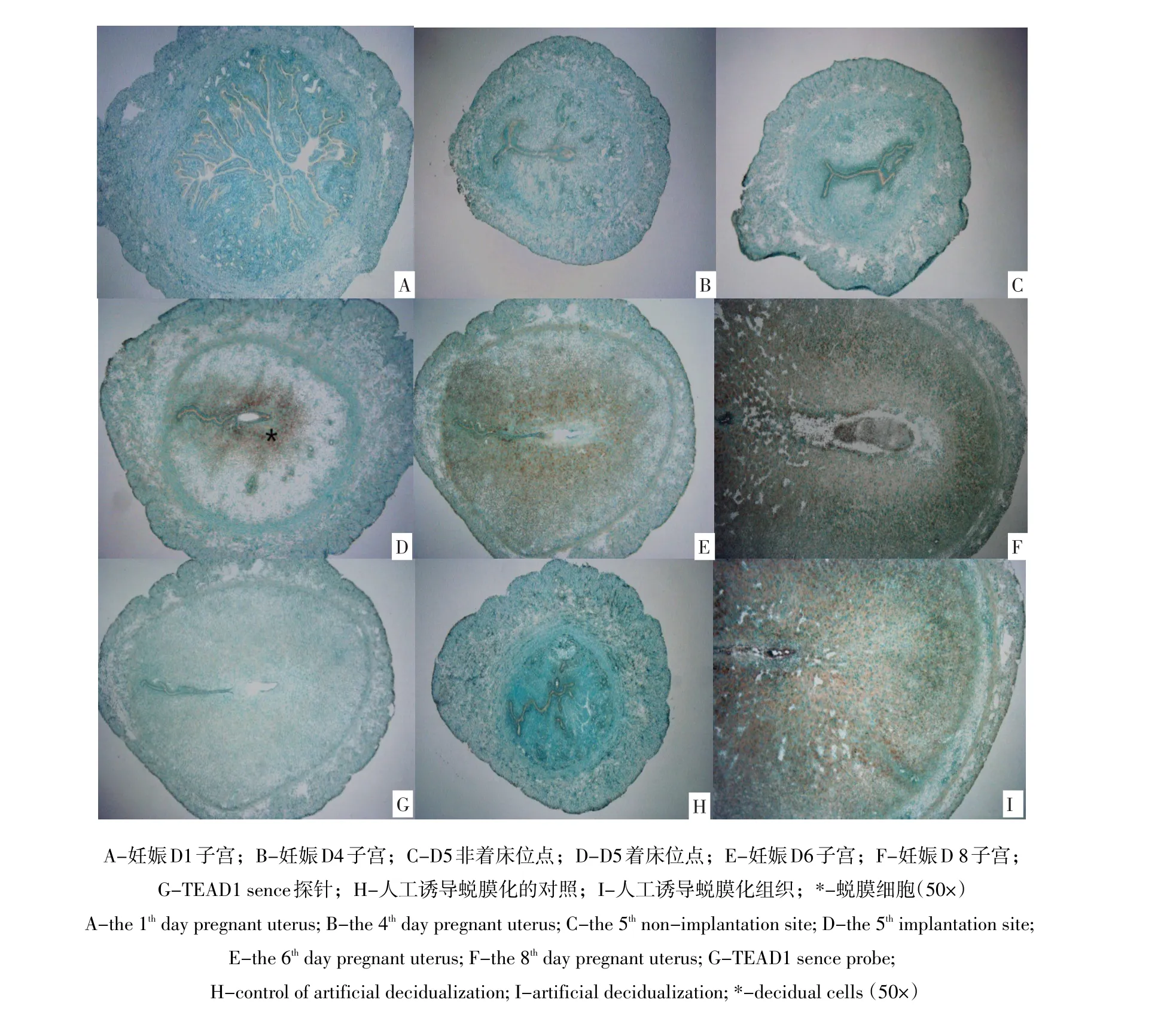
图4 原位杂交检测TEAD1 mRNA在小鼠早期妊娠子宫及人工诱导蜕膜子宫中的表达情况Fig.4 In situ hybridization was used to detect the expresstion of TEAD1 mRNA in uterus of the early pregnant and artificial decidualization mouse
3 讨论与结论
TEAD蛋白是高度保守的转录因子,参与胚胎发育和各种组织分化过程[8],也参与多种癌症发生过程[10-13]。TEADs发挥基因调控作用需要额外因子或辅激活物[14],这些因子大体上分为YAP及其同源物TAZ;Vgll蛋白;p160核受体辅激活物家族[5],其中研究最多的为YAP。在MCF10A细胞中YAP过表达诱导上皮-间质转化(EMT)[15],在多种人类癌症组织也检测到高YAP蛋白水平[16],是肿瘤发生标志。YAP自身没有DNA结合活性,需通过与TEAD结合,共同配合调控基因表达[5],TEAD需要YAP诱导的基因表达、细胞生长、锚定非依赖性生长和EMT[17]。研究表明,TEADs与YAP/TAZ结合可上调CTGF(Connective tissue growth factor)、Cyr61、受体酪氨酸激酶Axl、Ki67、c-myc和sur⁃vivin,促进癌症发展[17-19]。可知,TEAD与YAP在促进肿瘤细胞增殖中发挥重要作用。胚胎着床过程中,子宫内膜基质细胞发生广泛的增殖分化为蜕膜细胞,蜕膜细胞常有双核或多倍体状态[20]。癌细胞在增殖过程中也可出现巨核、双核或多核现象,与蜕膜细胞相似。鉴于TEADs在癌细胞增殖中的作用,推测TEAD1在蜕膜细胞增殖调控中起重要作用。
原位杂交结果显示,在小鼠妊娠1~4 d及第5天非着床位点子宫检测不到TEAD1 mRNA表达,提示TEAD1可能对着床时子宫接受态调节不起作用,而在妊娠第5天着床位点处的胚胎周围的蜕膜区域开始检测到TEAD1 mRNA阳性信号,妊娠6~8 d,子宫中TEAD1 mRNA的表达范围从围绕胚胎的蜕膜区域逐渐扩展到整个蜕膜区,强度呈增强趋势与Real-time PCR结果一致,推测TEAD1可能由YAP激活转录出TEAD1,TEAD1-YAP共同调控与蜕膜化相关基因表达,参与小鼠子宫蜕膜化过程,TEAD1 mRNA也强表达于人工诱导蜕膜化组织中,进一步加强对TEAD1功能推测证据。
本试验首次发现TEAD1 mRNA在妊娠小鼠子宫蜕膜细胞中高表达。Hong等研究表明,YAP/ TAZ与TEAD共同组成Hippo通路主要效应器[21],当Hippo通路激活时,其核心组成部分Lats1/2激酶直接磷酸化YAP使其失活[22],限制细胞过度增殖,Hippo通路通过抑制细胞的增殖与促进凋亡限制控制器官大小[23-24],因此Hippo通路是否在蜕膜化过程发挥作用,有待进一步探究。
本研究结果显示,TEAD1在小鼠围着床期子宫内膜呈时空特异性表达,且在人工诱导蜕膜化模型中强表达,提示TEAD1可能参与子宫内膜蜕膜化过程,但TEAD1是否与TAP/TAZ配对激活相关基因的转录,是否通过Hippo通路促进蜕膜细胞的凋亡需深入研究。
[1]Correia da Silva G,Bell S C,Pringle J H.Patterns of uterine cellu⁃lar proliferation and apoptosis in the implantation site of the rat during pregnancy[J].Placenta,2004,25(6):538-547.
[2]杨增明,孙青原,夏国良.生殖生物学[M].北京:科学出版社, 2005.
[3]Anbanandam A,Albarado D C,Nguyen C T,et al.Insights into transcription enhancer factor 1(TEF-1)activity from the solution structure of the TEA domain[J].Proc Natl Acad Sci,2006,103: 17225-17230.
[4]Xiao J H,Davidson I,Ferrandon D,et al.One cell-specific and three ubiquitous nuclear proteins bind in vitro to overlapping mo⁃tifs in the domain B1 of the SV40 enhancer[J].EMBO J,1987,6 (10):3005-13.
[5]Pobbati A V,Hong W.Emerging roles of TEAD transcription fac⁃tors and its coactivators in cancers[J].Cancer Biology&Therapy, 2013,14(5):390-398.
[6]Atsushi Sawada,Hiroshi,Kiyonari,et al.Redundant roles of TEAD1and Tead2 in notochord development and the regulation of cell proliferation and survival[J].Mol Cell Boil,2008,28(10): 3177.
[7]Wang F,Wang H,Wu H,et al.TEAD1 controls C2C12 cell prolif⁃eration and differentiation and regulates three novel target genes [J].Cell Signal,2013,25(3):674-81.
[8]Landin Malt A,Cagliero J,Legent K,et al.Alteration of TEAD1 expression levels confers apoptotic resistance through the tran⁃scriptional up-regulation of livin[J].PLoSONE,2012,7(9): 45498.
[9]李永旺.Tead4在小鼠围着床期子宫中的表达研究[D].哈尔滨:东北农业大学,2013:14-15.
[10]Han W,Jung E M,Cho J,et al.DNA copy number alterations and expression of relevant genes in triple-negative breast cancer[J].Genes Chromosomes Cancer,2008,47:490.
[11]Richardson A L,Wang Z C,De Nicolo A,et al.X chromosomal abnormalities in basal-like human breast cancer[J].Cancer Cell, 2006(9):121-132.
[12]Nowee M E,Snijders A M,Rockx D A,et al.DNA profiling of pri⁃mary serous ovarian and fallopian tube carcinomas with array com⁃parative genomic hybridization and multiplex ligation-dependent probe amplification[J].J Pathol,2007,213:46-55.
[13]Skotheim R I,Autio R,Lind G E,et al.Novel genomic aberrations in testicular germ cell tumors by array-CGH,and associated gene expression changes[J].Cell Oncol,2006,28:315-326.
[14]Xiao J H,Davidson I,Matthes H,et al.Cloning,expression,and transcriptional properties of the human enhancer factor TEF-1[J]. Cell,1991,65:551-568.
[15]Overholtzer M,Zhang J,Smolen G A,et al.Transforming proper⁃ties of YAP,a candidate oncogene on the chromosome 11q22 am⁃plicon[J].Proc Natl Acad Sci,2006,103:12405-12410.
[16]Zhao B,Wei X,Li W,et al.Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tis⁃sue growth control[J].Genes Dev,2007,21:2747-2761.
[17]Zhao B,Ye X,Yu J,et al.TEAD mediates YAP-dependent gene induction and growth control[J].Genes Dev,2008,22:1962-1971.
[18]Xu M Z,Chan S W,Liu A M,et al.AXL receptor kinase is a medi⁃ator of YAP dependent oncogenic functions in hepatocellular car⁃cinoma[J].Oncogene,2011,30:1229-1240.
[19]Dong J,Feldmann G,Huang J,et al.Elucidation of a universal sizecontrol mechanism in drosophila and mammals[J].Cell,2007, 130:1120-1133.
[20]Ansell J D,Barlow P W,McLaren A.Binucleate and polyploid cells in the deciduas of the mouse[J].J Embryol Exp Morphol, 1974,31:223-227.
[21]Hong W,Guan K L.The YAP and TAZ transcription co-activa⁃tors:Key downstream effectors of the mammalian Hippo pathway [J].Semin Cell Dev Biol,2012,23:785-793.
[22]Hao Y,Chun A,Cheung K,et al.Tumor suppressor LATS1 is a negative regulator of oncogene YAP[J].Journal of Biological Chemistry,2008,283(9):5496-5509.
[23]Huang J,Wu S,Barrera J,et al.The hippo signaling pathway coor⁃dinately regulates cell proliferation and apoptosis by inactivating yorkie,the Drosophila homolog of YAP[J].Cell,2005,122: 421-434.
[24]Zhao B,Lei Q Y,Guan K L.The Hippo-YAP pathway:new con⁃nections between regulation of organ size and cancer[J].Curr Opin Cell Biol,2008,20:638-646.
Expression of TEAD1 in endometrium of mice during peri-implantationperiod/
NI Hua,BEN Wenrui,LI Wenping,LI Ruiting,JIN Fangyuan(School of Life Science,NortheastAgricultural University,Harbin,150030,China)
Real-time PCR andin situhybridization were used to detect the expresstion of TEAD1 in peri-implantation uterus of mice and in artificial decidual cells.Real-time PCR results showed that the expression level of TEAD1 mRNA was gradually increased in pregnant mice 1-8 d uterus;in situ hybridization showed that,TEAD1 strongly expressed in uterine decidual cells and embryos from pregnant 5-8 d and artificial decidual cells.Inferred TEAD1 might be involved in regulating uterine stromal decidualization and play an important role in embryo implantation process.
TEAD1;embryo implantation;decidualization;mice
Q26
A
1005-9369(2014)06-0097-06
时间 2014-6-11 16:12:46 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1612.011.html
倪华,贲文锐,李文萍,等.TEAD1在小鼠围着床期子宫中的表达研究[J].东北农业大学学报,2014,45(6):97-102.
Ni Hua,Ben Wenrui,Li Wenping,et al.Expression of TEAD1 in endometrium of mice during peri-implantation period[J]. Journal of Northeast Agricultural University,2014,45(6):97-102.(in Chinese with English abstract)
2012-10-24
国家自然科学基金(30500361)
倪华(1973),女,副教授,博士,硕士生导师,研究方向为胚胎着床与卵泡发育。E-mail:huani@neau.edu.cn

