番茄果实光滑基因F的分子标记筛选及种质资源鉴定
许向阳,于亭亭,赵婷婷,李帅,姜景彬,张贺,李景富
(东北农业大学园艺学院,哈尔滨 150030)
番茄果实光滑基因F的分子标记筛选及种质资源鉴定
许向阳,于亭亭,赵婷婷,李帅,姜景彬,张贺,李景富
(东北农业大学园艺学院,哈尔滨 150030)
以含F基因的果实光滑型品种12509为母本,以果实皱褶型品种12510为父本配制杂交组合,以亲本、F1及其F2代分离群体为研究材料,采用AFLP分子标记技术筛选与果实光滑基因F连锁的分子标记。通过对256对AFLP引物进行筛选,获得6个与F基因连锁的标记:E13M08、E11M07-B、E11M12-D、E11M08-A、E01M10和E10M16-E,连锁遗传距离分别为6.4、8.5、10.9、17.1、23.5和24.2 cM。将E13M08标记用于种质资源筛选,获得45份果实光滑型材料,为番茄外观品质育种奠定基础。
番茄;果实;F基因;AFLP;种质资源
影响番茄果实形状的主要位点有ovate、sun、fs8.1、f和lc[1],此外也发现几个次要位点存在。研究表明,番茄果实颜色受B、og、hp、dg(hp⁃ dg)、Del、MOB等9个基因位点控制[2],目前番茄育种工作主要着重于果实形状、颜色、畸形果等外观品质研究,果实表面光泽度和光滑度与有无棱褶等方面有待进一步研究,以培育更高商品性。
目前有多种分子标记技术,如以Southern杂交为基础RFLP、VNTR,以PCR为基础SSR、SCAR、RGA等[3],基于限制性酶切和PCR的DNA标记,AFLP、CAPS等[4],基于单核苷酸多态性的DNA标记、SNP、RAPD,具有筛选准确度高,可缩短育种周期等优点。目前,关于番茄果实光滑基因F的分子标记研究国内外尚未见相关报道,本文应用果实光滑型品种12509为母本和果实皱褶型品种12510为父本杂交获F1代,经F1代自交构建标记F2代群体;利用AFLP分子标记技术对亲本、F1代及F2代群体进行筛选,获得与果实光滑基因F紧密连锁的标记,采用JoinMap4.0遗传作图软件进行遗传连锁分析,将该AFLP标记定位,确定连锁遗传距离,利用所获得的连锁标记对种质资源进行筛选,对需鉴定的种质资源进行田间表型调查,比较二者吻合率,确定标记准确性,为果实光滑型番茄遗传育种提供理论依据。
1 材料与方法
1.1 仪器及试剂
1.1.1 仪器
紫外分光光度计、高压灭菌锅、小型高速离心机、低温离心机、-20℃冰箱、-80℃冰箱、超净工作台、液氮罐、德国Biometra T-Gradient The⁃moblock型PCR仪、凝胶自动成像系统(GDS-800)、系列电泳仪、电泳槽等琼脂糖凝胶电泳相关设备(DYY-8B型),聚丙烯酰胺凝胶电泳的相关设备、通风橱、Eppendorf Research和Reference系列移液器、电热恒温水浴锅(DK-8D型)及其他常用分子生物学试验设备。
1.1.2 试剂
EDTA-Na2H2O、CTAB、RNase、Mse I、Eco R I、2×Taq Master Mix酶、ATP、T4DNA连接酶均为MBI公司产品,AFLP引物及接头、DNA Marker由北京六合华大基因科技股份有限公司合成或生产,Repel、Binding由北京鼎国生物技术公司生产,尿素、过硫酸铵、TEMED均为Amsensco。其他试剂如异戊醇、氯仿、氢氧化钠、异丙醇、甲醛、冰乙酸等化学试剂由哈尔滨市宝瑞生物试剂公司和哈尔滨市德美试剂公司提供。琼脂糖、Tris-HCl为进口分装,其他试剂为国产分析纯试剂。
1.2 材料
1.2.1 番茄材料
番茄母本材料12509为果实光滑型高代自交纯合系,含有F基因;父本12510为果实皱褶型高代自交纯合系,不含F基因;杂交F1代、自交F2代分离群体及70份用于种质资源筛选的番茄材料,均由东北农业大学园艺学院番茄课题组提供。
1.2.2 AFLP引物
试验采用EcoR I和MseI酶切,其接头序列为:

预扩增引物为Eco R I pre 和Mse I pre,序列为:
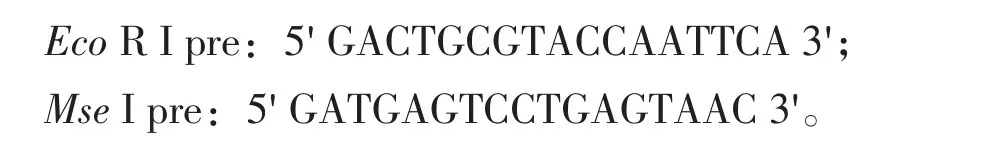
选择性扩增的引物是根据番茄基因组大小和其碱基偏爱性,选择上游E引物16条,下游M引物16条,其序列见表1。本试验用256对AFLP引物进行分子标记筛选,接头采用E接头和M接头,所用AFLP引物均由北京六合华大基因科技股份有限公司合成。
1.3 方法
1.3.1 番茄果型鉴定
在番茄果实成熟期,经田间表型观察区分确定果实形状,即光滑型果实与皱褶型果实,母本为光滑型果实,父本为皱褶型果实(果实表面有棱褶),F1代杂交群体均为光滑型果实,F2代群体中果型出现分离现象,如图1所示。
1.3.2 番茄叶片DNA提取
在F2代分离群体果实成熟时期取其幼嫩叶片200 mg装在已灭菌的EP管内,液氮速冻后,-80℃贮存,试验采用CTAB法[5]提取叶片DNA。1%琼脂糖凝胶检测提取物浓度,并用灭菌后去离子水将各样本浓度稀释至50 ng·μL-1,于-20℃冰箱内贮存,以用于AFLP分子标记研究。
1.3.3 番茄果型基因池建立
根据番茄果型的田间调查情况,分别从果实光滑及皱褶的植株中各随机选取25株,利用BSA法[6]建立果型基因池。
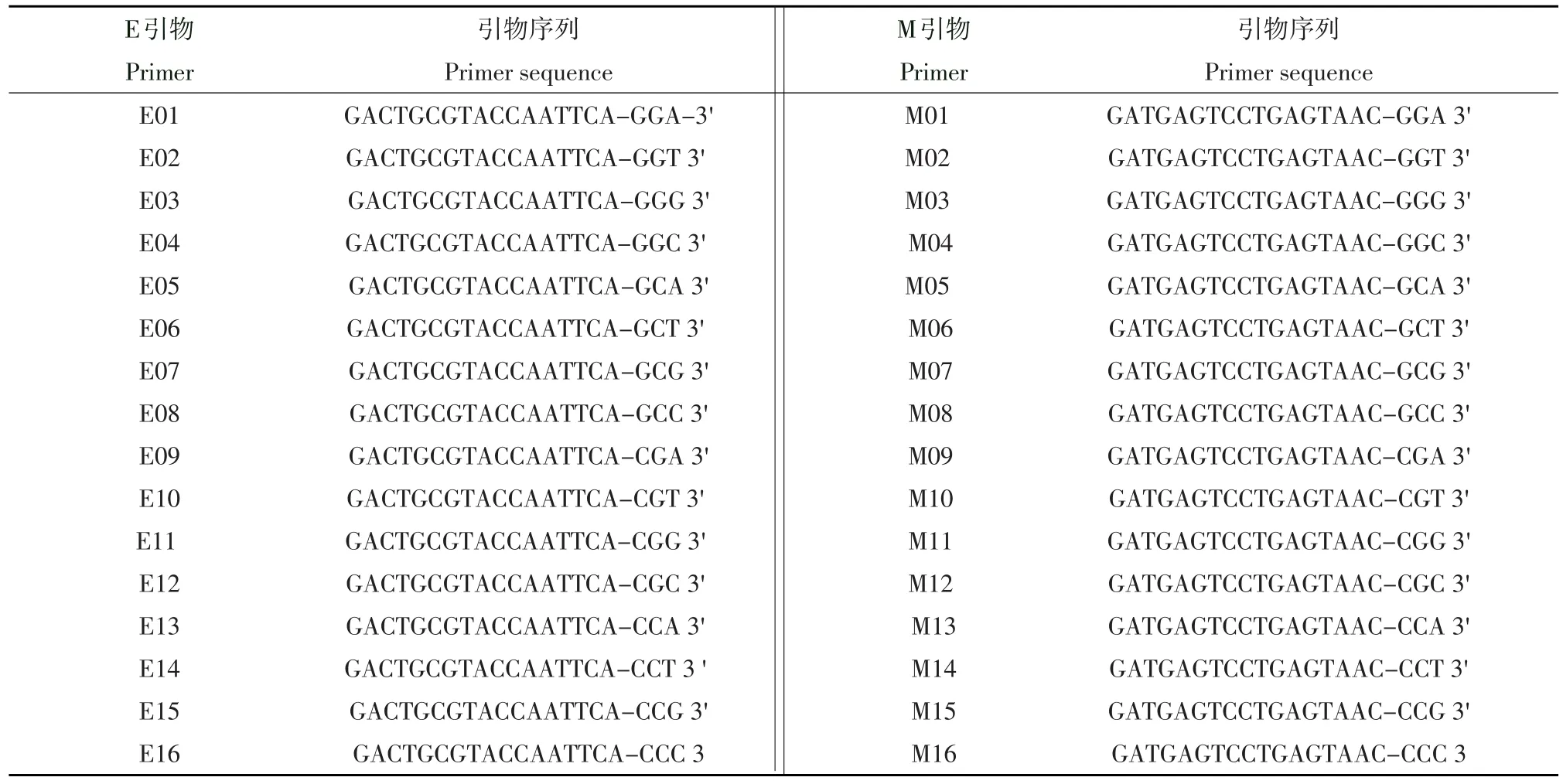
表1 AFLP标记的E引物和M引物Table 1 AFLP E primers and M primers

图1 番茄成熟果实Fig.1 Tomatomature fruit
1.3.4 AFLP分子标记
番茄叶片DNA采用EcoR I和MseI进行酶切。具体AFLP分子标记方法[7]参考Vos等,酶切连接体系为:DNA(100~500 ng)3.0 μL,Eco RⅠadapter(5 pmol·μL-1)1.0 μL,MseⅠadapter(50 pmol·μL-1)1.0 μL,ATP(10 mmol·L-1)1.0 μL,10×Buffer 6.0 μL,EcoRⅠ(10 U·μL-1)0.5 μL,MseⅠ(10 U·μL-1)0.5 μL,T4DNA Ligase(5 U·μL-1)0.6 μL,加ddH2O至50 μL,反应程序为37℃酶切与连接6~8 h(时间不宜过长)。
预扩增体系为DNA(酶切连接后产物)6.0 μL,EcoR I-primer 0.6 μL,MseI-primer 0.6 μL,2× TaqMaster Mix 8.0 μL,加ddH2O至25 μL。反应程序为94℃3 min;94℃30 s,56℃30 s,72℃ 1 min,24个循环;72℃10 min,4℃终止反应。取5 μL预扩增产物于1%琼脂糖凝胶中检测扩增结果,依据条带清晰度情况,确定将预扩产物稀释40倍为最佳,以用于选择性扩增,余下的预扩增产物于-20℃保存。
选择性扩增体系为DNA(预扩增产物稀释40×)6.0 μL,Exx(50 ng·μL-1)1.0 μL,Mxx(50 ng·μL-1)1.0 μL,2×TaqMaster Mix 8.0 μL,加ddH2O至25 μL。反应程序为94℃3 min;94℃30 s,65℃30 s,(每个循环降低0.7℃),72℃1 min,12个循环;94℃30 s,56℃30 s,72℃1 min,25个循环(每个循环增加1 s);72℃10 min;4℃终止反应。将选择性扩增产物在PCR仪中95℃变性8 min后立即置于冰水混合物中,用6%变性聚丙烯酰胺凝胶电泳分离变性产物,银染参照Bassam等方法[8],银染后进行分析。
1.3.5 种质资源筛选
利用E13M08标记对70份种质资源进行鉴定,并与田间表型鉴定结果结合分析,获得有应用价值的种质资源。
2 结果与分析
2.1 田间果型鉴定
观察供试材料在果实成熟期的田间表型。经鉴定表明,两个亲本间果实表现差异明显,父本表现为皱褶型果实,母本表现为光滑型果实,F1代杂交群体均表现为光滑型果实,F2代分离群体果实光滑型与皱褶型实际比例为3.174∶1,x2检测符合3∶1的分离比例。分析结果表明,母本12509中所含F基因符合单基因显性遗传规律。
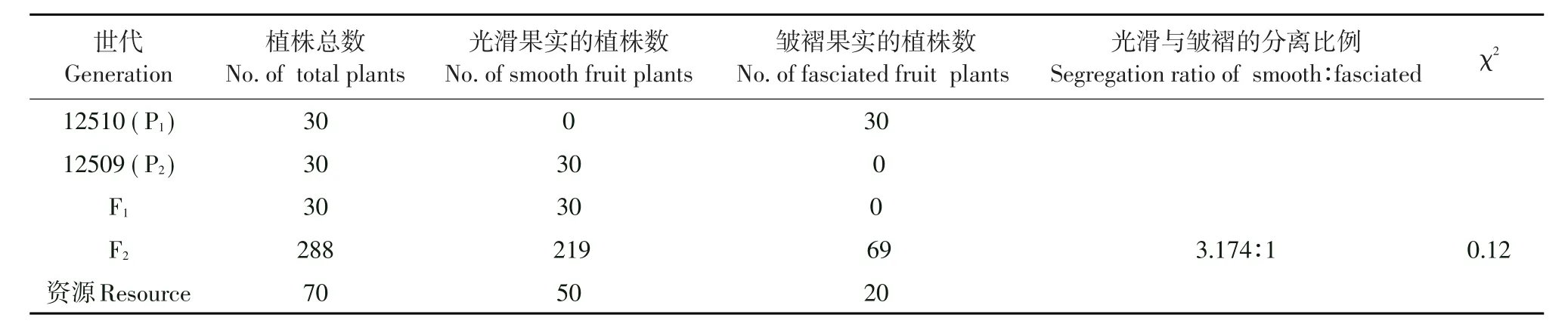
表2 不同世代试验材料F基因的遗传分析Table 2 Genetic analysis of F gene in different generation
2.2 AFLP分子标记筛选及分析
利用父本(12510)与母本(12509)对256对AFLP引物进行筛选,获得82对差异性引物(见图2),详细引物见表3,利用果实光滑与皱褶的果型基因池进行复选,筛选出33对差异较显著的AFLP引物(见图3)。使用筛选出33对引物对F2代分离群体共288株试验材料分别进行扩增,详细引物见表4。对扩增结果进行记录,有带记为“1”,无带记为“0”(见图4),应用JoinMap4.0软件分析试验数据,确定遗传连锁距离(cM),得到6个连锁标记:E13M08、E11M07-B、E11M12-D、E11M08-A;E01M10和E10M16-E,连锁遗传距离分别为6.4、8.5、10.9、17.1、23.5和24.2 cM,AFLP分子标记遗传连锁图谱见图5。

图212509 ×12510群体筛选的部分AFLP引物Fig.2 Screening AFLP primers on 12509×12510 population
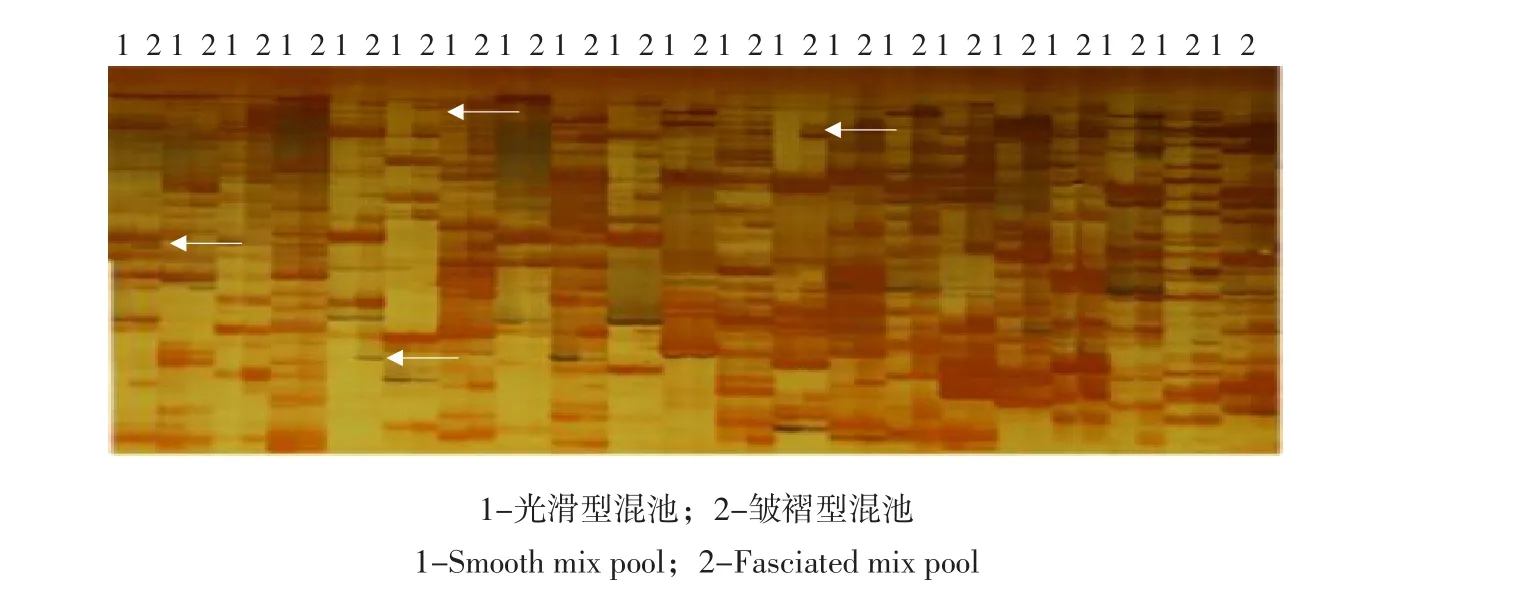
图3 混合基因池筛选出的部分AFLP特异性引物Fig.3 Screening AFLP primers on mix pool

表3 从亲本中筛选到的特异引物Table 3 Screening the specific primers from 12509 and 12510
表4 用于群体F2单株选择性扩增的特异引物Table 4 Primers used in amplication of F2individual plants of 12509×12510

图4 引物E13M08在部分F2群体中的AFLP扩增结果Fig.4 AFLP PCR amplification results using E13M08 primers in partial F2population

图5 AFLP分子标记遗传连锁图谱Fig.5 Genetic linkage map of AFLP markers
2.3 种质资源筛选
对70份种质资源进行田间表型鉴定和分子标记鉴定,田间表型鉴定70份材料中有50份为光滑品种,应用E13M08标记对70份种质资源进行筛选,二者结果吻合的品种为45份,吻合率为90%。具体见表5。

表5 F2代分离群体中部分单株的分子鉴定结果与田间表型鉴定结果Table 5 Result of molecular identification and field in partial F2population
3 讨论与结论
经典遗传学认为控制果实光滑性状F基因符合单基因显性遗传规律,而Barrero等认为控制此性状是由主效基因和多个微效基因共同作用,为数量遗传[9]。试验通过对亲本、F1代杂交群体及F2代分离群体进行田间果型鉴定,父本表现为皱褶型果实,母本表现为光滑型果实,F1代杂交群体均表现为光滑型果实,F2代分离群体果实光滑型与皱褶型比例接近3∶1,F基因符合单基因显性遗传规律。
目前分子标记技术因选育周期短、准确性高等优点而被应用于番茄品质育种工作中,其中AFLP分子标记技术可靠性强、多态性高、可重复性较好、条带丰富清晰,被认为是有效分子标记技术,本试验通过利用AFLP分子标记技术,获得6个与果实光滑基因F相连锁分子标记,且有两个标记(E13M08、E11M07-B)在10 cM以内,可用于分子遗传育种,在种质资源筛选过程中,分子鉴定结果与田间表型鉴定结果差异性显著,除环境或人为原因外,也可能E13M08标记与F基因连锁不紧密,这与试验材料亲缘关系有关,还有待于筛选连锁更为紧密的分子标记,为今后分子育种工作奠定基础。
[1]Cong B,Barrero L S,Tanksley S D.Regulatory change in YABBY like transcription factor led to evolution of extreme fruit size dur⁃ing tomato domestication[J].Nature Genetics,2008,40(6):800-804.
[2]Ronen G,Carmel-Goren L.An alternative pathway to β-carotene formationin plant chromoplasts discovered by map-based cloning of beta and old-gold color mutation in tomato[J].PNAS,2000,97 (20):11102-11107.
[3]李红双,李景富,许向阳.番茄抗根结线虫病基因的RAPD和SCAR标记[J].植物病理学报,2006,36(2):185-188.
[4]许向阳.番茄叶霉病抗病基因Cf-11、Cf-19的分子标记研究[D].哈尔滨:东北农业大学,2007.
[5]Williamson V M,Ho J Y,Wu F F,et al.A PCR-based marker tightly linked to the nematode resistance gene,Mi,in tomato[J]. Theoretical and Applied Genetics,1994,87:757-763.
[6]Michelmore R W,Paran I,Kesseli R V.Identification of markers linked to disease-resistance genes by bulked segregant analyses: A rapid method to detect markers in specific genomic regions by using segregating populations[J].Proceedings of the National Academy of the United States of America,1991,88:9828-9832.
[7]Vos P,Hogers R,Bleeker M.AFLP:A new technique for DNA fin⁃gerprinting[J].Nucleic Acids Research,1995,23:4407-4414.
[8]Bassam B J,Caetano Anollés G,Gresshoff P M.Fast and sensitive silver staining ofDNA in polyacrylamide gels[J].Anal Biochem, 1991,196:80-83.
[9]Barrero L S,Tanksley S D.Evaluating the genetic basis of multi⁃ple-locule fruit in a broad cross section of tomato cultivars[J]. Theor Appl Genet,2004,109:669-679.
Screening of molecular markers linked to fruit smoothFgene intomato and identification of germplasm resource/
XU Xiangyang,YU Tingting, ZHAO Tingting,LI Shuai,JIANG Jingbin,ZHANG He,LI Jingfu(School of Horticulture,Northeast Agricultural University,Harbin 150030,China)
Study identified the molecular marker linked to smooth fruitFgene of tomato.The linked marker was screened with a F2population between a smooth and fasciated parent(12509×12510)by AFLP technology.Total six AFLP markers had been identified to linked withFgene,E13M08,E11M07-B, E11M12-D,E11M08-A,E01M10 and E10M16-E.The genetic distances were 6.4,8.5,10.9,17.1,23.5 and 24.2 cM,respectively.AFLP marker E13M08 was used for the screening of germplasm resources.We obtained 45 cultivars which contained this marker.The study provided the basis for the appearance quality of tomato breeding.
tomato;fruit;Fgene;AFLP;germplasm resource
S641.2
A
1005-9369(2014)06-0032-06
时间 2014-6-11 16:08:56 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1608.007.html
许向阳,于亭亭,赵婷婷,等.番茄果实光滑基因F的分子标记筛选及种质资源鉴定[J].东北农业大学学报,2014,45(6):32-37.
Xu Xiangyang,Yu Tingting,Zhao Tingting,et al.Screening of molecular markers linked to fruit smoothFgene in tomato and identification of germplasm resource[J].Journal of Northeast Agricultural University,2014,45(6):32-37.(in Chinese with English abstract)
2013-12-06
国家自然科学基金(31272171);现代农业产业技术体系专项资金(CARS-25);黑龙江省杰出青年科学基金(JC201204)
许向阳(1969-),男,研究员,博士,博士生导师,研究方向为蔬菜遗传育种。E-mail:xxy709@126.com

