酶水解对大豆致敏蛋白P34免疫活性的影响及酶解产物理化性质研究
郑环宇,白小娟,张丽丽,董小超,许慧,韩建春,朱秀清
(1.东北农业大学食品学院,哈尔滨 150030;2.黑龙江省大豆技术开发研究中心,哈尔滨 150030)
酶水解对大豆致敏蛋白P34免疫活性的影响及酶解产物理化性质研究
郑环宇1,2,白小娟1,张丽丽1,董小超1,许慧2,韩建春1,2,朱秀清1,2
(1.东北农业大学食品学院,哈尔滨 150030;2.黑龙江省大豆技术开发研究中心,哈尔滨 150030)
采用不同来源的7种蛋白酶对大豆蛋白进行酶解,利用SDS-PAGE和水解度研究酶解去除P34的效果,通过Western Blot法测定酶解后大豆致敏蛋白P34免疫活性的变化。结果表明,经不同来源的蛋白酶处理后,大豆蛋白中致敏蛋白P34的含量都有不同程度降低,风味蛋白酶和碱性蛋白酶对P34的作用效果最强,可将P34完全去除。在最优的酶解条件下,两种大豆蛋白酶解物溶解性、保水性、乳化性、乳化稳定性和起泡性明显提高,而粘性、吸油性和泡沫稳定性降低。
大豆;大豆致敏蛋白P34;酶水解;理化性质
大豆蛋白作为一种优质植物蛋白源,不但具有丰富的蛋白质和与人体需求相平衡的氨基酸组成,而且还具有水溶性、脂溶性、乳化性、发泡性等功能特性,适于多种食品加工,但大豆蛋白中也含有一些致敏性蛋白。大豆致敏蛋白可以引起皮肤瘙痒、红肿、呼吸困难、昏厥甚至危及生命。调查表明美国约有0.5%的人对大豆过敏[1],而我国至今还没有大豆过敏人群的统计数字,在大豆过敏源方面的研究也相对较少。根据过敏源在线数据库的报道[2]。已在大豆中发现38种致敏蛋白。在这些致敏蛋白中,大豆致敏蛋白P34被称为大豆致敏蛋白Gly m Bd 30 K,属于半胱氨酸蛋白酶的木瓜蛋白酶超家族边缘成员,是一种糖蛋白,糖基化位点位于成熟蛋白第170位天冬酰胺处,多糖组成为甘露糖、N-乙酰氨基葡萄糖、岩藻糖、木糖,比例分别为3∶2∶1∶1[3-4]。P34结构由3对保守二硫键稳定,主要由α螺旋和β折叠结构域组成[5]。研究表明P34是大豆中的主要致敏蛋白[6-7],易引发过敏性皮炎,其特异性IgE抗体识别率高达65%[8],因此研究如何去除P34对降低大豆蛋白的致敏性具有重要意义。
本研究选取不同来源的七种蛋白酶对大豆分离蛋白进行酶解,通过对大豆致敏蛋白P34含量和大豆分离蛋白水解度比较,筛选出降解大豆致敏蛋白P34能力最强的酶种类,优化出消除P34致敏性的最佳酶解工艺条件,对最佳酶解条件下酶解物的功能特性进行研究。旨在为生产低致敏性大豆蛋白产品及其应用提供理论参考。低致敏性大豆蛋白不但可解决敏感人群食用大豆蛋白过敏问题,也为生产豆基婴幼儿配方粉代替动物乳品提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
大豆分离蛋白(蛋白质含量92.5%)购自哈高科大豆食品有限公司;丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、十二烷基磺酸钠(SDS)、β-巯基乙醇、N,N,N′,N′-四甲基乙二胺(TEMED)、考马斯亮蓝R-250、甘氨酸(Gly)、三羟甲基氨基甲烷(Tris)、牛血清白蛋白、预染的蛋白Marker(14.4~97.4 kDa)、4-Chloro-1-Naphthol,均购自Sigma公司;一次抗体:F5(NICS,Japan),二次抗体: IgG(H+L)(HRP-labeled Goat Anti-Mouse IgG(H +L)均购自Bioss Inc公司。木瓜蛋白酶、风味蛋白酶、菠萝蛋白酶、复合蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶,均购自诺维信公司;其他试剂均为国产分析纯。
1.1.2 仪器
DYY-6C型电泳仪(北京六一仪器厂)、DYY-24D型电泳槽(北京六一仪器厂)、DYCZ-40D转印电泳仪(北京六一仪器厂)、GL-20B高速冷冻离心机(上海安亭实验仪器厂)、FD-1D-50型真空冷冻干燥机(北京博医康实验仪器有限公司)、TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司)、水浴恒温摇床(上海天呈仪器厂)、水平摇床(北京六一仪器厂)、FJ200型高速分散均质机(上海标本模型厂)、凯氏定氮仪(上海玻璃仪器厂)、PHS-3C型酸度计(上海雷磁仪器厂)等。
1.2 方法
1.2.1 大豆分离蛋白致敏原组成及其致敏蛋白P34免疫活性分析
称取大豆分离蛋白50 mg置于1.5 mL离心管中,加入1 mL Tris-HCl(pH 8.2)缓冲液,涡旋混匀,超声30 min(每间隔10 min涡旋混匀1次)后,10 000 r·min-1离心30 min,取上清液。通过Brad⁃ford法测定其蛋白质含量后进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫印迹(Western Blot)试验,分析大豆蛋白分子组成及致敏蛋白P34的免疫活性。
1.2.1.1 大豆致敏蛋白P34含量的测定
利用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法,作用条件采用分离胶浓度为12%,浓缩胶浓度为4.5%,交联度为3.6%,进行垂直电泳,浓缩胶压力设为100 V,分离胶压力设为150 V,恒压运行2 h。蛋白质样品经适当稀释与溴酚蓝上样缓冲液按1∶1混合后制备成蛋白浓度为2 μg·μL-1上样液,沸水浴煮沸5 min,冷却后加样量为10 μL,电泳完毕后,采用考马斯亮蓝R-250染色40 min,经电泳脱色液脱色,待蛋白带清晰后,利用Bio Rad ChemiDocTMXRS+凝胶成像系统的Image LabTM软件分析电泳谱带。
1.2.1.2 大豆致敏蛋白P34免疫活性的分析研究
利用免疫印迹(Western Blot)法,通过观察大豆蛋白致敏原P34在Western Blot图谱中相应谱带的颜色深浅变化和有无,分析其致敏性的强弱变化,具体操作如下:
①转膜:将所测样品进行SDS-PAGE电泳。电泳完毕后将胶体从电泳槽卸下,并在电转移液中驯染8~10 min,同时在湿转印系统的底板(阳极)上方,按无纺纤维垫→加厚滤纸→硝酸纤维素膜(NC膜)→驯染的胶体→加厚滤纸→无纺纤维垫→负极顶板的顺序叠放,接通电源,恒流100 mV,转写3 h。
②NC膜的封闭:将转写后的NC膜,去离子水洗5 min后,放入含3%BSA的封闭液中室温下封闭12 h。
③1次抗体的孵育:将封闭后的NC膜,用TBST漂洗3次,每次10 min,然后放入盛有F5(用含1%BSA稀释液稀释1 000倍浓度为2 μg·mL-1)1次抗体的密闭容器中,37℃下轻摇孵育2 h。
④2次抗体的孵育:回收一抗后,用TBST漂洗3次,每次10 min,将漂洗后的NC膜放入2 000倍稀释的辣根过氧化物酶标记山羊抗小鼠IgG(H+ L)(HRP-labeled Goat Anti-Mouse IgG(H+L)的孵育液中,37℃轻摇孵育2 h。
⑤显色反应(大豆致敏蛋白P34的检测):回收二抗后将NC膜放入显色液(25 mL辣根过氧化物酶底物溶液,450 μL 4-Chloro-1-Naphthol,15 μL 30%H2O2,充分混匀)中,充分反应20~25 min,大豆致敏蛋白P34谱带即会显色,待目标蛋白谱带清晰出现后,将膜浸入1 mol NaCl溶液中,终止显色反应,然后用去离子水反复冲洗2~3遍,置滤纸上干燥后,利用Bio Rad ChemiDocTMXRS+凝胶成像系统的Image LabTM软件分析电泳谱带。
1.2.2 蛋白酶对大豆致敏蛋白P34酶解效果的筛选
选取7种蛋白酶用于试验。采用福林酚法测定各种蛋白酶的酶活力。在相同酶活力条件下,根据蛋白酶对大豆致敏蛋白P34的水解能力进行选择。将大豆蛋白配制成实际底物蛋白浓度为5%溶液,7种蛋白酶酶解条件见表1,以酶活与底物蛋白比为2 000 U·g-1加入相应的酶,将样品置于水浴摇床中反应60 min后,100℃沸水浴15 min使酶失活,冷却后采用SDS-PAGE法测定大豆致敏蛋白P34含量,茚三酮法测定大豆分离蛋白的水解度[9]。

表1 7种蛋白酶生产商推荐的最适反应条件和酶活力Table 1 Optimal reaction conditions of seven proteases and protease activity
1.2.3 蛋白酶反应条件的优化
对优选出的蛋白酶进行酶解条件优化。以大豆致敏蛋白P34含量和大豆分离蛋白水解度为考查指标,对加酶量(100、300、500、1 000、1 500和2 000 U·g-1)、酶解时间(15、20、30、60、90和120 min)、pH(6.0、6.5、7.0、7.5、8.0和8.5)、温度(35、40、45、50、55和60℃),4个条件逐一进行优化。
1.2.4 蛋白酶解物功能性测定
将大豆分离蛋白在优化后的酶解条件下进行酶解,酶解后100℃沸水浴15 min使酶失活。将酶解液在14 000 r·min-1下均质2 min,真空冷冻干燥后-20℃保存备用。
1.2.4.1 溶解性的测定
溶解性以氮溶解指数(NSI)表示,分别称取2.0 g大豆蛋白酶解物(大豆分离蛋白作对照),加入50 mL去离子水,配制成一定浓度的蛋白溶液,将蛋白溶液置30℃水浴加热1 h后,取出以3 000 r·min-1离心20 min,将上清液进行凯氏定氮,求出水溶性氮含量。样品中总氮含量采用凯氏定氮法测定,NSI的计算公式如下:
NSI(%)=水溶性氮/总氮×100%
1.2.4.2 粘度的测定
采用毛细管粘度计法测定:配制底物浓度为2.0%的大豆蛋白酶解物(大豆分离蛋白作对照)溶液,用NDJ-8S型粘度计测定其粘度。
1.2.4.3 吸油性的测定
[10]的方法,准确称取3.0 g大豆蛋白酶解物(大豆分离蛋白作对照),加入大豆油9 mL,搅拌均匀后室温放置30 min,使之充分吸油,然后离心(7 500 r·min-1,30 min),除去液体后,测定残留物的重量,重复试验3次,结果取平均值表示。
吸油率(g·g-1)=(离心后残留物重-试样干重)/试样干重
1.2.4.4 保水性的测定
参照文献[11]的方法,准确称取5.0 g大豆蛋白酶解物(大豆分离蛋白作对照)加入50 mL去离子水,搅拌均匀后室温放置30 min,然后离心(4 500 r·min-1,30 min)分离出上清液,测定残留物质量,同时测定上清液中的氮含量转换为蛋白质质量,重复试验3次,结果取平均值表示。
保水率(g·g-1)=[离心后残留物重-(试样干重-上层清液中蛋白质含量)]/(试样干重-上层清液中蛋白质含量)
1.2.4.5 乳化性及乳化稳定性的测定
参照文献[12]的方法。蛋白乳化活性用EA表示,乳化稳定性用ESI表示。配制浓度为0.75%大豆蛋白酶解物溶液(大豆分离蛋白作对照)15 mL,大豆油5 mL,高速乳化均质机以一定速度均质40 s,连续3次共计2 min,制成乳浊液后,立即用微量注射器从底部3个不同点分别抽取20 μL乳状液放入3支试管中,再各加入5 mL 0.1%SDS混匀,用0.1%的SDS作为空白,在500 nm下记录此时的吸光值E0,30 min后,同样方法再抽取20 μL测定吸光度值Et。
计算公式如下:
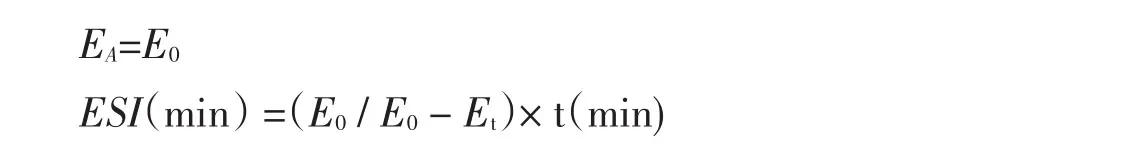
1.2.4.6 起泡性及泡沫稳定性的测定
蛋白的起泡性用FC表示,泡沫稳定性用FS表示。测定方法为,取100 mL浓度为0.75%大豆蛋白酶解物溶液(大豆分离蛋白作对照),置于500 mL量筒中,使用高速乳化均质机以一定速度均质40 s,连续3次共计2 min,记录均质后页面高度记为V0,静置30 min后记录页面高度,记为Vt。计算公式如下:
起泡能力FC(%)=(V0-100)/100×100%
泡沫稳定性FS(%)=(Vt-100)/(V0-100)×100%
2 结果与分析
2.1 大豆分离蛋白的分子组成及致敏蛋白P34免疫活性验证结果
为明确国产大豆分离蛋白中大豆致敏蛋白组成及P34免疫活性,进行SDS-PAGE和Western-Blot试验,结果见图1。

图1 大豆分离蛋白的SDS-PAGE电泳与大豆致敏蛋白P34的Western Blot图谱Fig.1 SDS-PAGE of soy protein isolate and Western Blot patterns of soyean protein P34
由图1(a)可知,大豆分离蛋白电泳图谱中亮度较高相关条带分别为β-伴大豆球蛋白α′亚基,β-伴大豆球蛋白α亚基(Gly Bd 60 k),β-伴大豆球蛋白β亚基,11S大豆球蛋白G1酸性链,G2碱性链,P34/Gly Bd 30k[13-18]。因此可知,国产大豆分离蛋白包含大豆致敏蛋白的全部组分。由图1(b)可知,大豆致敏蛋白P34在Western Blot图谱中有颜色较深的谱带,因此说明其在大豆分离蛋白中依然存在致敏性,且活性很强。大豆蛋白致敏原P34在电泳图中位置近于分子质量为31 ku条带处。
2.2 相同酶活力下酶对大豆致敏蛋白P34的降解能力的比较
各酶解物的SDS-PAGE电泳结果及水解度测定结果见图2~3。

图2 7种蛋白酶水解大豆分离蛋白的SDS-PAGEFig.2 SDS-PAGE of seven kinds of proteases hydrolysis results of SPI
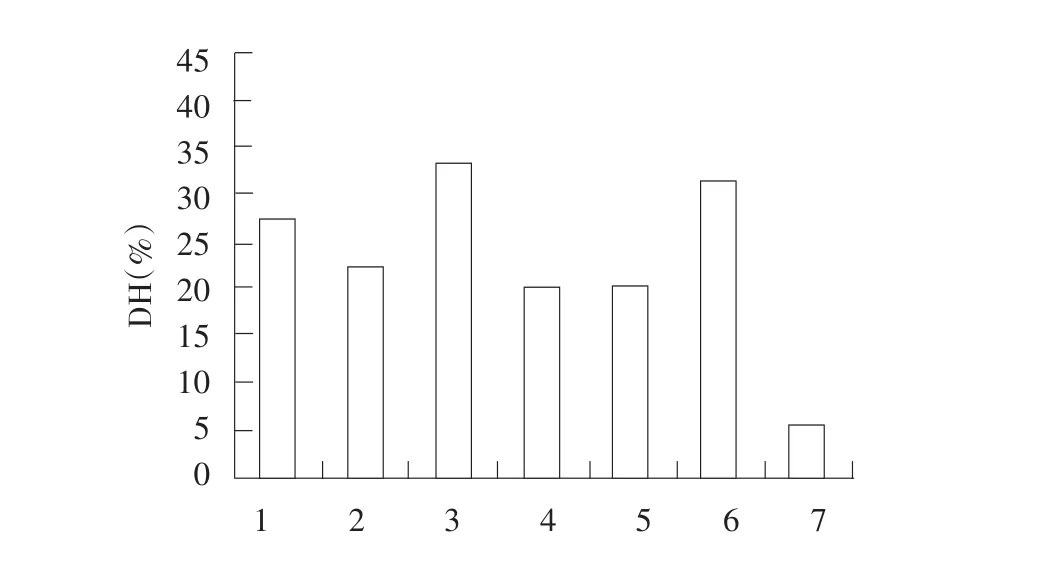
图3 7种蛋白酶水解大豆分离蛋白的水解度Fig.3 Hydrolysis results of seven kinds of proteases of SPI
由图2可知,大豆分离蛋白经7种蛋白酶持续水解60 min,在大豆致敏蛋白P34的特征谱带处仍有部分残留,但对于不同的酶其深浅度不一,说明其剩余含量不同,从而也说明七种蛋白酶对P34降解能力不同。相对而言风味蛋白酶和碱性蛋白酶的P34特征谱带颜色较淡,说明其含量相对较少,进而说明这两种酶对P34的降解能力相对较强,菠萝蛋白酶和木瓜蛋白酶的降解效果次之,复合蛋白酶、中性蛋白酶和胰蛋白酶对大豆分离蛋白水解的能力较弱,P34含量较高。7种蛋白酶对致敏蛋白P34的水解效果不同,这可能是由于酶对蛋白的作用位点不同所致。
由图3可知,相同的酶活力下,风味蛋白酶和碱性蛋白酶的水解度最大,其次是木瓜蛋白酶、菠萝蛋白酶、复合蛋白酶、中性蛋白酶,而胰蛋白酶的水解度最小。
综合以上分析,风味蛋白酶和碱性蛋白酶对大豆分离蛋白中致敏蛋白P34的降解效果最好且水解度也最大,因此选择风味蛋白酶和碱性蛋白酶进行后续研究,优化酶解条件。
2.3 风味蛋白酶酶解条件优化
2.3.1 电泳图谱研究
利用酶解前后的电泳图谱优化风味蛋白酶水解条件,结果见图4。
图4(a)为加酶量对酶解效果的影响(1~6加酶量分别为100、300、500、1 000、1 500和2 000 U·g-1;其他反应条件:反应时间60 min,pH 7.0,温度50℃)。由图4(a)可知,随着加酶量的增加,大豆致敏蛋白P34水解越完全,当加酶量为2 000 U·g-1时,经过60 min持续水解,大豆致敏蛋白P34的相应谱带已经完全消失,因此确定适宜的加酶量为2 000 U·g-1。图4(b)为反应时间对酶解效果的影响(1~6反应时间分别为15、20、30、60、90和120 min;其他反应条件:加酶量2 000 U·g-1,pH 7.0,温度50℃)。由图4(b)可知,随着酶解时间的增加,大豆致敏蛋白P34被逐渐水解,作用时间>60 min时,电泳图谱中大豆致敏蛋白P34相应条带已完全消失,而作用时间120 min时,大部分蛋白完全被水解,只剩下分子量在20 ku的小分子蛋白质。最终确定最佳的酶解时间为60 min。图4(c)为pH对酶解效果的影响(1~6 pH分别为6.0、6.5、7.0、7.5、8.0和8.5;其他反应条件:加酶量2 000 U·g-1,时间60 min,温度50℃)。由图4(c)可知,pH在6.5时水解效果最好,而pH在6.0、7.0、7.5、8.0、8.5时,大豆致敏蛋白P34水解不彻底,因此最佳的pH为6.5。图4(d)为反应温度对酶解效果的影响(1~6反应温度分别为35、40、45、50、55和60℃;其他反应条件:加酶量2 000 U·g-1,时间60 min,pH 6.5)。由图4(d)可知,各温度条件下,大豆致敏蛋白P34均有不同程度水解,其中反应温度在55℃时,P34水解效果最好,所以确定最佳酶解温度为55℃。
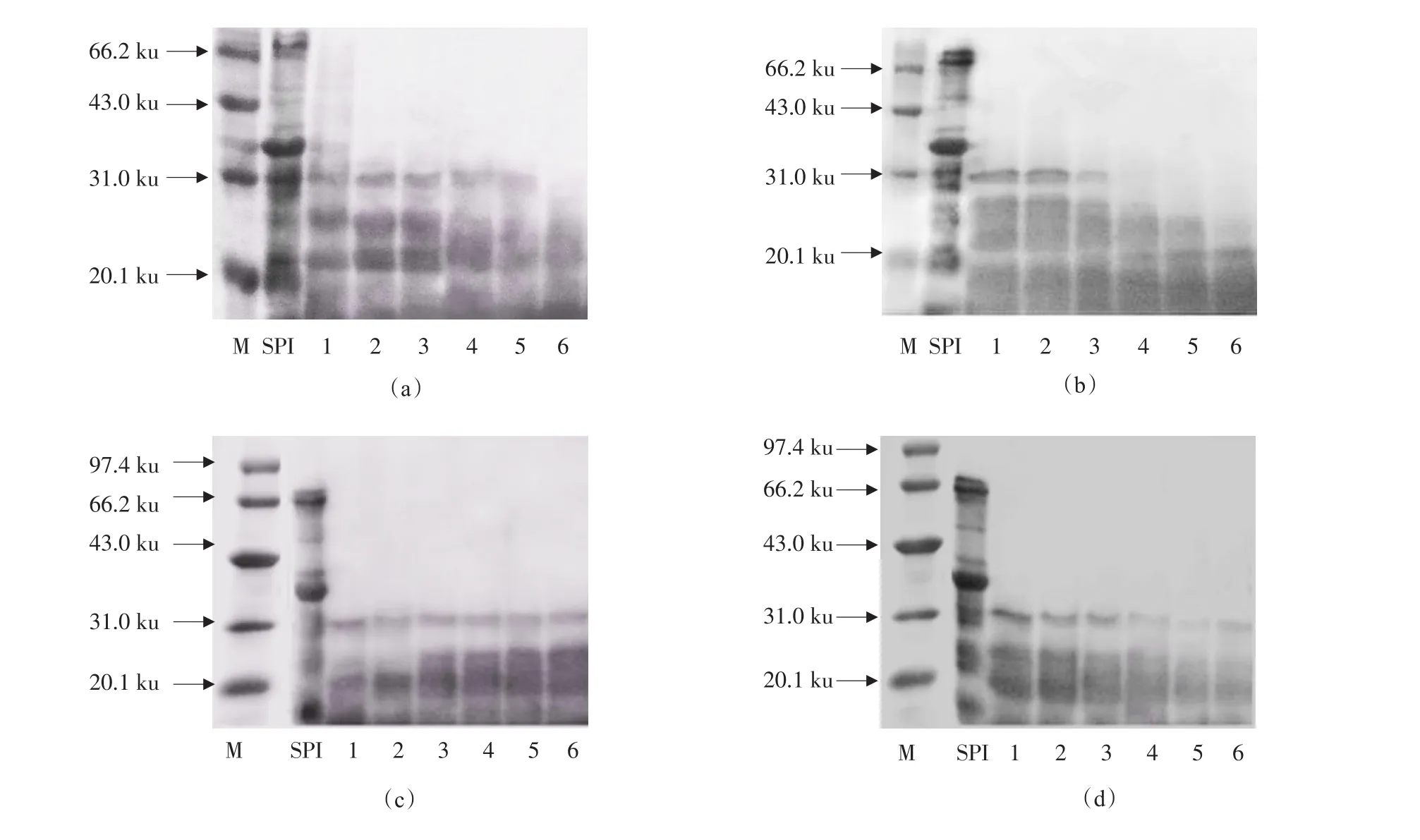
图4 风味蛋白酶水解条件优化SDS-PAGEFig.4 SDS-PAGE of optimization of flavourzyme hydrolysis conditions
2.3.2 水解度对比研究
通过不同水解条件下水解度的变化,研究风味蛋白酶酶解大豆致敏蛋白P34的程度与水解度的关系,结果见图5。

图5 风味蛋白酶水解条件对水解度的影响Fig.5 Effect of hydrolysis results of flavourzyme hydrolysis conditions
由图5可知,随着加酶量的增加,水解度也逐渐增大,当加酶量为2 000 U·g-1时,蛋白质水解度达到最大;当酶解时间逐渐增加时,水解度也呈逐渐增大趋势,而当酶解时间达到120 min时水解度达到最大;当pH 6.0~6.5时,水解度不断增加,而当pH增加到7时,蛋白质水解度呈下降趋势,继续增大pH 8.5,水解度无明显变化。当温度从35℃增加到55℃时,水解度逐渐增加,在55℃时达到最大,温度继续增加到60℃时,水解度随温度升高而降低。
综合以上分析,电泳的分析结果与水解度的分析结果一致,水解度越高大豆致敏蛋白P34水解越完全,消除越彻底。因此,确定最佳的风味蛋白酶反应条件为加酶量2 000 U·g-1、反应时间60 min、pH为6.5、温度55℃。
2.4 碱性蛋白酶酶解条件优化
2.4.1 电泳图谱研究
利用酶解前后的电泳图谱优化碱性蛋白酶水解条件,结果见图6。
图6(a)为加酶量对酶解效果的影响(1~6加酶量分别为100、300、500、1 000、1 500和2 000 U·g-1;其他反应条件:反应时间60 min,pH 8.0,温度55℃)。由图6(a)可知,随着加酶量的增加,大豆致敏蛋白P34不断被水解,当加酶量为1 500和2 000 U·g-1时,大豆致敏蛋白P34的条带已经完全消失,说明已经被完全水解。从节约试验成本方面考虑确定最终加酶量为1 500 U·g-1。图6(b)为反应时间对酶解效果的影响(1~6反应时间分别为15、20、30、60、90和120 min;其他反应条件:加酶量1 500 U·g-1,pH 8.0,温度55℃)。由图(b)可知,随着反应时间的延长,大豆致敏蛋白P34不断被水解,当水解时间为60、90和120 min时,大豆致敏蛋白P34在电泳图谱中的特征谱带完全消失,说明P34已经被完全水解,从提高试验效率方面考虑,选择最终的水解时间为60 min。图6(c)为pH对酶解效果的影响(1~6 pH分别为6.0、6.5、7.0、7.5、8.0、8.5;其他反应条件:加酶量1 500 U·g-1,反应时间60 min,温度55℃)。由图(c)可知,碱性蛋白酶在试验设定的不同pH下都能将大豆致敏蛋白P34水解掉,因碱性蛋白酶的最适pH为8.0,所以确定最终pH 8.0。图6(d)为反应温度对酶解效果的影响(1~6反应温度分别为35、40、45、50、55和60℃;其他反应条件:加酶量1 500 U·g-1,时间6 min,pH 8.0)。由图(d)可知,温度对碱性蛋白酶水解大豆致敏蛋白P34的影响不明显,在试验设定的各温度下,碱性蛋白酶均能将大豆致敏蛋白P34完全水解,考虑到碱性蛋白酶的最适温度为55℃,所以最终确定碱性蛋白酶的最佳温度条件为在55℃。

图6 碱性蛋白酶水解条件优化SDS-PAGEFig.6 SDS-PAGE of optimization of alcalase hydrolysis conditions
2.4.2 水解度对比研究
通过不同水解条件下水解度的变化,研究碱性蛋白酶水解大豆致敏蛋白P34的程度与水解度的关系,结果见图7。
由图7可知,随着加酶量的增加,水解度逐渐增大,当加酶量为1 500 U·g-1时,水解度达到最大,继续增大加酶量时,蛋白质水解度保持不变;随着酶解时间的延长,水解度也逐渐增大,在60 min时达最大,之后随时间延长,水解度保持不变。当pH从6.0到8.5时,水解度不断增加,在pH 8.0达最大,而当pH增加到8.5时,蛋白质水解度保持不变。当温度从35℃增加到60℃时,水解度逐渐增加,在50℃时达到最大,温度继续增加到55℃时水解度随温度升高而降低,当温度增加到60℃水解度保持不变。
综合以上分析,电泳分析结果与水解度分析结果基本一致,大豆致敏蛋白P34完全水解时,水解度基本达到最大值。因此,确定最佳的碱性蛋白酶反应条件为加酶量1 500 U·g-1、反应时间60 min、pH 8.0、温度55℃。

图7 碱性蛋白酶水解条件对水解度影响Fig.7 Effect of of hydrolysis results of alcalase hydrolysis conditions
2.5 最优酶解条件下P34免疫学活性验证研究
为验证最优酶解条件下可使大豆致敏蛋白P34免疫活性丧失,进行免疫印迹实验,结果见图8。由图8可知,未优化酶解条件下7种蛋白酶的免疫印迹图谱中都有不同程度亮度谱带,而在最优酶解条件下风味蛋白酶和碱性蛋白酶P34谱带消失,说明在最优酶解条件下大豆致敏蛋白P34的免疫活性完全丧失。

图8 不同蛋白酶酶解条件下产物的Western Blot图谱Fig.8 Western Blot patterns of enzymatic hydrolysate ofoteases hydrolysis conditions
2.6 最优条件下蛋白酶解物的功能特性
对最优条件下大豆分离蛋白酶解产物的功能特性研究结果见表2。
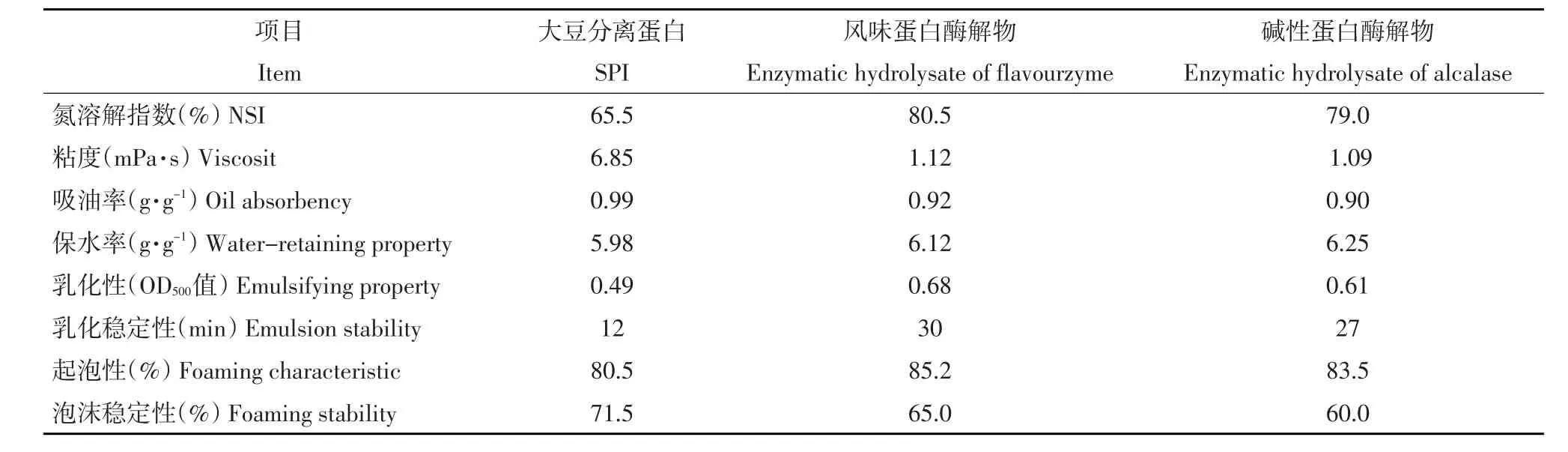
表2 大豆蛋白酶解物功能性比较Table 2 Changes of physicochemical properties of enzymatic hydrolysate
由表2中可知,风味蛋白酶解物和碱性蛋白酶解物的溶解性都有较大幅度提高,其中风味蛋白酶解物NSI值由原来大豆分离蛋白的65.5%,提高到80.5%,而碱性蛋白酶解物NSI值提高到79.0%。蛋白酶解物溶解性提高的原因可能是大豆分离蛋白酶解后,断裂成多肽和小分子物质,使-NH2和-COOH的数目增多,极性增加,电荷密度增大,亲水性增强,提高溶解性。
由表2中可知,风味蛋白酶解物和碱性蛋白酶解物粘度都有较大幅度降低,其中风味蛋白酶解物黏度由原来大豆分离蛋白6.85(mPa·s),降低到1.12(mPa·s),而碱性蛋白酶解物的黏性降低到1.09(mPa·s)。蛋白酶解物黏性降低原因可能是大豆分离蛋白经蛋白酶酶解产生许多小分子肽类,使原来的网状结构受到破坏,膨胀率降低,由于蛋白多聚体的解离和离子基团的增加,增强蛋白质分子有序性,表现为蛋白质的表观体积减小,使粘度下降。
由表2可知,风味蛋白酶解物和碱性蛋白酶解物的吸油性略有降低,其中风味蛋白酶解物的吸油率由原来大豆分离蛋白酶的0.99(g·g-1),降低到0.92(g·g-1),而碱性蛋白酶解物的吸油率降低到0.90(g·g-1)。蛋白的吸油性是因为油与疏水性基团结合,将油包裹在蛋白中,蛋白酶解物吸油性降低的原因是蛋白酶水解大豆分离蛋白后,由于水解度增大,肽链变小,使形成包裹油的网络结构遭到破坏,吸油性降低。
由表2可知,风味蛋白酶解物和碱性蛋白酶解物保水性都有较大幅度提高,其中风味蛋白酶解物保水率由原来大豆分离蛋白的5.98(g·g-1)提高到6.12(g·g-1),而碱性蛋白酶解物的保水率提高到6.25(g·g-1)。蛋白酶解物保水性提高原因是大豆分离蛋白经蛋白酶水解后,使大量的亲水基团外露,保水性有所提高。
由表2可知,风味蛋白酶解物和碱性蛋白酶解物的乳化性和乳化稳定性都有较大幅度提高,其中风味蛋白酶解物的乳化性和乳化稳定性由原来大豆分离蛋白的0.49(OD500值)和12(min)提高到0.68(OD500值)和30(min),而碱性蛋白酶解物乳化性和乳化稳定性提高到0.61(OD500值)和27(min)。蛋白酶解物乳化性和乳化稳定性提高的原因是大豆分离蛋白经蛋白酶水解,产生许多肽段,致使大量疏水基团暴露,大量肽分子进入油水界面,降低界面张力,由于疏水基向里亲水基向外包裹在油表面,起到保护作用,由于-COO-所带电荷,通过静电排斥作用阻止油滴间聚和,因此提高乳化活性。由于蛋白质疏水性越大,界面上吸附蛋白质浓度越大,界面张力越小,乳状液更稳定。
由表2可知,风味蛋白酶解物和碱性蛋白酶解物的起泡性都有较大幅度提高,而泡沫稳定性都有较大幅度降低,其中风味蛋白酶解物起泡性由原来大豆分离蛋白的80.5%提高到85.2%,泡沫稳定性由原来大豆分离蛋白的71.5%降低到65.0%,而碱性蛋白酶的起泡性提高到83.5%,泡沫稳定性降低到61.5%。产生上述结果的原因可能是由于产生泡沫需要蛋白质分子间的肽链展开,在液面上通过各种相互作用形成一种韧膜,而大豆分离蛋白经酶解后其溶解性的增强致使蛋白质扩散并吸附在空气/水界面的能力增强,降低界面张力,提高发泡能力。但是酶解后蛋白质的粘度会变小,液膜会变得很脆弱无法裹住气泡,使泡沫稳定性变差。
综合以上分析,两种蛋白酶解物的溶解性、保水性、乳化活性和乳化稳定性,起泡性明显好于大豆分离蛋白,而粘性、吸油性和泡沫稳定性低于大豆分离蛋白,由于蛋白的粘度、吸油性和泡沫稳定性都与浓度和pH、温度等因素有关,可通过后期调节其他因素使其发挥更好效果。相比较而言,碱性蛋白酶解物的保水性好于风味蛋白酶解物,而其他性质略差于风味蛋白酶解物,这可能是由于碱性蛋白酶和风味蛋白酶的作用位点不同,以至酶解物中小分子蛋白种类不同所致。
3 结论
不同来源酶由于其酶切位点不同,对大豆致敏蛋白P34呈现出不同失活作用效果。在相同酶活力下风味蛋白酶和碱性蛋白酶对大豆致敏蛋白P34水解能力较强,在最优水解参数下能完全去除其免疫活性。经最优条件下获得风味蛋白酶解物和碱性蛋白酶解物功能特性,如溶解性、保水性、乳化活性、乳化稳定性和起泡性,明显优于原料大豆分离蛋白,而其中风味蛋白酶解物的功能特性要好于碱性蛋白酶解物。
[参考文献]
[1]Goodwin P R.Food allergen detection methods:A coordinated ap⁃proach[J].J Aoac Int,2004,87(6):1383-1390.
[2]L'Hocine L,Boye JI.Allergenicity of soybean:New developments in identification of allergenic proteins,cross-reactivities and hy⁃poallergenization technologies[J].Crit Rev Food Sci Nutr,2007, 47(2):127-143.
[3]Ogawa T,Bando N,Tsuji H,et al.Identification of the soybean al⁃lergenic protein,Gly m Bd 30K,with the soybean seed 34-ku oil⁃body-associated protein[J].Bioscience,Biotechnology and Bio⁃chemistry,1995,57(6):1030-1033.
[4]Bando N,Tsu jiH,Yam anish iR,et al.Identificat ion of the glyco⁃sylation site of a major soybean allergen,Gly m Bd 30K[J].Biosci⁃ence,Biotechnology and Biochemistry,1996,60(2):347-348.
[5]Zhao X Y,Chen F S,Xue W T,et al.FTIR spectra studies on thesecondary structures of 7S and 11S globulins from soybean pro⁃teins using AOT reverse micellar extraction[J].Food Hydrocol⁃loids,2008,22(4):568-575.
[6]Batista R,Martins I,Jeno P,et al.Aproteomic study to identify soya allergens the human responseto transgenic versus non-trans⁃genic soya samples[J].Int Arch Allergy Immunol,2007,144(1): 29-38.
[7]Bin Liu,Da Teng,Xiumin Wang,et al.Expression of the soybean allergenic protein P34 in Escherichia coli and its indirect ELISA detection method[J].Appl Microbiol Biotechnol,2012 94:1337-1345.
[8]Helm R M,Cockrell G,Connaughton C,et al.Mutational analysis of the IgE-binding epitopes of P34/Gly m Bd 30K[J].J Allergy Clin Immunol,2000,105(2 Pt 1):378-384.
[9]赵新淮,冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995.26(2):178-181.
[10]张亚丽,徐忠.大豆蛋白酶解物的功能特性研究[J].食品与发酵工业,2003,29(9):27-28.
[11]陈靓,朱秀清,窦巍巍,等.大豆分离蛋白酶解产物功能特性的研究[J].大豆科技,2011(3):24-26.
[12]Pearce K N,Kinsella J E.Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J].J Agric Food Chem, 1978,26(3):716-723.
[13]Herman E M,Helm R M,Jung R,et al.Genetic modification re⁃moves an immunodominant allergen from soybean[J].Plant Physiol, 2003,132(1):36-43.
[14]Ogawa T,B ando N,Tsuji H,et al.Investigation of the IgE bind⁃ing proteins in soybeans by immunobloting with the sera of the soybean sensitive patients with atopic dermatitis[J].Journal of Nutritional Science and Vitaminology,1991,37(6):555-565.
[15]Gagnon C,Poysa V,Cober E,et al.Soybean allergens affecting North American patients identified by 2D gels and mass spectrom⁃etry[J].Food Analytical Methods,2010,3(4):363.
[16]Hou D H,Chang S K.Structural characteristics of purified gly⁃cinin from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemmistry,2004,52(12):3792-3800.
[17]Koshiyama I.Isolation of a glycopeptides from a 7S protein in soy⁃bean globulins[J].Arch Biophys,1969,130(1):370-373.
[18]Lee J O,Lee S L,Cho S H,et al.A new technique to produce hy⁃poallergenic soybean proteins using three different fermentating microorganisms[J].Allergy and Clinical Immunology,2004,113 (2):239.
Effect of enzymatic hydrolysis process on allergenic activity of soy⁃bean protein P34 and physicochemical properties of enzymatic hydro⁃lysate/
ZHENG Huanyu1,2,BAI Xiaojuan1,ZHANG Lili1,DONG Xiaochao2,XU Hui2,HAN Jianchun1,2, ZHU Xiuqing1,2(1.School of Food Science,Northeast Agricultural University,Harbin 150030,China; 2.Soybean Technology Development and Research Center of Heilongjiang Province,Harbin 150030,China)
Soybean protein was hydrolyzed with seven different kinds of proteases,respectively.The elimination effect of soy protein P34 was analyzed by determination of SDS-PAGE and hydrolysis degree, and the immune activity of P34 before and after hydrolysis was determined by Western Blot.The results showed that the P34 content in soybean degraded to varying degrees after hydrolyzed with different proteases and the flavor and alkaline proteases were two most effective proteases that could completely eliminate P34.Under optimal conditions,the solubility,water-retaining property,emulsification,emulsion stability and foaming ability of enzymatic hydrolysis product which hydrolyzed with flavors or alkaline protease increased significantly,whereas the viscosity,oil absorbency and foam stability of it reduced.
soybean;soybean allergen P34;enzymatic hydrolysis;functionality
TS214.2
A
1005-9369(2014)06-0006-10
时间 2014-6-11 16:05:46 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1605.003.html
郑环宇,白小娟,张丽丽,等.酶水解对大豆致敏蛋白P34免疫活性的影响及酶解产物理化性质研究[J].东北农业大学学报, 2014,45(6):6-15.
Zheng Huanyu,Bai Xiaojuan,Zhang Lili,et al.Effect of enzymatic hydrolysis process on the allergenic activity of soybean protein P34 and the physicochemical properties of enzymatic hydrolysate[J].Journal of Northeast Agricultural University, 2014,45(6):6-15.(in Chinese with English abstract)
2013-12-31
国家高技术研究发展计划(863计划)(2013AA102208);国家科技支撑计划项目(2012BAD34B04);黑龙江省教育厅新世纪优秀人才培养项目(1154-NCET-003)
郑环宇(1975-),女,副研究员,博士,硕士生导师,研究方向为粮食、油脂及植物蛋白工程。E-mail:841625891@qq.com

