连翘酯苷A抗LPS介导大鼠类风湿性关节炎机制研究
程广东,岳丽红,吕冬云,盛尊来,李盛举,张强,王伟娥,张伟,赵玉林,李艳华*
(1.佳木斯大学生命科学学院,黑龙江佳木斯 154007;2.东北农业大学动物医学学院,哈尔滨 150030;3.佳木斯大学公共卫生学院,黑龙江佳木斯 154007;4.佳木斯大学药学院,黑龙江佳木斯 154007)
连翘酯苷A抗LPS介导大鼠类风湿性关节炎机制研究
程广东1,2,岳丽红1,吕冬云1,盛尊来2,李盛举1,张强3,王伟娥4,张伟4,赵玉林2,李艳华2*
(1.佳木斯大学生命科学学院,黑龙江佳木斯 154007;2.东北农业大学动物医学学院,哈尔滨 150030;3.佳木斯大学公共卫生学院,黑龙江佳木斯 154007;4.佳木斯大学药学院,黑龙江佳木斯 154007)
为探究连翘酯苷A抑制LPS协同诱导大鼠类风湿性关节炎机制,将40只SD大鼠[体重(120±2)g],随机分成4组,每组10只,分别记为对照组、类风湿性关节炎组、LPS刺激类风湿性关节炎组和连翘酯苷A干扰组。利用经典方法制作类风湿性关节炎模型。进而通过LPS及连翘酯苷A作用,建立大鼠体内抗炎模型,通过大鼠临床症状观察、关节指数评分、ELISA技术以及抗氧化指标检测。结果表明,类风湿性关节炎模型和LPS协同类风湿性关节炎模型组关节指数增加,IL-1β和IL-17蛋白表达量增加,T-AOC和GSH抗氧化酶含量下降,自由基MDA含量上升;而连翘酯苷治疗组上述指标趋势相反;推测连翘酯苷A可降低LPS刺激类风湿性关节炎组大鼠关节炎指数、抑制炎症因子IL-1β和IL-17蛋白翻译,影响抗氧化酶及自由基含量,最终发挥抗炎功效。
连翘酯苷A;LPS;类风湿性关节炎;细胞因子
类风湿关节炎(Rheumatoid arthritis,RA)是慢性、自身免疫病,以对称性外周多关节病变为主,是以关节滑膜炎、破坏性关节病变为主要特征的疾病,致畸、致残率极高。对于RA至今尚无特效疗法。目前,针对引起RA主要致炎因子IL-1β,IL-17为靶标的双价抗体药物已被应用[1-3],IL-1β,IL-17是重要前炎因子,能在类风湿关节炎CD4+T细胞中表达,介导炎症通路和炎症因子,在类风湿性关节炎起重要作用[4]。
连翘酯苷A是中药连翘主要有效成分之一,具有解热、镇痛、抗菌、抗病毒及抗氧化作用,起免疫调节作用[5-6]。脂多糖是革兰氏阴性细菌细胞壁成分之一,引起机体炎症反应,常被用于复制炎症模型。在RA疾病情况下,LPS不直接对成纤维状滑膜细胞(FLS)产生影响,通过刺激体内的免疫细胞,使其分泌多种炎症介质和细胞因子,间接刺激FLS,使FLS生长加快,引起包括IL-6在内多种细胞因子表达和分泌增加,造成关节损伤[7]。本试验利用建立CII和完全弗氏佐剂复制大鼠类风湿性关节炎模型,通过检测大鼠临床症状、炎症因子蛋白表达量与抗氧化酶及自由基的关系,探讨LPS对大鼠类风湿性关节炎炎症协同作用,研究连翘酯苷A抗LPS协同的类风湿性关节炎机制,为连翘酯苷A在抗炎免疫调控中的作用研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物
SD大鼠购于中国农业科学院哈尔滨兽医研究所实验动物中心。
1.1.2 仪器
酶标仪(DENLEY DRAGON Wellscan MK2,Thermo公司生产);可见分光光度计(722S型,上海美析仪器有限公司生产);数显高速离心机(TGL-16B,常州迈科诺仪器有限公司生产)。
1.1.3 主要试剂
T-AOC、GSH和MDA抗氧化试剂盒购自南京建成生物技术有限公司;LPS购自SIGMA公司;连翘酯苷购自成都瑞芬思生物科技有限公司(纯度>98%);大鼠IL-1β和IL-17 ELISA试剂盒购自上海生物工程有限公司;鸡Ⅱ型胶原和完全弗氏佐剂购自美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 类风湿性关节炎大鼠模型的建立
参照文献[8-10]的方法,将4 mg·mL-1CII溶解于0.1 mol.L-1醋酸中,配成2 mg·mL-1的溶液,进而与预冷的弗氏完全佐剂混合并制成质量浓度为1 mg·mL-1CII,保证乳化完全。每只大鼠通过尾根部、背部、左后足跖皮内等3点注射0.25 mL,诱导其发生炎症。两周后,以每只0.1 mL的剂量进行尾根部散点注射起到加强免疫功效。
1.2.2 大鼠分组与处理
将40只SD大鼠[体重(120±2)g],随机分成4组,每组10只,分别记为对照组(A组)、类风湿性关节炎组(B组)、LPS刺激类风湿性关节炎组(C组)和连翘酯苷A干扰组(D组)。除A组大鼠外,其余3组动物均按“1.2.1”项下方法造模,A组大鼠以同体积的冰醋酸注射。造模当天开始给药,D组灌胃给予30 mg·kg-1连翘酯苷A,A组、B组、C组灌胃给予等量生理盐水,每天1次,连续21 d。C组和D组于末次灌胃给药2 h后,按20 μg·kg-1BW(体重)剂量腹腔注射LPS。
1.2.3 样品采集与处理
第21天大鼠经股动脉放血处死,用加抗凝剂试管分离血浆,不加抗凝剂自然析出血清,将分离血浆和血清,按试剂盒说明书中方法测定血清中IL-1 β和IL-17蛋白含量。并测定大鼠血浆抗氧化指标。
1.2.4临床症状
观察并记录大鼠临床症状、食欲和足爪肿胀程度。
1.2.5 关节炎指数的判定
关节炎指数的判定标准:通过五级评分法[11],依照大鼠关节肿大、变形、红肿状况,对大鼠评分。0分表示无关节炎,1分表示关节出现红肿,有轻微症状,2分表示中度红肿,3分表示严重红肿,4分表示关节严重肿胀并出现功能障碍。AI表示四个关节炎症评分之和,每个关节炎症最高分为4份,四个总和最高16分。
1.2.6 ELISA试验
取大鼠血液自然析出血清,按大鼠IL-1β和IL-17 ELISA检测试剂盒操作流程,通过酶标仪,检测血清中IL-1β和IL-17蛋白的吸光度,相应计算出中IL-1β和IL-17蛋白含量。
1.2.7 抗氧化指标的检测
取大鼠血浆,按大鼠抗氧化试剂盒操作流程,通过可外分光光度计,检测血浆中T-AOC、GSH和MDA的吸光度,相应计算出中T-AOC和GSH抗氧化酶含量和自由基MDA含量。
1.2.8 统计分析
结果以平均值±标准差表示,试验数据采用SPSS 16.0进行统计分析,采用单因素方差分析(One-way ANOVA)进行差异显著性检验,其中P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 临床症状
对照组大鼠食欲、体重增加、精神状态正常、被毛光泽。类风湿性关节炎组大鼠精神状态沉郁,食欲减少,被毛无光泽,注射药后第7天,大鼠左后足发现明显肿胀,后期左侧足开始肿胀,当14~21 d后,大鼠对侧足有明显红肿现象,关节出现变形,形成稳定的胶原诱导性关节炎(CIA)模型。当21 d给LPS后,大鼠精神出现先兴奋后沉郁现象,体温升高,而连翘酯苷A组症状比LPS组缓解,接近正常组,表明LPS可促进类风湿性关节炎症状,而连翘酯苷A可抑制类风湿性关节炎症状,减低LPS协同致炎作用。
2.2 关节指数的评定结果
A组大鼠关节无红肿,各时间点AI值为0分;其余3组大鼠关节均出现红肿,于初次免疫后8~9 d出现红肿并逐渐严重,AI值升高呈上升趋势,而后关节红肿现象减轻,AI值下降成下降趋势。C、D组在21 d时,腹腔注入LPS后,关节红肿加剧,AI值上升,D组大鼠AI值明显低于C组大鼠AI值,显示LPS的致炎作用和连翘酯苷A抗炎功能,试验组大鼠关节炎指数评分具体情况见表1。
2.3 大鼠血清中IL-17和IL-1β蛋白的含量
通过ELISA方法检测大鼠血清中IL-17和IL-1β蛋白的含量,结果如图1和图2。
由图1可知,与对照组相比,其余3组血清中IL-17的水平均成上升趋势,且与两个模型组间血清中IL-17的水平差异均极显著(P<0.01),与连翘酯苷A组的大鼠血清中IL-17水平差异显著(P<0.05),表明和LPS协同刺激类风湿性关节炎关节炎组大鼠血清中IL-17蛋白含量均极显著升高,引起炎症,况且LPS协同刺激类风湿性关节炎关节炎组比类风湿性关节炎组大鼠血清中IL-17蛋白含量也极显著升高,显示出LPS可刺激炎症反应增强。与两关节炎组模型大鼠比较,连翘酯苷A组大鼠血清中IL-17蛋白含量下降,显示连翘酯苷A有抗炎效果。

表1 试验大鼠关节炎指数评分Table 1 Score of arthritis index in experiment rats

图1 IL-17蛋白含量Fig.1IL-17 protein levels
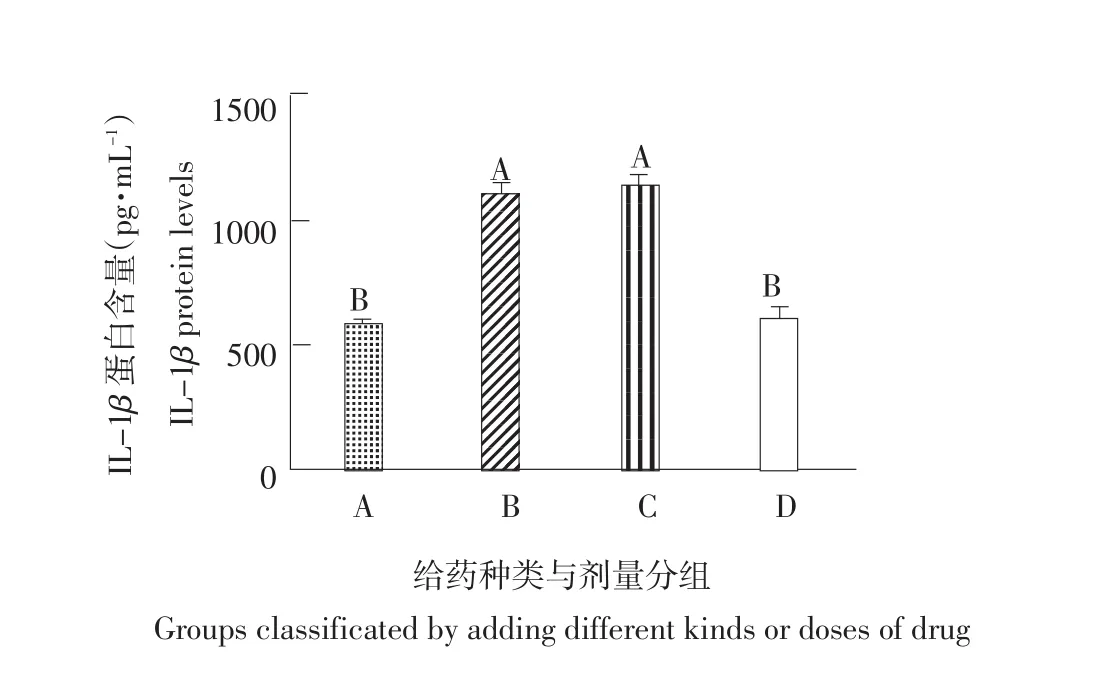
图2 IL-1β蛋白含量Fig.2 IL-1β protein levels
由图2可知,与对照组相比,两个模型组间血清中IL-1β的水平均升高,差异极显著(P<0.01),与连翘酯苷A组的大鼠血清中IL-1β水平差异不显著(P>0.05),表明和LPS协同刺激类风湿性关节炎关节炎组大鼠血清中IL-1β蛋白含量均极显著升高,引起炎症,与两关节炎组模型大鼠比较,连翘酯苷A组大鼠血清中IL-17蛋白含量下降,差异极显著(P<0.01),显示连翘酯苷A有抗炎效果。
2.4 大鼠血浆中抗氧化指标的检测结果
利用抗氧化试剂盒检测血浆中T-AOC、GSH和MDA含量,通过可见分光光度计读出OD值,并计算出T-AOC、GSH和MDA含量,结果见表2。
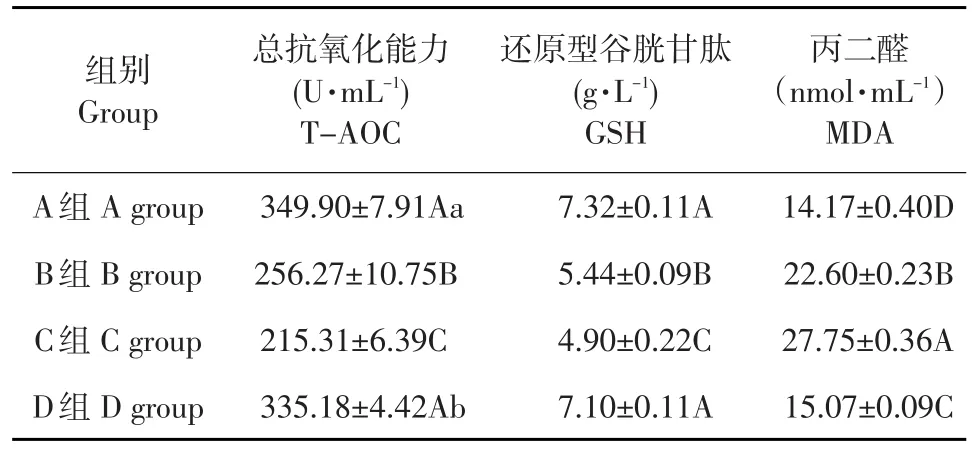
表2 连翘酯苷A对大鼠血清中抗氧化指标的影响Table 2 Effect of Forsythiaside A on antioxidant function in LPS-induced serum of rats
由表2可知,与对照组相比,两个模型组间血浆中抗氧化酶T-AOC和GSH的水平均下降,差异均极显著(P<0.01),而自由基MDA含量升高,差异极显著(P<0.01),与炎症模型组相比,连翘酯苷A组血浆中抗氧化酶T-AOC的水平均上升,差异显著(P<0.05);连翘酯苷A组血浆中抗氧化酶GSH的水平均上升,差异极显著(P<0.01);而自由基MDA含量下降,差异极显著(P<0.01)。表明LPS可协同刺激类风湿性关节炎抗氧化酶含量下降,自由基含量上升;而连翘酯苷A与其作用相反,显示连翘酯苷A有抗炎效果。
3 讨论与结论
本研究通过CII+CFA混合的乳化剂诱导大鼠建立类风湿性关节炎模型,并通过LPS协同作用,建立LPS协同类风湿性关节炎模型。由于CFA存在,机体可产生激烈的免疫应答,形成关节炎症反应。提示大鼠体内体液免疫功能发生改变,参与慢性多发性炎症的发病过程。韩晓枫等研究表明,胶原诱发的体液免疫应答在RA的发生和形成中有重要作用[11]。其可能导致抗CII抗体沉积在患者的关节软骨上,补体活化并趋化炎性细胞到组织部位,炎性浸润形成引起关节组织破坏。Chon⁃drex研究由Ⅱ型胶原单克隆抗体和LPS诱导的类风湿性关节炎模型发现LPS可使造模时间减少[12],本次试验表明,LPS可使类风湿性关节炎炎症反应增强,关节炎指数增加,促进炎症反应发生,其原因可能为LPS刺激增强炎症反应,导致红肿严重。显示LPS的致炎作用,此外,连翘酯苷A与LPS作用相反,表明连翘酯苷A有抗炎功能,并对LPS协同引发类风湿性关节炎有较好疗效。
IL-17主要可诱导人成纤维细胞分泌IL-8和IL-6,并使人成纤维细胞表达ICAM-1。IL-17在RA中软骨和骨的破坏中起重要作用。IL-17增加IL-6的产量并加剧软骨破坏,同时使胶原的合成受到抑制。IL-17在鼠的关节软骨中加速软骨蛋白多糖的损失,进而使合成抑制。其中骨破坏机制可能如下:一方面通过直接分化与活化破骨细胞,另一方面可诱导IL-1β和TNF-α产生,间接破坏增关节;再有通过干扰受体通路加速破坏骨损伤[13]。本试验发现,LPS可协同增强类风湿性关节炎组大鼠IL-17蛋白含量,而连翘酯苷A可降低IL-17蛋白含量,表明IL-17在类风湿性关节炎中起重要作用,而连翘酯苷A可通过抑制IL-17蛋白含量发挥抗类风湿性关节炎功能。
吕小波等研究云南红药对类风湿性关节炎模型的作用时发现,云南红药可有效抑制大鼠足肿胀的作用,使肿胀时间延迟,肿胀程度下降,与剂量呈效应关系;并能明显下调致炎因子IL-1β和TNF-α表达水平。表明云南红药能够有效抑制类风湿性关节炎的发生、发展过程[14]。卢雯雯等研究复方除痹汤治疗类风湿性关节炎的作用时发现,复方除痹汤对大鼠关节炎指数有抑制作用;可显著降低异常升高的类风湿关节炎模型大鼠血清中TNF-α和IL-1 β含量;表明复方除痹汤对类风湿性关节炎模型大鼠具有一定治疗作用[15]。邵成文等通过三藤散对类风湿性关节炎模型大鼠抗炎作用及机制的试验研究发现,三藤散可缓解RA病情,减轻足肿胀度,明显降低AIA大鼠血清中TNF-α和IL-1β的含量[16]。本试验发现,IL-1β蛋白在LPS协同类风湿性关节炎组大鼠中含量增强,而连翘酯苷A作用相反,表明IL-1β在类风湿性关节炎中起重要作用,而连翘酯苷A可通过抑制IL-1β蛋白含量发挥抗类风湿性关节炎功能。
肖诚等研究报道,雷公藤多甙可升高AA模型大鼠血清SOD和T-AOC活力,降低其血清MDA含量[17]。施旭光等研究表明,雷公藤多甙可使血浆LPO降低水平,并提高机体内源性的抗氧化酶SOD、GSH-PX的活性[18]。提示植物有效成分可通过抗氧化系统来参与类风湿性关节炎。贺拥军等研究表明,RA发病早期体内MDA含量上升,SOD活性下降,使抗氧化物质的抗氧化活性下降,检测SOD活性及MDA含量有助于RA临床早期诊断[19]。赵玉莲等研究连翘酯苷对LPS诱导的肉鸡法氏囊中NO及抗氧化酶活性的影响时发现[20],LPS可升高鸡法氏囊中IL-1β和IL-17蛋白表达水平,并引起机体T-AOC和GSH含量降低,MDA含量上升;而连翘酯苷A可通过降低鸡法氏囊中IL-1β和IL-17蛋白表达水平,并引起机体T-AOC和GSH含量升高,MDA含量下降。本试验表明,LPS可引起类风湿性关节炎组大鼠中抗氧化酶T-AOC和GSH含量升高,自由基MDA含量下降;而连翘酯苷A作用相反,表明抗氧化酶和自由基含量在类风湿性关节炎中起重要作用,而连翘酯苷A可通过增强抗氧化酶含量、降低自由基含量发挥抗类风湿性关节炎功能。
综上所述,通过对宏观指标观察和微观数据指标检测,试验表明,LPS可增加大鼠关节炎指数,升高血清中IL-1β和IL-17蛋白表达水平,并引起机体抗氧化酶T-AOC和GSH含量降低,自由基MDA含量上升;而连翘酯苷A可使大鼠关节炎指数减低,降低大鼠血清中IL-1β和IL-17蛋白表达水平,并引起机体抗氧化酶T-AOC和GSH含量升高,自由基MDA含量下降,推测连翘酯苷A一方面可通过影响炎症因子含量发挥抗类风湿性关节炎作用,另一方面可通过降低机体氧化损伤发挥作用。炎症因子与抗氧化酶和自由基在类风湿性关节炎发生过程可能相互协作,共同调控炎症反应发生。连翘酯苷A抗类风湿性关节炎确切机制有待进一步探讨。
[1]吴玲,李晶,芮金兵,等.IL-17和RORγt在类风湿关节炎CD4+T细胞中的表达及临床意义[J].江苏医药,2011,37(2):156-158. [2]马天瑞.Th17细胞在类风湿性关节炎发病机制中的作用[J].同济大学学报:医学版,2010,31(4):121-124.
[3]卢月,曹雅晶,钱瑞琴.IL-17在类风湿性关节炎发病机制中的作用[J].中国免疫学杂志,2011,27(9):855-859.
[4]蔡春友,张维铭,孙保存,等.白细胞介素1对Ⅱ型胶原诱导类风湿性关节炎模型的影响[J].中华骨科杂志,1999,19(10): 614-616.
[5]Cheng G D,Zhao Y L,Li H,et al.Forsythiaside attenuates lipo⁃polysaccharideinduced inflammatory responses in bursa of fabri⁃cius of chickens by downregulating the NF-κB signaling pathway [J].Exp Ther Med,2014,7(1):179-184.
[6]程广东,闫清波,陈俭清,等.连翘酯苷A抑制LPS诱导的鸡法氏囊中炎症因子表达[J].东北农业大学学报,2013,44(12): 52-57.
[7]刘柏合,沈放,李怡棠,等.脂多糖对人类风湿性关节炎滑膜细胞白介素-6表达的影响[J].药学学报,2003,38(6):420-423.
[8]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:920.
[9]王贵霞.类风湿性关节炎动物模型制备与发病机理的探讨[D].哈尔滨:东北农业大学,2010.
[10]林红,贺永怀,黎燕,等.Ⅱ型胶原蛋白与弗氏完全佐剂大鼠关节炎模型的建立和比较[J].中国实验动物学报,1999,7(1): 1-6.
[11]韩晓枫,马宝骊,张继英,等.胶原Ⅱ型诱导大鼠类风关模型的建立[J].上海免疫学杂志,2001,6(21):330-333.
[12]Chin J E,Lin YA.Effects of recombinant human interleukin-1 be⁃ta on rabbit articular chond-rocytes.Stimulation of prostanoid re⁃lease and inhi-bition of cell growth[J].Arthritis Rheum,1988,31 (10):1290-1296.
[13]王霖,王文杰.破骨细胞在类风湿性关节炎骨破坏中的作用及其调控机制[J].生理科学进展,2004,35(3):269-273.
[14]吕小波,李文,杨东加,等.云南红药对类风湿性关节炎模型大鼠足肿胀的抑制作用及对大鼠血清中致炎因子水平的影响[J].药学进展,2010,34(2):81-84.
[15]卢雯雯,吴国琳,李剑平,等.复方除痹汤治疗类风湿性关节炎的实验研究[J].甘肃中医,2011,24(3):71-73.
[16]邵成文,陈光,程晶,等.三藤散对类风湿性关节炎模型大鼠抗炎作用及机制的实验研究[J].中医药信息,2008,25(4):82-83. [17]肖诚,何颖辉,黄芳华,等.雷公藤多甙对佐剂性关节炎大鼠自由基和炎症因子的影响[J].北京中医药大学学报,2006,12(6): 134-137.
[18]施旭光,黄兆胜,高汉森.白虎追风丸对佐剂性关节炎大鼠血液中氧自由基的影响[J].中国中医药信息杂志,2003,10(7): 21-22.
[19]贺拥军,康龙丽,王英,等.类风湿性关节炎病人血清及关节滑液中一氧化氮、超氧化物歧化酶、丙二醛含量变化观察[J].西藏医药杂志,2005,26(3):43-45.
[20]赵玉莲,陈俭清,程广东等.连翘酯苷对LPS诱导的肉鸡法氏囊中NO及抗氧化酶活性的影响[J].中国家禽,2013,35(8): 17-19.
Forsythiaside A inhibits rheumatiod arthritis in rats stimulated byLipopolysaccharide/
CHENG Guangdong1,2,YUE Lihong1,LV Dongyun1,SHENG Zunlai2,LI Shengju1,ZHANG Qiang3,WANG Wei'e4,ZHANG Wei4,ZHAO Yulin2,LI Yanhua2(1.School of Life Science,Jiamusi University,Jiamusi Heilongjiang 154007,China;2.School of Veterinary Medicine, Northeast Agricultural University,Harbin 150030,China;3.School of Public Health,Jiamusi University, Jiamusi Heilongjiang 154007,China;4.School of Pharmacy,Jiamusi University,Jiamusi Heilongjiang 154007,China)
In order to study the mechanisms of that Forsythiaside A inhibit rheumatiod arthritis in rat stimulated by Lipopolysaccharide,fourty SD rats[weight(120±2)g]were randomly divided into control group,rheumatiod arthritis group,LPS+rheumatiod arthritis group and Forsythiaside A therapy group,10 rats in each group.The research using rheumatiod arthritis model,further Forsythiaside A and LPS play a part in rheumatiod arthritis model,through observing clinical symptoms and index score of arthritis and using ELISA technique and detecting antioxidant functions.the results showed that score of arthritis indexincreased and IL-1βand IL-17 protein content increased,T-AOC and GSH content decreased,MDA content increases in the plasma in rheumatiod arthritis model,while the above index was contrary in Forsythiaside A therapy group,it was deduced that Forsythiaside A can inhibit index score of arthritis and inhibit translation of IL-1βand IL-17 protein and affect antioxidant enzymes and free radicals content in rats of LPS+rheumatiod arthritis group,at last function anti-inflammation efficacy.
Forsythiaside A;Lipopolysaccharide;rheumatiod arthritis;inflammation factor
S685.24
A
1005-9369(2014)06-0103-06
时间 2014-6-11 16:20:16 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1620.020.html
程广东,岳丽红,吕冬云,等.连翘酯苷A抗LPS介导大鼠类风湿性关节炎机制研究[J].东北农业大学学报,2014,45(6):103-108.
Cheng Guangdong,Yue Lihong,Lv Dongyun,et al.Forsythiaside A inhibits rheumatiod arthritis in rats stimulated by Lipopolysaccharide[J].Journal of Northeast Agricultural University,2014,45(6):103-108.(in Chinese with English abstract)
2014-01-10
国家自然科学基金青年项目(31101250);黑龙江省卫生厅科研项目(2012-267);佳木斯大学青年基金项目(Sq2013-028)
程广东(1978-),男,讲师,博士,研究方向为中药抗炎机制。E-mail:chengguangdong@126.com
*通讯作者:李艳华,教授,博士生导师,研究方向为兽医药理与毒理学。E-mail:liyanhua1970@163.com

