磁共振扩散加权成像于肾脏恶性肿瘤的应用价值
尚 伟 刘安龙 李保庆 林光武
肾肿瘤是成人常见的肿瘤之一,且大多为恶性。80%的肾恶性肿瘤是来源于肾实质的肾细胞癌(renal cell carcinoma,RCC),主要包括:透明细胞癌(70%~80%)、乳头状细胞癌(10%~15%)和嫌色细胞癌(2%~5%)。其余大部分的恶性肿瘤为来源于肾盂的移行细胞癌(transitional cell carcinoma,TCC)。已有研究表明肾脏肿瘤的不同病理类型对于临床治疗及其预后存在重要意义[1]。穿刺活检是获取其病理类型的有效方法,但存在一定的适应证和并发症,并且为有创性检查。磁共振扩散加权成像(DWI)作为无创性功能性磁共振成像技术在中枢神经系统已经得到广泛应用,并随着硬件及软件的不断更新,其在体部也已开始得到应用[2],并已有关于正常人体肾脏ADC值及其同肾功能的相关性研究,但就DWI与肾脏恶性肿瘤病理类型相关性及预后的报道较少,且病例资料种类、设备及结果尚不完全一致[3-6]。据此本文就DWI结合T1、T2加权像对肾脏恶性肿瘤的病理分型判断及其与临床资料的相关性作进一步探讨。
方 法
1.临床资料
回顾性分析2011年1月~2012年12月间在我院经术后病理证实的49例肾脏恶性肿瘤患者的磁共振资料。其中男性33例,女性16例;年龄23~85岁,平均66岁。其中肾细胞癌(RCC)32例;移行细胞癌(TCC)17例。肾细胞癌中按照病理类型包括透明细胞癌(clear cell carcinoma, CCC)25例,乳头状细胞癌(papillary RCC)6例及嫌色细胞癌(chromophobic RCC) 1例。由于嫌色细胞癌例数较少,为便于统计,将乳头状细胞癌及嫌色细胞癌合并为非透明细胞癌组(non-clear cell carcinoma,Non-CCC)共7例。
2.影像检查
采用德国Siemens Symphony 1.5 T超导磁共振机。扫描序列包括:横轴位T1采用FLASH(fast low angle shot)梯度回波序列;横轴和冠状位T2采用快速自旋回波序列。扫描参数分别为:TR/TE 215/9ms和4300/90ms;层厚6mm;矩阵128×128;DWI采用平面回波扩散加权成像(echo planar imaging diffusion weighted imaging, EPI-DWI)。参数为TR/TE 3200/94ms;层厚6mm;视野(FOV)350mm×350mm;b值=0、500s/mm2。并测量肿瘤实性部分的表观扩散系数(apparent diffusion coefficient,ADC)。
3.图像分析
图像分析分别由两名10年以上磁共振阅片经验的高年资医师采用盲法对图像进行评判。评判不一致时由两人共同协商决定。评判内容包括肿瘤T1、T2信号强度、肿瘤大小、有无肾积水、有无淋巴结或远处转移等。ADC值测量的感兴趣区(region of interest, ROI)结合T1、T2图像及部分行增强扫描的图像尽可能避开坏死、钙化及出血区域,选取肿瘤的实性部分来测量。每个肿瘤选取3个ROI,每个ROI包含15~20个像素,并计算其平均值作为肿瘤部位的ADC值。ADC值的计算采用设备自带软件完成。肿瘤的信号强度同正常肾皮质相比分为3级:即低信号、等信号和高信号。
4.统计学处理
应用SPSS 13.0数据分析软件对所采集的数据进行处理分析,数据以均值±标准差(±s)表示;计数资料间的比较采用χ2检验;均数比较采用t检验;计量资料间的相关性采用Pearson相关分析及方差分析;P<0.05示为有统计学差异。
结 果
病变位于左肾者24例,右肾者25例;肿瘤大小2.5~13cm,平均3.3cm;所有患者肿瘤部位的ADC值为0.75~8.47×10-3mm2/s,平均为2.45±1.39×10-3mm2/s。
表1为RCC和TCC在T1及T2加权像的信号强度情况,结果显示两者在T1和T2加权像上的信号强度无明显差异(分别为P=0.35及P=0.08)。由于RCC总例数较少,按照χ2检验相关要求未进行病理分型进一步统计分析。进一步图像分析显示32例RCC中伴有肾积水者7例,17例TCC中伴有肾积水者4例,两者未见统计学差异(P=0.89)。

表1 49例RCC及TCC于T1WI及T2WI上的信号强度
RCC的平均ADC值明显高于TCC的平均ADC值,分别为2.93±1.35×10-3mm2/s和1.72±0.78×10-3mm2/s,P=0.024(图1、2)。
进一步统计分析RCC不同组织类型间的ADC值,由于嫌色细胞癌数目较少,将RCC分为透明细胞癌组(CCC)和非透明细胞癌组(Non-CCC)进行统计分析。结果显示透明细胞癌组ADC值明显低于非透明细胞癌组,分别为1.67±0.45×10-3mm2/s和3.81±1.81×10-3mm2/s,P=0.0005(图2、3)。
表2为ADC值同临床、病理资料间的相关性。Pearson相关分析显示ADC值同年龄、肿瘤大小未见明显相关性(P=0.45和0.25);单因素方差分析显示ADC值同RCC和TCC间的组织类型相关(P=0.024),同CCC和Non-CCC组织类型相关(P=0.0005);并同有无淋巴结转移(P=0.003)和远处转移(P=0.002)相关。而同性别、肿瘤部位未见明显相关性(P=0.69和0.65)。
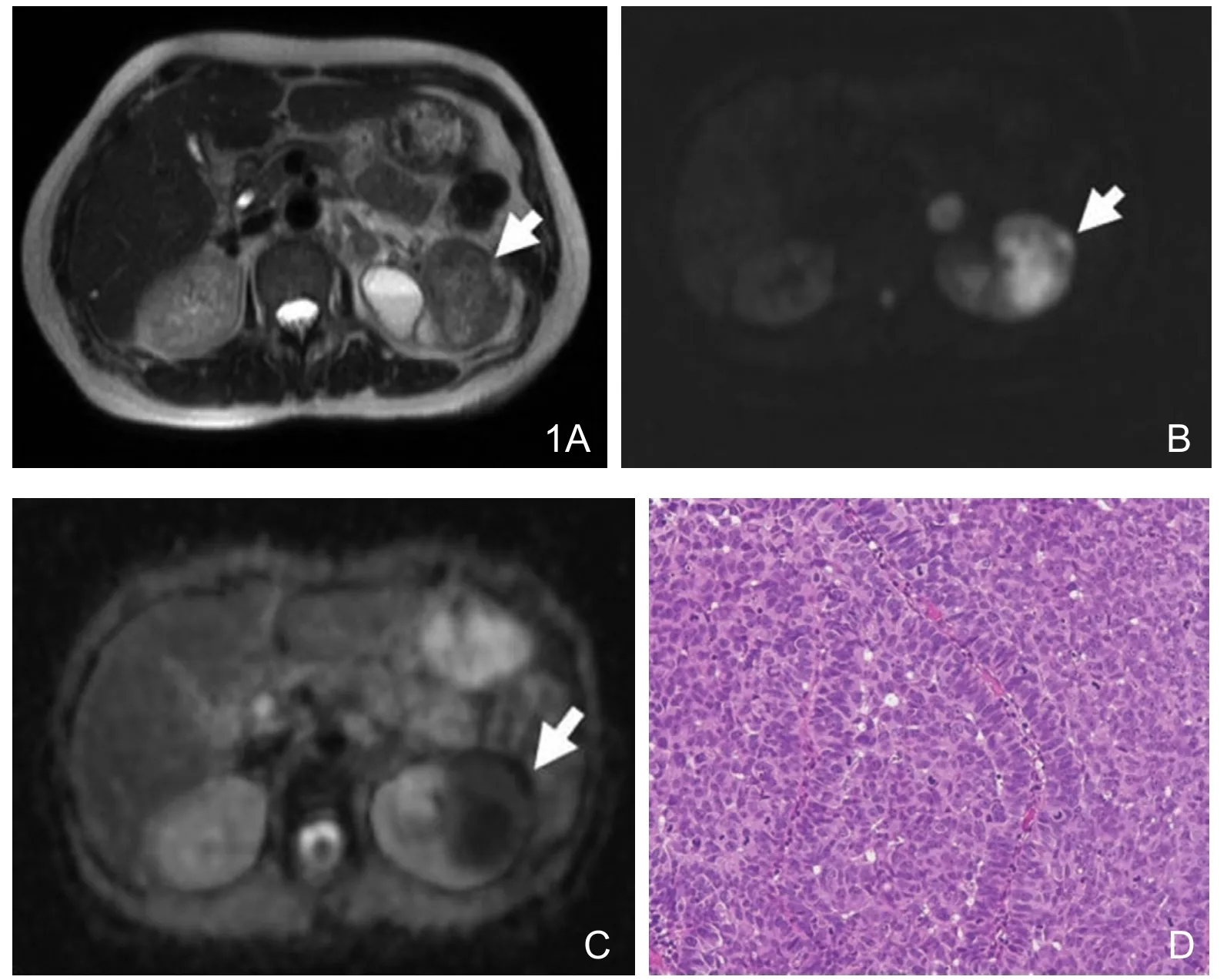
图1 57岁女性,左肾移行细胞癌。A.T2WI示左肾等高信号肿块。B.DWI示肿块呈高信号。C.ADC图肿块呈低信号,ADC值为0.93×10-3mm2/s。D.镜下显示肿瘤细胞排列紧密,呈柱状及扁平状,细胞核大小不一深染(HE×100)。
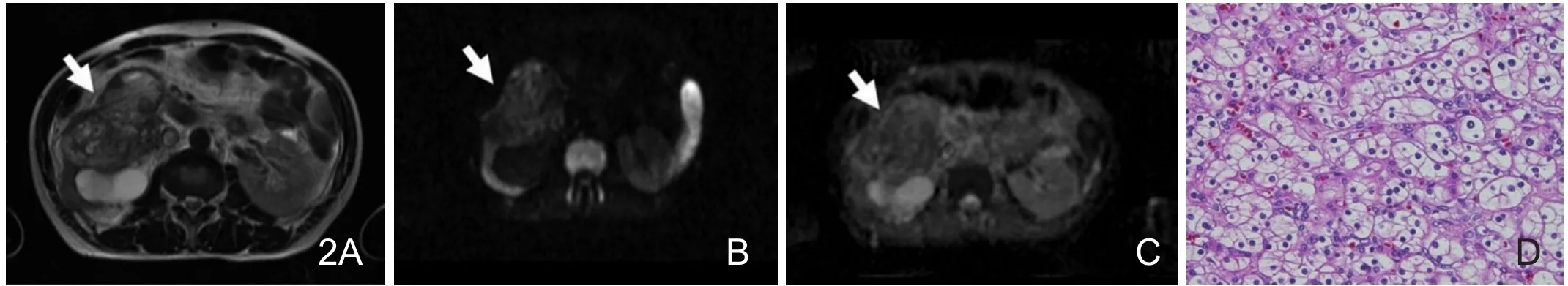
图2 64岁男性,右肾透明细胞癌。A.T2WI示右肾混杂略高信号肿块。B.DWI示肿块呈略高信号。C.ADC图肿块呈略低信号,ADC值为2.48×10-3mm2/s。D.镜下显示肿瘤细胞体积较大,圆形或多边形,胞质染色浅,透明或颗粒状,核固缩,间质富有毛细血管和血窦 (HE×100)。
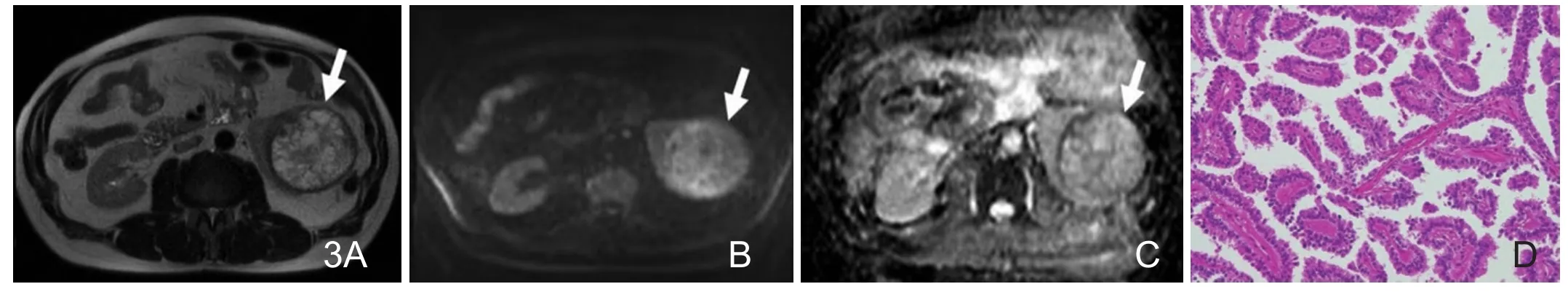
图3 37岁男性,左肾乳头状细胞癌。A.T2WI示左肾高信号肿块。B.DWI示肿块呈略高信号。C.ADC图肿块呈等高信号,ADC值为3.92×10-3mm2/s。D.镜下显示肿瘤细胞排列呈乳头样结构,细胞外间隙较大,瘤细胞核小,呈圆形或卵圆形 (HE×100)。
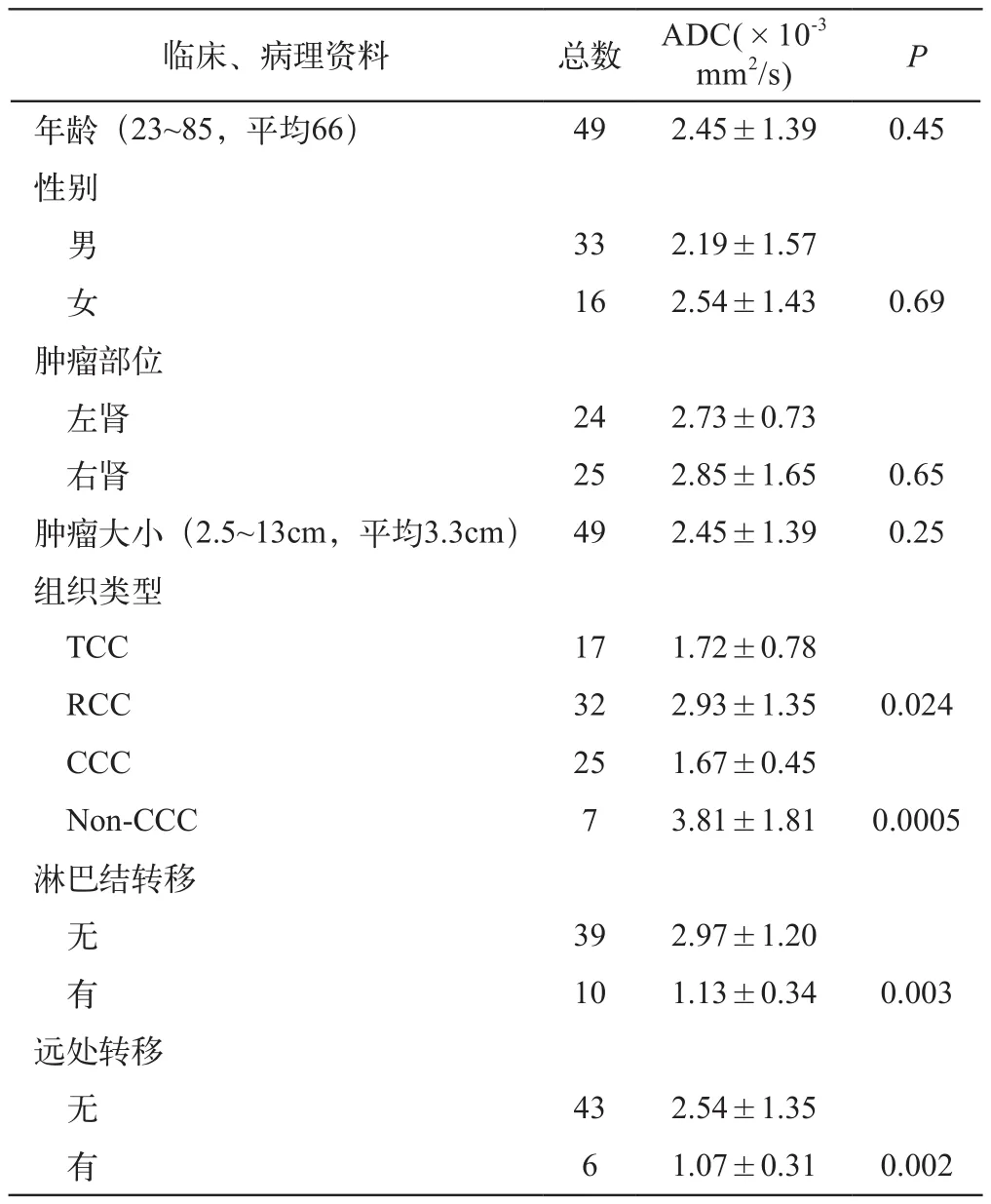
表2 ADC值同临床及病理资料间的相关性
讨 论
肾脏恶性肿瘤作为成人常见肿瘤,近年来其发现率及诊断准确率得到不断提高,但其死亡率并未见明显降低[1]。究其原因尽管常用检查手段如B超、CT及MRI可在肾肿瘤形态学方面提供了丰富信息,但对于肿瘤的鉴别分型方面还存在一定不足。并且已有研究显示肾肿瘤不同的病理类型与临床治疗及预后存在明显的相关性,如乳头状细胞癌及嫌色细胞癌的预后就明显好于透明细胞癌[1]。因此本文期望采用DWI手段从磁共振功能成像方面来评估肾肿瘤的相关临床及病理信息,从而为临床的诊断、治疗及预后提供更多的帮助。
DWI是基于活体内水分子扩散运动的磁共振功能成像技术,随着磁共振超快速成像序列尤其是平面回波成像序列的应用,DWI已逐渐应用于腹部影像诊断。肾脏位于腹膜后间隙受呼吸运动的影响相对较小,采用自由呼吸同样可以获取和屏气呼吸一样满意的图像质量[7]。对于b值的选择在兼顾信噪比和减少灌注影响的前提下,参考相关文献在1.5T设备上普遍采用b=500s/mm2[8-9]。对于ROI的选择由于肿瘤内部可由不同分化程度的肿瘤细胞及间质组成,可继发出血、坏死囊变及钙化等改变。本文结合T1及T2加权图像选择在肿瘤实性组织区域,以期获取的ADC值尽可能真实地反映肿瘤恶性程度及其生物学行为。
已有肾脏疾病DWI的研究报道显示,良性肿瘤的ADC值高于恶性;囊性肿瘤的ADC值高于实性肿瘤;肿瘤坏死区域ADC值高于非坏死区域[10-12]。但文献所报道病例均为肾细胞癌及部分良性占位,而未提及肾移行细胞癌(TCC)。肾TCC通常来源于肾盂,RCC和TCC在放射学角度尽管有一定形态学差异,但由于肿瘤较大及互相侵犯时造成其来源鉴别困难,并且本文结果显示两者在T1及T2加权像上信号特征无明显差异,且根据肿瘤大小、有无肾积水等形态学表现来鉴别两者仍存在困难。但本文结果显示RCC的ADC值为2.93×10-3mm2/s,明显高于TCC的ADC值1.72×10-3mm2/s。这是由于组织学上TCC主要由密实的移行上皮样肿瘤细胞组成,细胞间排列紧密,导致细胞外间隙减小,限制了其水分子自由扩散。而RCC通常可见出血、坏死及囊变区域,其细胞外间隙大于TCC。并且ADC值主要反映的是细胞外水分子的运动状况,从而导致RCC的ADC值明显高于TCC。汪等[10]报道显示恶性肾肿瘤的ADC值为1.75×10-3mm2/s,低于本文结果。而Manenti等[5]报道显示肿瘤ADC值为2.72×10-3mm2/s,同本文结果相近。上述具体数值存在差异主要与样本量、线圈、场强、参数等不完全相同有关。
本文进一步分型探讨显示CCC的ADC值为1.67×10-3mm2/s,明显低于Non-CCC的ADC值(3.81×10-3mm2/s),上述结果同样是由于两者间的细胞组织学差异所致。组织学上透明细胞癌由较大的肿瘤细胞组成,其内含有丰富的透明细胞浆,而细胞外间隙较小,导致水分子运动受限,ADC值减低。而非透明细胞癌由较小的瘤细胞组成,且细胞间的间隙较宽,水分子运动受限较轻,ADC值较高(图2、3)。Wang等[6]报道显示CCC的ADC值为1.849×10-3mm2/s,高于本文;Goyal等[11]显示CCC的ADC值为1.120×10-3mm2/s,低于本文。而余等[12]报道显示CCC的ADC值为1.778×10-3mm2/s,高于Non-CCC的ADC值(1.229×10-3mm2/s),其结果与Non-CCC的生物学行为及预后好于CCC不一致。上述结果的差异可能同样与样本量、ROI的选择及局部灌注水平等因素有关。
以上就RCC与TCC间ADC值的差异及RCC具体亚型间的ADC值进行了分别探讨。然而尚未见肾占位ADC值同淋巴结及远处转移相关性的报道。本文显示有淋巴结及远处转移的肾肿瘤ADC值明显低于没有转移的肾肿瘤。以上结果表明ADC值更低的肿瘤其侵袭性更强,这与其肿瘤细胞生长迅速,细胞更小、更丰富密实,细胞外间隙更小有关,从而限制了水分子的运动,导致ADC值比没有转移的肿瘤更低。因此ADC值或许可以作为预测肾肿瘤是否具有转移倾向的一个重要参考指标。
对于上述文献之间、文献同本文之间ADC值的不完全一致,笔者认为其原因有:①不同研究DWI所采用的序列、参数及b值的选择不完全相同。②不同研究中样本的选取条件、数目等有所不同而带来一定的个体差异。③ADC值同测量感兴趣区的选取也存在关系。鉴于此,有学者提出在不同的研究中心之间对于b值等DWI扫描重要参数应该尽可能的统一,或采用相对ADC值及EADC值[13]。从而建立可信的、有可比性的疾病诊断ADC标准。也只有如此DWI对于疾病的研究结果才具有可比性,所得结论才更具有说服力,从而使其应用更加广泛。
总之,DWI在鉴别肾恶性占位及组织分型方面具有一定作用,并且可能预测其恶性程度及预后。对于临床上肾恶性占位患者其ADC值较低时应进一步扩大检查范围以除外其存在淋巴结或远处转移的可能。同时本文也存在一定不足:如未包括良性病变;未全部进行增强扫描检查;TCC与CCC间的ADC值无明显差别,鉴别仍需密切结合T1及T2形态学资料;具体病理类型与淋巴结及远处转移的相关性由于例数较少未进行再分类统计等不足;本文为回顾性分析,尚有待前瞻性、大样本的数据验证。
[1] Chowdhury S, Choueiri TK. Recent advances in the systemic treatment of metastatic papillary renal cancer. Expert Rev Anticancer Ther, 2009, 9: 373-379.
[2] Dale BM, Braithwaite AC, Boll DT, et al. Field strength and diffusion encoding technique affect the apparent diffusion coefficient measurements in diffusion-weighted imaging of the abdomen. Invest Radiol, 2010, 45: 104-108.
[3] 李晨霞,孙兴旺,强永乾. 正常肾脏的磁共振扩散加权成像研究. 实用放射学杂志, 2008, 24: 970-972.
[4] 朱 捷,刘荣波,卢春燕,等. 正常肾脏3.0T磁共振扩散加权成像及其影响因素. 医学影像学杂志, 2012, 22: 606-610.
[5] Manenti G, Di Roma M, Mancino S, et al. Malignant renal neoplasms: correlation between ADC values and cellularity in diffusion weighted magnetic resonance imaging at 3 T. Radiol Med,2008, 113: 199-213.
[6] Wang H, Cheng L, Zhang X, et al. Renal cell carcinoma: diffusionweighted MR imaging for subtype differentiation at 3.0 T.Radiology, 2010, 257: 135-143.
[7] 王海屹,王 佳,叶慧义,等. 自由呼吸扩散加权成像与屏气扩散加权成像在肾脏病变方面的对比研究. 中国医学影像学杂志, 2011, 19:436-441.
[8] 李晨霞,孙兴旺,张月浪. 磁共振扩散成像在慢性肾病中的初步研究. 实用放射学杂志, 2008, 24: 1507-1511.
[9] Erbay G, Koc Z, Karadeli E, et al. Evaluation of malignant and benign renal lesions using diffusion-weighted MRI with multiple b values. Acta Radiol, 2012, 53: 359-365.
[10] 汪秀玲,程 丽,徐 凯. 磁共振扩散加权成像在肾脏占位性病变中的应用. 临床放射学杂志, 2010, 29: 1081-1085.
[11] Goyal A, Sharma R, Bhalla AS, et al. Diffusion-weighted MRI in renal cell carcinoma: a surrogate marker for predicting nuclear grade and histological subtype. Acta Radiol, 2012, 53: 349-358.
[12] 余小多,林 蒙,欧阳汉,等. 3.0T MR扩散加权成像诊断肾脏恶性肿瘤. 中国医学影像技术, 2010, 26: 538-542.
[13] Zhang YL, Yu BL, Ren J, et al. EADC values in diagnosis of renal lesions by 3.0 T diffusion-weighted magnetic resonance imaging:compared with the ADC values. Appl Magn Reson, 2013, 44: 349-363.

