雷公藤内酯醇C14 位羟基结构修饰及抗肿瘤活性研究进展
黄晓威,林友文*,陈晓春
1福建医科大学药学院,福州 350004;2 福建医科大学附属协和医院神经科,福州 350001
雷公藤Tripterygium wilfordii Hook.f.,又名断肠草、霹雳木等,是卫矛科雷公藤属木质藤本植物,是我国资源丰富的一种著名中草药,几百年来广泛用于治疗各种临床疾病[1]。雷公藤植物中化学成分复杂,从1936 年赵承嘏等[2]首次报道从雷公藤根部提取分离得到雷公藤红素至今,已有上百种化合物从雷公藤属植物中提取分离得到,这些化合物主要包括:二萜、三萜、倍半萜、生物碱、多糖等,其中二帖类化合物在实验中显示良好的药理活性[3],雷公藤内酯醇是雷公藤中最具代表的活性成分之一。
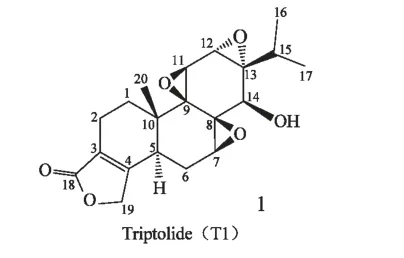
雷公藤内酯醇(Triptolide,T1),又名雷公藤甲素,Kupchan 等[4]于1972 年首次从台湾产的雷公藤中分离得到。实验研究表明,T1 具有良好的抗炎、免疫抑制、抗雄性生育等多种活性,可用于类风湿关节炎、红斑狼疮、慢性肾炎、白血病等疾病的治疗[5-8]。近年来,研究发现T1 还能抗血管生成,有效抑制多种癌细胞的增殖和迁移,具有良好的抗肿瘤活性[9-14],有望成为新的抗肿瘤药物。尽管T1 具有良好的药理活性,但是又有水溶性差、毒副作用大等缺点,极大的限制了临床上的应用[15]。因此,为了降低雷公藤内酯醇的毒性,提高临床应用的可行性,国内外许多学者做了大量的研究,针对其化学结构的不同部位进行修饰,合成了多种雷公藤内酯醇的衍生物,通过药理活性测试,得到了一些活性较好、毒性较低的化合物。雷公藤内酯醇的结构改造和修饰包括对C14-羟基、C12,C13-环氧、C7,C8-环氧、α,β-不饱和五元内酯环、C5,C6 的修饰,以及三环氧环的开环改造等。其中α,β-不饱和五元内酯环是生物活性必需基团之一,对内酯环的改造会显著降低其抗肿瘤活性,环氧环及C5,C6 的修饰均不同程度降低毒性和活性[16]。由于C14 位羟基的修饰物多数具有良好的水溶性,并能在生物体中转化为母体化合物,发挥前药的作用,本文着重综述了近十多年来国内外学者在雷公藤内酯醇的C14 位羟基结构修饰改造及其抗肿瘤活性研究进展。
1 酯化修饰
研究表明,雷公藤内酯醇C14β 羟基的空间结构是其发挥抗肿瘤活性的重要基团之一。但由于T1 的水溶性差,影响了其在体内的吸收代谢,限制了临床的应用。为了提高T1 的水溶性和抗肿瘤药理活性,降低毒性,很多学者针对C14-羟基进行了结构修饰,合成了多种的酯化衍生物。
1997 年,在一篇美国专利中,Qi 等人[17]采用琥珀酸酐与雷公藤内酯醇的C14-羟基在DCC/DMAP催化下反应,合成一些具有高水溶性的衍生物(Scheme 1)。其中,化合物4(C14-琥珀酸雷公藤内酯醇单酯钠盐,PG490-88),不仅具有高度水溶性,且在多项研究中均表现良好的药理活性和较低的毒副作用。Fidler 等[18]研究发现,PG490-88 单独使用就能诱导肺癌、结肠癌细胞的凋亡,而与CTP-11 联合应用能产生协同效应促进肿瘤细胞凋亡,且应用PG490-88 后能提高实体瘤的化疗敏感性。Krishna等[19]也发现PG490-88 能有效抑制博来霉素诱导的肺纤维化和炎症反应,表明它可能是一个可用于治疗肺纤维化的药物。目前,PG490-88 已通过美国FDA 和欧共体药物主管机构EMEA 批准,在美国、法国等进行I 期临床试验。
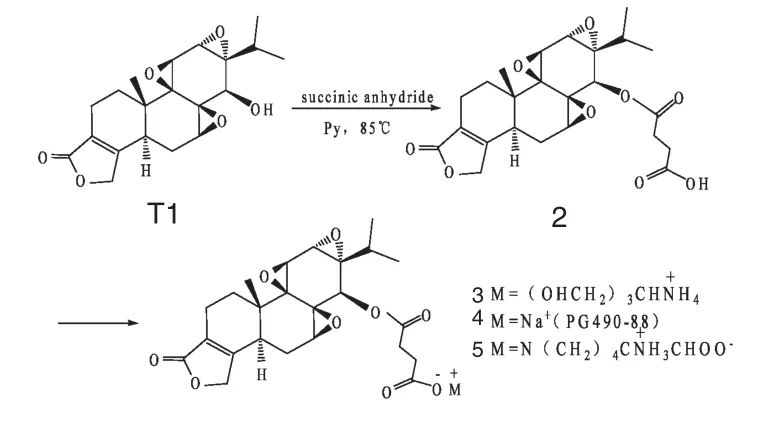
图1 化合物2~5 的合成步骤Fig.1 Synthesis procedure of compounds 2-5
Zhang 等[20-21]首先用琥珀酸酐与雷公藤内酯醇反应得到游离酸衍生物2,然后再与溶菌酶(LZM)反应,得到C14-琥珀酸雷公藤内酯醇溶菌酶偶联衍生物TPS-LZM 6(Scheme 2)。最后,用异硫氰酸荧光素(FITC)标记,进行动物实验。他们发现,经此改造后的衍生物不仅具有肾靶向作用,并且大大降低了雷公藤内酯醇的肝毒性和生殖毒性。
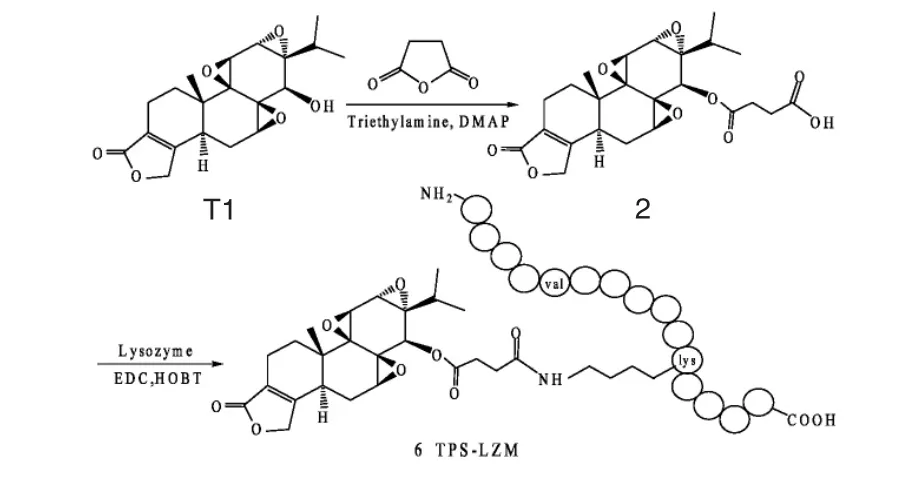
图2 TPS-LZM 偶联物的合成步骤Fig.2 Synthesis procedure of TPS-LZM conjugate
2 环氧化修饰
Li 等[22]以雷公藤内酯酮7 为初始物,分别用手性三元环氧基和五元环取代C14 位羰基,合成了2个系列新型的雷公藤内酯醇衍生物8~12(Scheme 3)和13~16(Scheme 4),使之不能形成分子内氢键,然后测定其抗癌活性。发现化合物8~12 均表现出明显的体外抗癌活性,尤以化合物8 的活性最高。体内进一步实验显示,化合物8 不仅对多药耐药性癌细胞有效,还具有选择性抗人卵巢癌(SKOV-3)和前列腺癌(PC-3),且其毒性也明显低于雷公藤内酯醇。这些都表明,化合物8 或许是一个有前途的抗肿瘤候选药物。
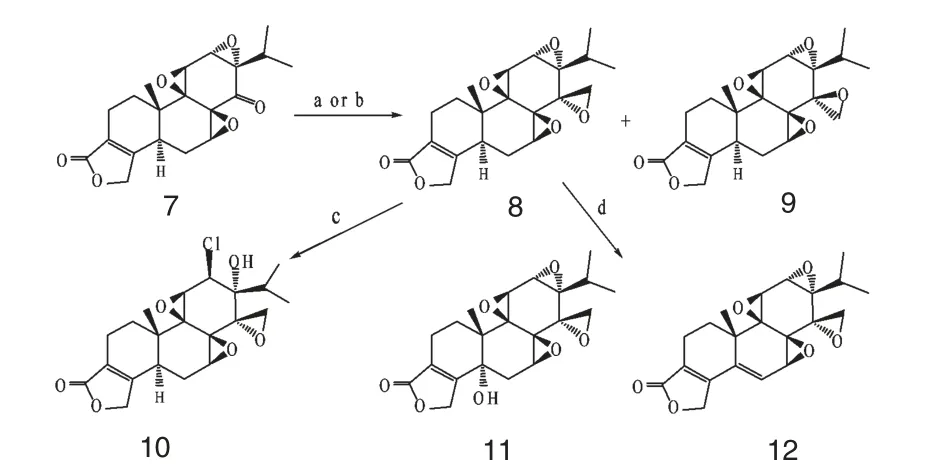
图3 化合物8~12 的合成步骤Fig.3 Synthesis procedure of compounds 8-12
3 铵盐取代乙酰化修饰
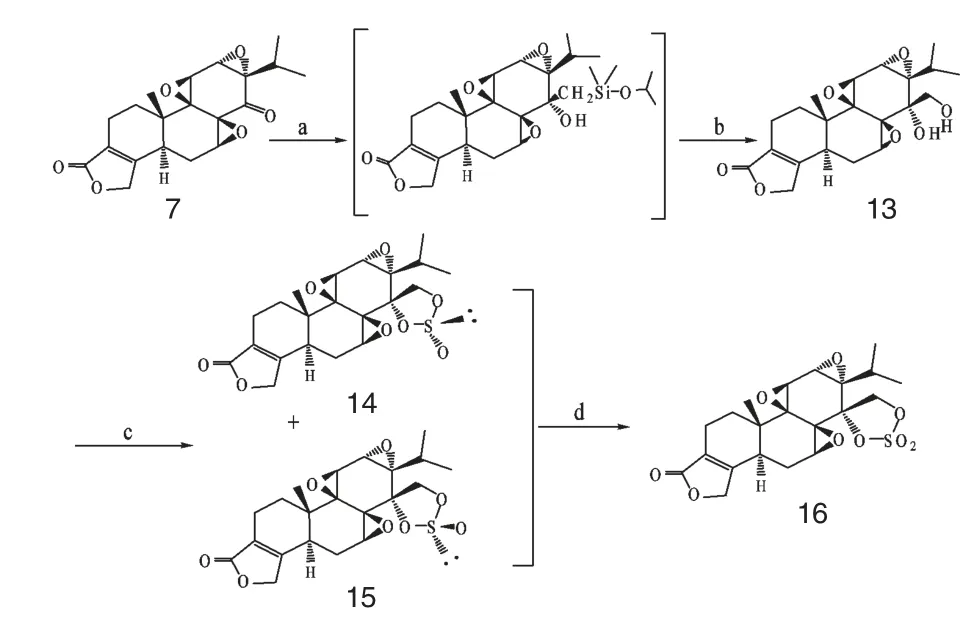
图4 化合物13~16 的合成步骤Fig.4 Synthesis procedure of compounds 13-16
Xu 等[23]采用氯乙酰氯对雷公藤内酯醇进行酯化,再用不同胺类化合物与氯乙酰化的雷公藤内酯醇反应,合成一系列具有良好水溶性的侧链带有铵盐的雷公藤内酯醇衍生物17~33(Scheme 5),并进行体内外药理活性测试。其研究表明,经此修饰后,虽然各种衍生物的水溶性大大增加,但其抗肿瘤活性却产生不同程度的降低。不过,值得一提的是,化合物19、20、23 和24 对耐伊马替尼的CML 显示出很好的抑制效果,有望成为克服伊马替尼耐药性的抗肿瘤候选药物。

图5 化合物17~33 的合成步骤Fig.5 Synthesis procedure of compounds 17-33
4 氟取代修饰
Aoyagi 等人[24]于2006 年报道了一些针对雷公藤内酯醇中C12α,C13α-环氧-C14-羟基结构进行改造的衍生物34~39(Scheme 6),并用A549 肺癌细胞和HT29 大肠癌细胞进行抗肿瘤活性研究。研究发现,衍生物34、35 能较好的保持抗肿瘤活性,而衍生物36~39 的活性均大大降低,特别是衍生物38,几乎丧失了抗肿瘤活性。因此,认为对C 环的改性将不同程度的降低T1 的抗肿瘤活性,C12α,C13α-环氧结构和C14-羟基的空间构型可能是雷公藤内酯醇发挥细胞活性、毒性必不可少的重要结构。
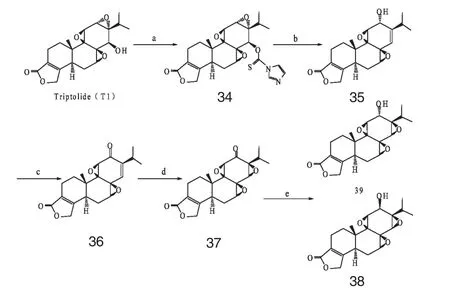
图6 化合物34~39 的合成步骤Fig.6 Synthesis procedure of compounds 34-39
Aoyagi 等于2008 年[25]报道了用氟化剂二乙胺基三氟化硫(DAST)或[双(2-甲氧基乙基)胺]-三氟化硫(Deoxo-Fluor)对雷公藤内酯醇及其衍生物进行结构改造,合成C14-位氟取代的雷公藤内酯醇及其类似物40~43(Scheme 7),并采用A549 肺癌细胞和HT29 大肠癌细胞进行细胞毒活性测试。他们发现,C14-F 取代羟基后的衍生物40b 在两种细胞株中的活性均高于T1,但C14-F 构型对活性有非常重要影响,其差向异构体40a 活性明显低于40b。除此之外,其他衍生物的细胞毒活性均远低于T1。

图7 化合物40a~43b 的合成步骤Fig.7 Synthesis procedure of compounds 40a-43b
5 结论
多年来国内外学者针对雷公藤内酯醇水溶性差、毒副作用大等,进行了许多结构改造及构效关系的研究,得到可喜的进展。总结学者们对雷公藤内酯醇C14 位结构改造的研究成果,有如下规律:1)雷公藤内酯醇C14 位基团的构型对其抗肿瘤活性有重要的影响,一般C14 位基团β 构型的活性高于α 构型的活性;2)对雷公藤内酯醇的C14 位羟基进行酯化、乙酰化修饰等,虽然会不同程度的降低其抗肿瘤活性,但同时也能降低毒副作用,提高水溶性,并且进入体内后酯键水解释放出雷公藤内酯醇,可作前药修饰;3)对雷公藤内酯醇的C14 位羟基进行氟代修饰有助于提高抗肿瘤活性。
围绕雷公藤内酯醇C14-羟基的结构修饰研究,今后重点可进一步研发C14-羟基的前药化修饰,包括提高水溶性的前药、高分子前药修饰;联合其它活性位点的修饰改造达到减毒增效的目的;对雷公藤内酯醇进行氟代修饰也将是一个很有前景的改造思路。围绕克服T1 毒性大、治疗窗窄的缺点,应加大缓控释制剂的研究开发。随着学者们对雷公藤内酯醇结构修饰和药理活性研究的不断深入,相信终有一天,科学家们将能合成出高活性、低毒性、宽治疗窗的雷公藤内酯醇衍生物,造福人类。
1 Shui GX(水光兴),et al.Progress in Tripterygium wilfordii and its bioactive components in the fieldof pharmacodynamics and pharmacology.Chin J Chin Mat Med(中国中药杂志),2010,359:515-520.
2 Xia ZL(夏志林),et al.Triterpene constituents from stalk and leaf of Tripterygium wilfordii.Chin Tradit Herb Drugs(中草药),1995,26:627-628.
3 Li JY(李建友),et al.Research progress of diterpenoids from Tripterygium wilfordii and the study on new drugs.J Shenyang Pharm Univ(沈阳药科大学学报),2012,29:901-907.
4 Kupchan SM,et al.Triptolide and triptdiolide,novel antileukemic diterpenoid triepoxides from Tripterygium wilfordii.J Am Chem Soc,1972,94:7194-7195.
5 Zheng Q,et al.Kinetic release of triptolide after injection of renal-targeting 14-succinyl triptolide-lysozyme in a rat kidney study by liquid chromatography/mass spectrometry.Biomed Chromatogr,2007,21:724-729.
6 Huang S,et al.Triptolide ameliorates auto-immune diabetes and prolongs islet graft survival in nonobese diabetic mice.Pancreas,2013,42:442-451.
7 Stephanie JL,et al.Triptolide is a traditional Chinese medicine-derived inhibitor of polycystic kidney disease.Proc Natl Acad Sci USA,2007,104:4389-4394.
8 Ranyia M,et al.Triptolide induces anti-inflammatory cellular responses.Am J Transl Res,2009,1:267-282.
9 Johnson SM,et al.Triptolide inhibits proliferation and migration of colon cancer cells by inhibition of cell cycle regulators and cytokine receptors.J Surg Res,2011,168:197-205.
10 Huang WW,et al.Triptolide inhibits the proliferation of prostate cancer cells and down-regulates SUMO-specific protease 1 expression.PLoS ONE,2012,7:e37693.
11 Lu L,et al.Inhibition of tumor cellular proteasome activity by triptolide extracted from the Chinese medicinal plant‘Thunder God Vine’.Anticancer Research,2011,31:1-10.
12 He MF,et al.Antiangiogenic activity of Tripterygium wilfordii and its terpenoids.Journal of Ethnopharmacology,2009,121:61-68.
13 Su D(苏丹),et al.Antitumor activity of the semisynthesis derivative of triptolide on mice with transplanted human colonic tumor cells.Chinese Journal of Experimental Traditional Medical Formulae(中国实验方剂学杂志),2009,15(11):58-60.
14 Pan JX.RNA polymerase:an important molecular target of triptolide in cancer cells.Cancer Letters,2010,292:149-152.
15 Sun X(孙新),et al.Safety of Tripterygium wilfordii.Chinese Journal of New Drugs(中国新药杂志),2001,10:539-542.
16 Li Z(李征),et al.Structural diversity and structure-activity relationship—new drug researchand development of Tripterygium wilfordii Hook.f..Progress in Chemistry(化学进展),2009,21:2483-2491.
17 Qi YM,Musser JH.US 5663335,1997-09-02.
18 Fidler JM,et al.PG490-88,a derivative of triptolide,causes tumor regression and sensitizes tumors to chemotherapy.Mol Cancer Ther,2003,2:855-862.
19 Krishna G,et al.PG490-88,a derivative of triptolide,blocks bleomycin-induced lung fibrosis.Am J Pathol,2001,158:997-1004.
20 Zheng Q,et al.Synthesis,Characterization and in vitro evaluation of triptolide-lysozyme conjugate for renal targeting delivery of triptolide.Arch Pharm Res,2006,29:1164-1170.
21 Zhang ZR,et al.The targeting of 14-succinate triptolide-lysozyme conjugate to proximal renal tubular epithelial cells.Biomaterials,2009,30:1372-1381.
22 Li Z,et al.Design and synthesis of novel C14-hydroxyl substituted triptolide derivatives as potential selective antitumor agents.J Med Chem,2009,52:5115-5123.
23 Xu F,et al.Design synthesis and biological evaluation of novel water-soluble triptolide derivatives:Antineoplastic activity against imatinib-resistant CML cells bearing T315I mutant Bcr-Abl.Bioorg Med Chem,2010,18:1806-1815.
24 Aoyagi Y,et al.Semisynthesis of C-ring modified triptolide analogues and their cytotoxic activities.Bioorg Med Chem Lett,2006,16:1947-1949.
25 Aoyagi Y,et al.Fluorination of triptolide and its analogues and their cytotoxicity.Bioorg Med Chem Lett,2008,18:2459-2463.

