黄山地区红豆杉中产紫杉醇内生真菌的分离和筛选
汪友明,马忠友,胡丰林,樊美珍,李增智
1安徽农业大学理学院 合肥 230036;2 安徽科技学院生物系 蚌埠 233100;3安徽农业大学微生物防治省重点实验室 合肥 230036
紫杉醇(Taxol,商品名Paclitaxe1)是从红豆杉树皮中提取的一种二萜类生物碱,是近十几年来获得的疗效显著的天然广谱抗癌药物,是目前全球销售量最大的抗癌药物[1-3]。目前研究生产紫杉醇的方法主要有四种:①从红豆杉植物直接提取;②化学半合成;③从红豆杉细胞培养物中提取;④从产紫杉醇的红豆杉内生真菌发酵代谢物中提取。由于红豆杉已经作为濒危物种被列为国家一级保护植物,显然从红豆杉植物组织中提取已受到极大的限制,同时红豆杉树皮中紫杉醇含量很低,药源极其有限,远不能满足临床用药需要。红豆杉细胞组织培养需要的条件严格且产量低而化学合成成本昂贵,因此这两种途径均不适合大量获取紫杉醇。而微生物发酵法生产紫杉醇,它不需依赖红豆杉而极具工业化生产潜力的方法。特别是自1993 年Stierle 与Strobel等首次报道了从太平洋短叶红豆杉(Taxus brevifolia)树皮中分离到一株能产生紫杉醇的内生真菌(Taxomyces andreanae),其紫杉醇含量为24~50 μg/L,为人们展示了一个可能生产紫杉醇的诱人的新途径[4]。国内在云南红豆杉(Taxus yunnanensis)、南方红豆杉(Taxus chinensis var.mairei)和东北红豆杉(Taxus cuspidata)等红豆杉属植物中已分离到产紫杉醇或其类似物的内生真菌,为紫杉醇的微生物工程提供了更广阔的途径[5-7]。本文主要从安徽黄山地区采集红豆杉植物样本进行内生真菌分离培养、鉴定、产紫杉醇菌筛选的研究。
1 材料与方法
1.1 材料
红豆杉(Taxus chinensis var.mairei)树根、嫩枝、针叶和树皮样本采自安徽省黄山旅游分景区外围,树径为30~100 cm,海拔800~980 m。样品采集后迅速装入无菌塑料袋,4 ℃保存。并由安徽农业大学微生物防治省重点实验室的李增智教授鉴定。
1.2 试剂和细胞株
紫杉醇标准品购于sigma 公司,青霉素钠与链霉素购于中国华北制药公司,其余试剂均为国产分析纯。中国仓鼠卵巢CHO 细胞株,购于中国科技大学免疫学实验室。
1.3 培养基
固体培养基选用PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂粉5 g,蒸馏水1000 mL,121 ℃,20 min 灭菌,冷却至60~70 ℃倒入25 mg/L 链霉素。液体培养基选用PDA 培养基不加琼脂。
1.4 内生真菌分离和纯化
将新鲜的植株样本用水洗净,叶片切成1 cm2小块;根与皮切成lcm 左右的小段(两端均需有切口)。把叶片和根茎段依次浸泡于75%酒精3 min,1%次氯酸钠溶液(含游离氯>2.5%)10~15 min,75%酒精再浸泡2~3 min 进行消毒以去除表面污染菌株,再用含有抗生素的PDA 培养基平板25 ℃培养。待菌落从切口处长出后,按常规方法对分离出的菌落进行纯化,以供鉴定和保藏。
1.5 内生真菌的液体培养及代谢产物的提取
将分离纯化后得到的菌株进行液体培养,用无菌PDA 液体培养基将真菌菌丝体和孢子洗下接人250 mL 三角瓶,放入25 ℃(±0.5),转速为150 rpm的全控温培养箱中培养。将培养好的菌株发酵液抽滤,分离出发酵液,将菌丝体刮下后冷冻干燥备用。发酵液采用低温真空浓缩处理,浓缩至原体积的1/5 后用等体积的氯仿和乙酸乙酯萃取多次后,将有机相浓缩近于1ml 备用。
1.6 代谢产物检测
1.6.1 薄层层析分析(TLC)
用标准品溶液作为对照,样品用毛细管点到已活化的GF254高效薄层层析硅胶板上,并成一点,点的直径控制在2 mm 以内。将硅胶板放入层析缸中展开,层析后取出硅胶板,用喷雾器在薄层板上均匀地喷上显色剂,在100 ℃的烘箱中显色约10 min 左右,观察斑点的大小、位置和颜色。
1.6.2 高效液相色谱分析(HPLC)
利用HPLC 建立紫杉醇标准曲线,用高效液相色谱(HPLC)测定,条件为:流动相为甲醇:水(v/v)=65∶35;反向C18柱(Waters4.6 ×250 mm,5 μm,ODS2),流速1 mL/min,检测波长228 nm.将样品发酵液5000 rpm 离心,蒸发浓缩一定程度加入等体积的乙酸乙酯萃取,收集乙酸乙酯相,然后加人按一定比例配好的三氯甲烷和水萃取后,将三氯甲烷相蒸发至干,用甲醇溶解后离心,取上清液上高效液相色谱做定量检测。
1.7 细胞毒性实验
CHO 细胞经胰酶消化后加新鲜培养液,于35℃、5%CO2培养箱中培养,每2~3 天换一次培养液,待细胞生长到对数分裂期,将细胞从培养瓶中转移到96 孔板中培养,细胞在96 孔板中培养24 h 且贴壁后,用移液器吸出旧的培养液,然后每孔加90 μL 新鲜培养液和10 μL 样品,同时设100%对照组、0%对照组,于37 ℃、5%CO2培养箱中培养72 h。酶标仪检测,计算抑制率。
2 结果与讨论
2.1 产紫杉醇产生菌的筛选
从安徽黄山地区红豆杉中分离出来107 多株内生真菌,通过液体培养后TLC 法的初步筛选发现共有8个菌株的发酵液提取物在薄层板上均能产生紫杉醇的特征性斑点出现,其Rf均与紫杉醇的标准品相同[见图1]。将8个菌株的发酵产物进行HPLC复筛检测。在一定的检测波长下,结果发现HQ-24菌株代谢产物的紫杉醇的吸收峰与紫杉醇标准品吸收峰保留时间一致。因此初步判定该菌株代谢物能产紫杉醇(见图2,图3)。
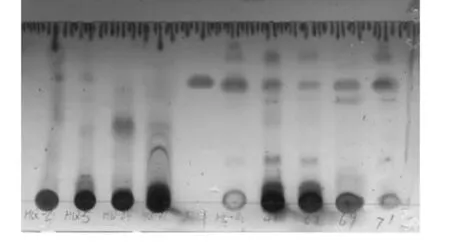
图1 安徽红豆杉内生真菌培养物的薄层层析Fig.1 Thin layer chromatograph of the organic extract the endophytic fungus from Taxus anhuiensis

图2 紫杉醇的标准品的HPLC 图谱Fig.2 The HPLC chromatogram of taxol standard sample
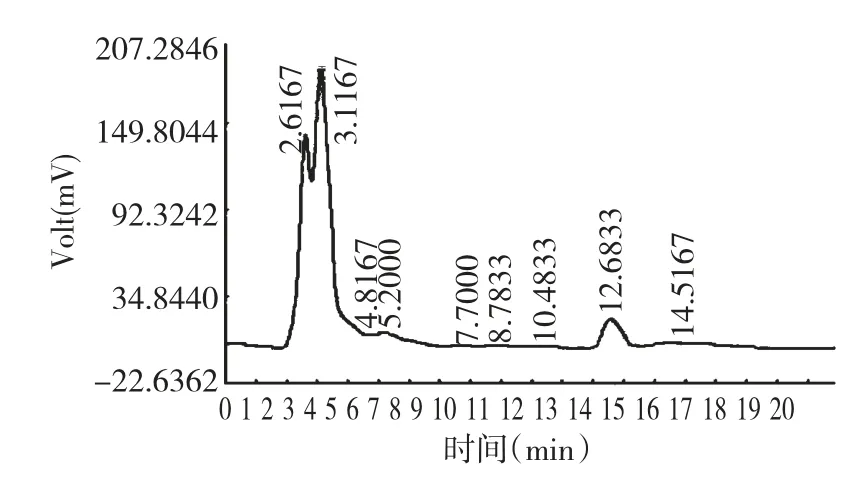
图3 HQ-24 代谢物的HPLC 图谱Fig.3 The HPLC chromatogram of the organic extract of HQ-24
2.2 目标菌株细胞毒性测定结果
将HQ-24 菌株发酵液冻干品用12.5%的DMSO 配成1.0 mg/mL 的样品溶液,用CHO Cytotoxicity Assay 模型进行测定,样品的测试终浓度为100 μg/mL。细胞毒性测定结果抑制率为71.28%(±1.22),由此可见HQ-24 菌株的代谢物细胞毒较大,结合HPLC 定量分析,该菌株值得作进一步研究。
2.3 目标菌株的生理特征和鉴定
菌株HQ-24 在查氏培养基上25 ℃培养8~10天直径可达到36~48 mm,菌落致密,质地绒状,平展,菌落白色,无渗出液,无特殊气味,边缘整齐;菌落背面淡黄色,中央无隆起,有树枝状皱纹。
菌丝无色,有隔膜。分生孢子梗从壁厚而较细的菌丝细胞生出,稍弯,大多数无隔膜,光滑,上部较粗大,顶端膨大成椭圆形的泡囊;从泡囊的全部表面以放射状生出小梗,初为辐射状,后呈疏松柱形,直径15~25 X 25~40 μm。分生孢子串生于小梗顶端,作辐射状排列,单个孢子球形或亚球形和椭圆形,直径为1.7 μm~2.3 μm,小,无隔膜,光滑,无色,根据HQ-24 菌株上述特征判定为曲霉(Aspergillus sp.)。(见图4)。

图4 HQ-24 菌株显微形态Fig.4 The photomicrography of HQ-24
2.4 讨论
研究表明:经过TLC 和HPLC 检测,可以证实HQ-24 菌株发酵次生代谢物可以产紫杉醇类化合物,通过CHO Cytotoxicity Assay 模型测定,说明该菌株代谢物细胞毒较大,具有很强的抗肿瘤活性,最后对该菌株的形态学鉴别,初步判定HQ-24 菌株属于曲霉属(Aspergillus)。从其HPLC 图谱可以看出,目标化合物的色谱峰非常小,其它不明物的色谱峰较多较强,这说明在HQ-24 发酵产物中紫杉醇类化合物含量较低,而其它化学成分较多。
至今已经有许多关于产紫杉醇真菌的研究,也反映了产紫杉醇真菌的多样性[8,9]。大量研究结果表明,红豆杉组织中紫杉醇的含量与其种属没有明显的相关性,而其产生紫杉醇的能力是否也与宿主红豆杉生长的地理位置及其生态环境存在相关性尚待进一步研究[10]。本研究中所得紫杉醇,虽然经TLC、HPLC 检测,但仍然需要从科学的角度进一步证明。内生真菌产紫杉醇的遗传基因是否稳定,紫杉醇的含量是否稳定,也有待进一步研究,从目前来看内生菌产紫杉醇的产量与工业化生产还有一段距离。如果能找到内生菌中的产紫杉醇的基因,并利用所分离得到的紫杉醇产生菌构建工程菌株将是工业化生产紫杉醇的一条可行途径。
1 Woo HL,Swenerton KD,Hosldns PJ.Taxol is active in platinum-resistant endometrial adeaocawinoma.Ain J Clin Oncol,1996,19:290-291.
2 Jones W,Schneider J,Shapiro F,et al.Treatment of resistant gestational chodoeardnoma with Taxol:A report of two cases.Cynecol Oncol,1996,61,126-130.
3 Li YC(李勇超),Zhou XR(周修任),Cheng YG(成元刚),et al.The pre-screening for taxol-producing endophytic fungi from Taxus.Biotechnology(生物技术),2009,19(5):22-25.
4 Strobel GA,Stierle A,Stierle D.Taxomyces andreanoe,a proposed new taxol for a bulbilli-ferous hyphomycete associated with Pacific Yew(Taxus brevifolia).Mycotaxon,1993,47:71-80.
5 Duan LL(段丽丽),Chen HR(陈鸿锐),Chen JP(陈杰鹏),et al.Screening the high-yield paclitaxel producing strain Alternaria alternate var.monosporus.Chin J Antibiol(中国抗生素杂志),2008,33:650-652.
6 Cheng L(程龙),Ma QM(马奇明),Tao GJ(陶冠军),et al.Systemic identification of a paclitaxel-producing endofungus.Indus Microbiol(工业微生物),2007,37(4):23-30.
7 Lu LY(卢陆洋),Qing Z(秦竹),Xu JK(徐金库),et al.Production of taxol by an endophytic fungus isolated from Taxus chinensis var.mairei.Chin Med Biotechn(中国医药生物技术),2010,5:202-207.
8 Tian RP(田仁鹏),Yang Q(杨桥),Zhou GL(周国玲),et al.Taxonomic study on a taxol producing fungus isolated from bark of Taxus chinensis var.mairei.Journal of Wuhan Botanical Research(武汉植物学研究),2006,24:541-545.
9 Hu K(胡凯),Tan F(谈锋),Tang KX(唐克轩),et al.Isolation and screening of endophytic fungi synthesizing taxol from Taxus chinensis var.mairei.J Southwest China Normal Univ(西南师范大学学报),2006,31:134-137.
10 Kang JC(康冀川),Jin R(靳瑞),Lei BX(雷邦星),et al.Recent research advances on endophytic fungi producing taxol.Mycosystema(菌物学报),2011,30:168-179.

