响应面法优化葡萄叶中白藜芦醇的提取条件
毛俊霞,张文君,李曦默,孙雅茹,杨建雄
陕西师范大学生命科学院,西安 710062
白藜芦醇(resveratrol)最初作为植物抗菌素而被发现的,是植物产生的一种次生代谢产物。其分子式为C14H12O3,相对分子质量为228.25,难溶于水,易溶于有机溶剂,广泛存在于21个科、31个属的72 种植物中[1],如寥科的寥属、大黄属,葡萄科的葡萄属和爬山虎属,百合科的藜芦属,莎草科的苔属,桑科的桑属,豆科的落花生属、羊蹄甲属和决明属等多种植物[2]。常见的含白藜芦醇的植物有决明子、何首乌和虎杖等传统药用植物,近来报道在葡萄、花生和桑树等中也含有一定量的白藜芦醇。白藜芦醇具有多种药理活性,如抗菌消炎抗病毒抗氧化、保护心血管系统、肝脏和神经元、调节免疫和骨代谢,并对癌症具有预防和治疗作用,被认为是继紫杉醇之后的又一抗癌成份[1-3]。
在葡萄的不同组织部位,如葡萄皮、葡萄籽、葡萄果穗轴和葡萄叶中均含有白藜芦醇[4]。而我国葡萄产业发达,每年秋季丢弃的葡萄叶数量可观,充分利用葡萄叶资源提取白藜芦醇,优选出低成本的提取方法,便可以变废为宝,为葡萄资源的合理利用开辟新途径,但尚未见到以葡萄叶为原料提取白藜芦醇工艺条件的研究报道。响应面法(RSM)是评价指标和因素间的非线性关系的一种试验设计方法,通过合理的试验设计得到的一定数据,建立影响因素与响应值之间的多元二次回归模型,通过对回归方程的分析来优化工艺参数[5,6]。本文以乙醇为浸提剂,以葡萄叶为原料,白藜芦醇提取量为考察目标,在单因素实验的基础上,利用响应面分析法优化提取条件,为利用葡萄叶提取白藜芦醇提供实验数据,以促进葡萄叶资源的更好开发利用。
1 材料与方法
1.1 材料与试剂
户太八号葡萄叶,采自西安市长安区滦镇葡萄园(阴干,粉碎,备用);白藜芦醇对照品,购自中国生物制品检定所(批号:100080-200707);乙酸乙酯和无水乙醇为分析纯,甲醇和乙腈为色谱纯。
1.2 仪器与设备
LC-2010 AHT 型高效液相色谱仪(日本岛津);BP221S 电子天平(Sartorius 公司);KQ-300DE 型数控超声清洗器(昆山市超声仪器有限公司);数显电热恒温水浴锅(常州国华电器有限公司);旋转蒸发器RE-52AA(上海亚荣生化仪器厂);Milli-Q Century 超纯水系统(美国Millipore 公司)。
1.3 方法
1.3.1 白藜芦醇的提取方法
称取一定量粉碎的葡萄叶片,按所设定的单因素条件浸提,提取液过滤,滤液回收溶剂并浓缩至一定体积。将该浓缩液转移至分液漏斗中,萃取3 次,每次乙酸乙酯液的使用量以1∶1 计,将上层的有机相收集并合并。用旋转蒸发仪回收乙酸乙酯,残留物用甲醇溶解并定容至5 mL,用微孔滤膜(φ=0.45 μm)过滤,得样品溶液。因白藜芦醇对光敏感,该过程需避光。
1.3.2 白藜芦醇的含量测定方法
采用高效液相色谱法(HPLC)测定样品中白藜芦醇的含量,色谱柱为Hypersil C18(4.6 mm × 250 mm,5 μm);流动相为水(A)和乙腈(B);洗脱程序:0~5 min,15%~24%(B);
5~33 min,24%~40%(B);流速为1.0 mL/min;柱温为30 ℃;检测波长为306 nm。
1.3.3 标准曲线的绘制
准确称取白藜芦醇对照品5.1 mg,用甲醇溶解并定容至25 mL,配成质量浓度为0.204 mg/mL 的对照品储备液。准确吸取上述白藜芦醇对照品储备液1 mL,稀释成20.4 μg/mL 对照品溶液。准确吸取上述对照品溶液,分别以5、10、15、20、25 和30 μL 的不同体积进样。在上述色谱条件下进行分析,以峰面积Y 为纵坐标,进样量X(μg)为横坐标,绘制标准曲线,得回归方程为:Y=7 ×106X-19421(r2=0.9996),表明进样量在0.1~0.6 μg 范围内,白藜芦醇含量与峰面积具有良好的线性关系。
1.3.4 方法学考察
在相同的色谱条件下,考察精密度、重复性、稳定性和加样回收率等指标,计算相对标准偏差(RSD)。
1.4 实验设计与数据分析
1.4.1 单因素实验
在进行响应面分析之前,先通过单因素实验选出对白藜芦醇提取量具有明显影响的因素并确定其试验水平。称取5.0 g 葡萄叶,考查了不同的乙醇体积分数、液固比、浸提时间、浸提温度和提取次数等对白藜芦醇提取量的影响。
1.4.2 响应面分析法优化提取条件
在单因素实验的基础上,通过分析软件Design Expert V 8.05 b 设计响应面分析法的实验方案,对葡萄叶中白藜芦醇的提取工艺作进一步的优化。
2 结果与分析
2.1 含量测定方法学考察结果
按1.3.2 的含量测定方法得到对照品和样品的色谱图,如图1 所示。
精密度试验:取20 μg/mL 的白藜芦醇对照品溶液重复进样5 次,记录峰面积,计算得RSD 为0.7%(n=5),说明该方法精密度良好。
稳定性试验:同一待测样品,在HPLC 中每隔2 h 测定1 次,共5 次,记录白藜芦醇的峰面积,计算得RSD 为3.17%(n=6),说明供试品溶液在10 h内稳定。
重复性试验:在相同的条件下,以同一葡萄叶制备5 份样品,在相同的HPLC 条件下检测白藜芦醇,由峰面积计算出RSD 为2.48%(n=5)说明该方法重复性好。
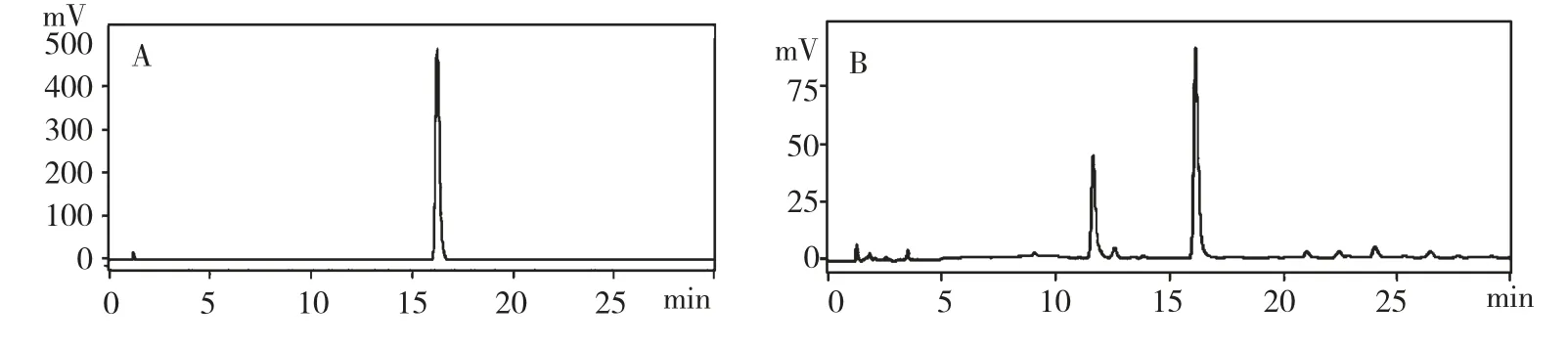
图1 白藜芦醇对照品(A)和葡萄叶提取物(B)的HPLC 色谱图Fig.1 HPLC chromatograms of resveratrol standard(A)and grape leaves extract(B)
加样回收率实验:准确称取干燥的葡萄叶5 份,每份以1∶1 的比例加入白藜芦醇对照品,按1.3.1的方法制备样品,在相同的HPLC 条件下检测,计算得平均回收率为102.09%,RSD 为3.27%(n=5),说明该方法的准确度好。
2.2 单因素实验结果
2.2.1 乙醇体积分数
称取4 份葡萄叶,按照20 倍体积分别加入30%、40%、50%和60%的乙醇溶液,于室温在300 W 的功率下超声处理30 min 后,于60 ℃水浴浸提60 min。所得提取液按1.3.1 方法操作后,用HPLC测定白藜芦醇的含量,结果如图2。由图可知:白藜芦醇含量随乙醇体积分数的升高而增大,当乙醇体积分数为40%和50%时,白藜芦醇含量较高;当乙醇体积分数继续升高时,白藜芦醇含量反而减小。原因可能是:随乙醇体积分数增加,醇溶性杂质和亲脂性成分的溶出量增加,影响了白藜芦醇与溶剂分子的结合,导致白藜芦醇提取量下降。综合考虑,选择体积分数为40%的乙醇作为提取剂。
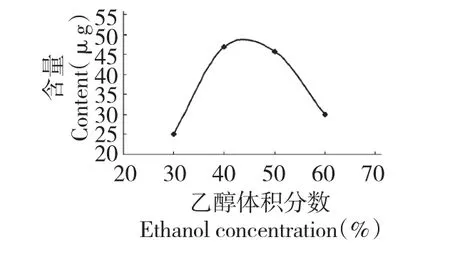
图2 乙醇体积分数对白藜芦醇含量的影响Fig.2 Effect of ethanol concentration on extraction yield of resveratrol
2.2.2 液固比
称取3 份葡萄叶,分别按照15、20 和25 倍的体积加入60%的乙醇溶液,于室温在300 W 的功率下超声处理30 min 后,于60 ℃水浴浸提60 min。所得提取液按1.3.1 方法操作后,用HPLC 测定白藜芦醇的含量,结果如图3。由图可知:随液固比的增加,白藜芦醇含量在增加,但液固比大于20 mL/g时,白藜芦醇含量增加缓慢。因此,选择20 mL/g 为最佳液固比。
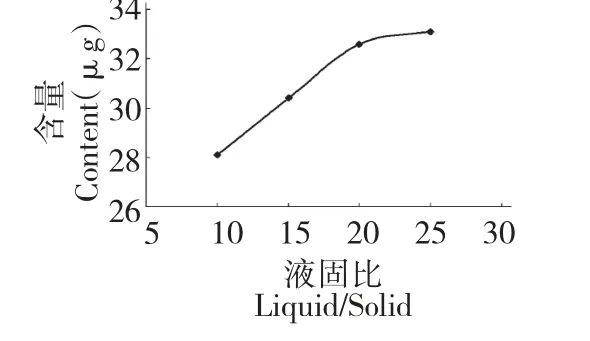
图3 液固比对白藜芦醇含量的影响Fig.3 Effect of ratio of liquid to solid on extraction yield of resveratrol
2.2.3 浸提时间
称取3 份葡萄叶,按照20 倍的体积加入60%的乙醇溶液,于室温在300 W 的功率下超声处理30 min 后,于60 ℃水浴分别浸提30、60 和90 min。所得提取液按1.3.1 方法操作后,用HPLC 测定白藜芦醇的含量,结果如图4。由图可知:随着时间的增加,白藜芦醇含量也增加,在60 min 时达到最大,时间继续增加,白藜芦醇含量却下降。这可能是由于提取时间为60 min 时,白藜芦醇已经较完全地溶出。由于白藜芦醇的热敏性较强,浸提时间延长后其分解速率超过溶出速率,从而导致白藜芦醇含量下降。因此,选择60 min 为最佳提取时间。
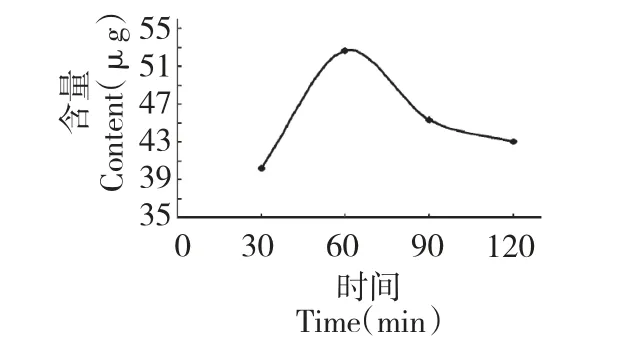
图4 提取时间对白藜芦醇含量的影响Fig.4 Effect of extraction time on extraction yield of resveratrol
2.2.4 浸提温度
称取3 份葡萄叶,按照20 倍的体积加入60%的乙醇溶液,于室温在300 W 的功率下超声处理30 min 后,分别于50、60 和70 ℃水浴浸提60 min。所得提取液按1.3.1 方法操作后,用HPLC 测定白藜芦醇的含量,结果如图5。由图可知:在40~60 ℃之间,随着温度的升高,白藜芦醇含量增加,60 ℃时效果最佳,温度继续升高时,白藜芦醇含量又会下降。这可能是由于白藜芦醇对热敏感,温度过高会导致其分解。因此,选择60 ℃为最佳提取温度。
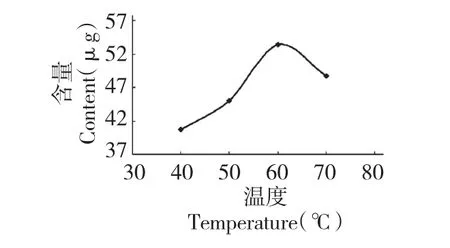
图5 浸提温度对白藜芦醇含量的影响Fig.5 Effect of extraction temperature on extraction yield of resveratrol
2.2.5 提取次数
称取4 份葡萄叶,按照20 倍的体积加入60%的乙醇溶液,于室温在300 W 的功率下超声处理30 min 后,于60 ℃水浴浸提60 min,分别提取1、2、3和4 次。所得提取液合并后按1.3.1 方法操作后,用HPLC 测定白藜芦醇的含量,结果如图6。由图可知:随提取次数的增加,白藜芦醇的提取量逐渐增加,当提取3 次后,白藜芦醇含量增加不明显。综合考虑后,确定提取次数为3 次。
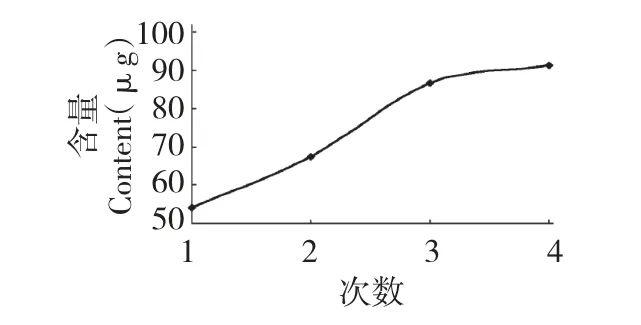
图6 提取次数对白藜芦醇含量的影响Fig.6 Effect of times of extraction on yield of resveratrol
2.3 响应面分析实验结果
在上述的单因素试验中,提取时间对白藜芦醇含量的影响较明显,且大部分文献报道的提取时间也在60 min;通常,目标物质的提取量会随提取次数增加而增加,故在运用响应面方法优化时,未考虑提取时间和提取次数这2个因素。响应面法的实验设计如表1,选取的自变量为乙醇体积分数(A)、液固比(B)和浸提温度(C),提取得到的白藜芦醇含量为响应值(Y),响应面试验的方案及结果如表2。
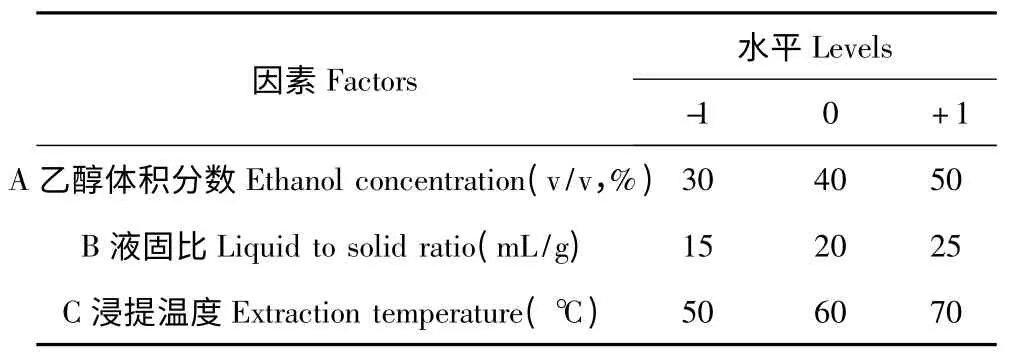
表1 响应面法的因素与水平Table 1 Factors and levels of RSM
对表2 的数据用分析软件Design Expert V 8.05 b 处理,得到如下的多元二次方程:Y=45.88 +4.10A+1.70B+0.49C+0.63AB-0.13AC +1.62BC-4.06A2-2.01B2-3.61C2。
式中:各项系数的绝对值大小反应各因素对响应值(Y)的影响程度,系数的正负则反映了影响的方向[7,8]。
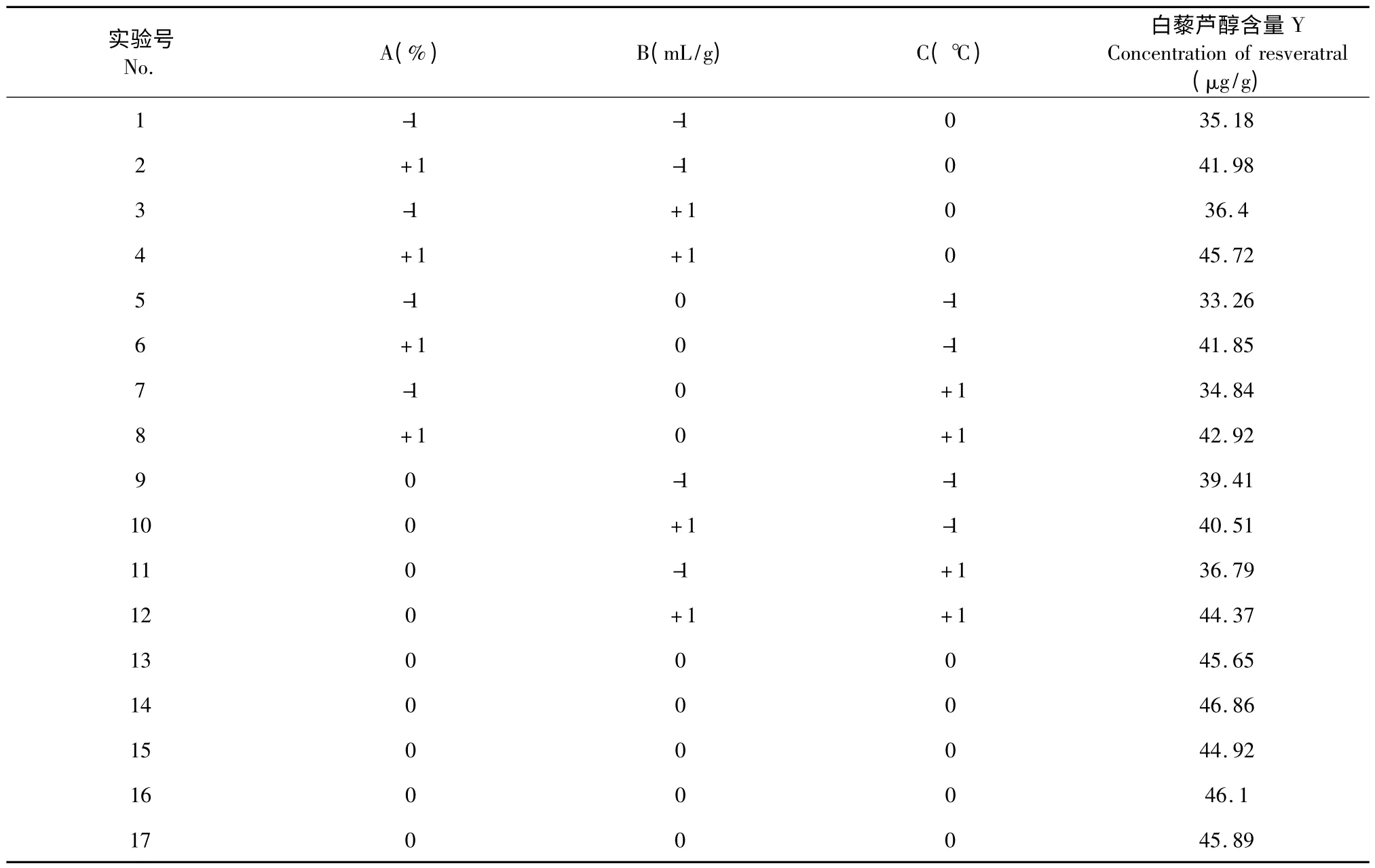
表2 Box-Behnken 试验设计与结果Table 2 Results of response surface experiments
表3 为响应面法试验数据的方差分析。统计显示:所建模型的F 值为63.74,反映显著性的P 值小于0.0001,即该模型极显著(P<0.01),对实验因素的拟合情况较好,可很好地描述实验结果;失拟性分析的F 值为1.36,P 值为0.3759(P >0.05),即失拟不显著,这表明未知因素对试验结果的干扰很小。模型的变异系数CV 值较小,仅1.83,说明该模型的可信度高,稳定性好,调整决定系数表示97.24%的响应值差异可由该模型解释,即该模型的相关性很好,可用该模型对白藜芦醇的提取过程进行分析和预测[6]。
各变量对响应值的影响大小,是由F 检验来判定的。概率P 值>F 的值越小,则相应变量对响应值影响的显著程度越高。由表3 可以看出:一次项中,液固比和乙醇体积分数对响应值的作用达到极显著的水平(P<0.01),浸提温度的作用不显著(P>0.05);二次项中,浸提温度、液固比和乙醇体积分数对响应值的作用均达到极显著水平(P<0.01);在交互项中,液固比和浸提温度的交互作用极显著(P<0.01),其余因素间的交互作用不显著(P >0.05),故不能用简单的线性关系表示所选实验因素对响应值的影响。在实验范围内,各因素对响应值的影响大小为:乙醇体积分数>液固比>浸提温度。
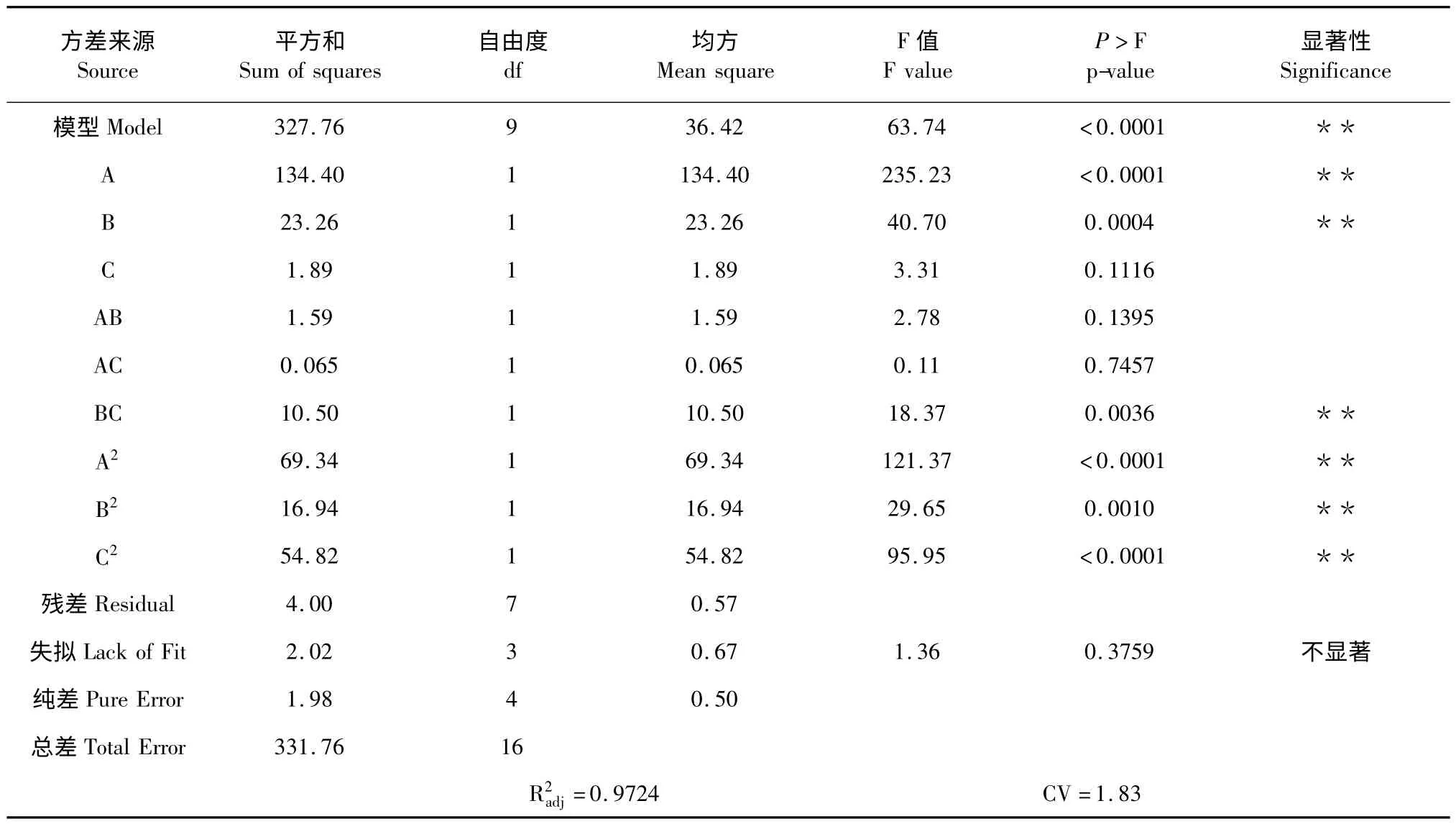
表3 回归模型的方差分析Table 3 Variance analysis of regression model
各因素交互作用对响应值的影响,如图7 所示。响应面图为三维空间曲面,是根据回归方程绘制的。分析发现:所有三维曲面的开口均向下,向上形成凸面,在一定的范围内,因素值增大引起响应值升高,响应值增加至最大值后,因素值的增大又导致响应值逐渐降低,故响应值的最高点即为所建模型的稳定点[9]。

图7 各因素交互作用对白藜芦醇提取量影响的响应图Fig.7 Response surface plots showing interactive effects of different factors on extraction yield of resveratrol
在底面上,响应值相同的点对应的因素值可形成等高线。交互作用的强弱可由其形状反映出来。当所考察因素的交互作用弱时,等高线接近圆形;当两作用因素的交互作用强时,等高线呈现为椭圆形[10]。观察各等高线,可发现液固比和浸提温度的交互作用强,为极显著;其余各因素的交互作用均不显著。
用分析软件Design Expert V 8.05 b 分析实验数据后,得出白藜芦醇的优化提取条件为:在61.9 ℃时,选择45.5%的乙醇,以22.95 mL/g 的液固比加入溶剂。选用上述优化的提取工艺,分析软件预测白藜芦醇提取量为47.55 μg/g。在实际提取过程中,将优化的提取方法近似为:乙醇体积分数为46%,液固比为23 mL/g,温度为62 ℃。
2.4 响应面法工艺验证实验结果
运用优化的提取方法平行制取3 份样品,以验证响应面法所建立的模型。HPLC 测得的白藜芦醇提取量为47.96 μg/g(RSD=2.55%)。与回归模型的预期相比,其相对误差只有0.86%,说明该模型可靠性好,所预测的结果准确,可用于分析和预测各因素对白藜芦醇提取量的影响。
3 结论
本文在单因素试验的基础上,采用响应面法对葡萄叶中白藜芦醇提取条件进行优化。该方法优化的白藜芦醇最佳提取条件为:在62 ℃的温度下,选择46%的乙醇,以23 mL/g 的液固比加入溶剂。回归分析和验证实验表明:该工艺条件提取率高,稳定性好,操作简便。
1 Chen XX(陈秀霞),Chen YQ(陈由强),Chen RK(陈如凯).Advances in the research of resveratrol.J Fujian For Sci Tech(福建林业科技),2003,30(14):84-88.
2 Wu CF,Yang JY,Wang F,et al.Resveratrol:botanical origin,pharmacological activity and applications.Chin J Nat Med,2013,11:1-15.
3 Fremont L.Biological effects of resveratrol.Life Sci,2000,66:663-673.
4 Li T(李婷),Li S(李胜),Zhang QS(张青松),et al.Comparison of the resveratrol contents in different grape tissues.J Gansu Agric Univ(甘肃农业大学学报),2009,44(2):64-67.
5 Cai LL(蔡亮亮),Yu FR(余方荣),Li XH(李西海),et al.Optimization of extraction conditions of Bauhinia championii benth polysaccharide based on response surface methodology.Nat Prod Res Dev(天然产物研究与开发),2012,24:1837-1843.
6 Huang XB(黄晓兵),Lin LJ(林丽静),Zhou YM(周瑶敏),et al.Optimization of ultrasonic extraction technology of flavonoids from longan.Acta Agric Jiangxi(江西农业学报),2012,24:116-119.
7 Wang TY(王桃云),Wang JH(王金虎),Hu CY(胡翠英),et al.Response surface methodology for optimization of extraction flavonoids from Spirodela polyrrhiza(L.)schleid and antioxidant evaluation.Chin J Biol Eng(生物加工过程),2012,10:1-6.
8 Rabesiaka M,Rabesiaka LR,Mabille I,et al.Extraction of trans-resveratrol from red wine and optimization by response surface methodology.Sep Pur Tech,2011,81:56-61.
9 Liu WX(刘伟霞),Yang JX(杨建雄).Optimization of extraction technology of forsythiaside and phillyrin in forsythia suspense leaves based on response surface methodology.Nat Prod Res Dev(天然产物研究与开发),2012,24:1098-1104.
10 Zhou XM(周晓明),Yan P(闫鹏),Ma K(马凯),et al.Optimization of ultrasonic-assisted extraction of flavonoids from maca by response surface methodology.Xinjiang Agric Sci(新疆农业科学),2012,49:1414-1420.

