通平养心方对高糖诱导H9c2 心肌细胞损伤的保护作用机制研究
尹 敬,田 炜,魏建强,喇孝瑾,杨雨旸,李继安*
1河北联合大学 国家老年医学国际合作基地;2 唐山工人医院,唐山 063000
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的主要并发症之一,随着糖尿病患病率逐年增加及病程的延续,糖尿病心肌病的发病率也迅速上升。糖尿病心肌病主要以心功能降低,心肌肥大为主要表现,长期发展还可以导致心肌纤维化和心力衰竭。虽然其发病机制尚未完全明了,但是高血糖及其高血糖通过活性氧簇诱导氧化应激在DCM 发病机制中的作用一直是人们关注的热点[1]。在高糖及氧化应激引起的心肌损害中,线粒体功能障碍是其主要表现形式[2]。因此,通过心肌线粒体功能评价来筛选心肌保护中药是当今的重要研究途径。我们以高糖培养建立H9c2 心肌细胞损伤模型,以临床经验方通平养心方作为对模型细胞干预因素,观察其对高糖导致心肌细胞损伤的保护作用,并初步探讨其作用机制。
1 材料与方法
1.1 材料与试剂
1.1.1 实验药品
通平养心方(由瓜蒌、红景天、葛根、黄芪、丹参、桂枝、薤白、麦冬、赤芍、甘草、苏子、莱菔子组成):所有中药饮片均购于唐山市北京同仁堂药店,由河北联合大学中医学院实验室进行药物制备。
制备方法:将上述药物按组方比例混合,研粗末装于4 层纱布袋封口并置于烧杯中,加10 倍量水浸泡1 h,用文火煎煮2 h,过滤药液;药渣再加8 倍量水煮沸1 h,过滤药液,将2 次滤液合并,浓缩成浓度为1 g/mL 的药液,4 ℃冰箱保存备用。
1.1.2 细胞株
大鼠胚胎心脏组织来源的H9c2 细胞株,购自中科院上海细胞库。
1.1.3 主要材料与试剂
MTT 细胞增殖及毒性检测试剂盒(碧云天生物技术研究所),DMEM 培养基购自赛默飞世尔生物化学制品(北京)有限公司(批号:NXM0765)。抗体p-JNK、GAPDH、SP600125 等均购自Cell Signaling technology Inc(CST)。辣根过氧化物酶标记山羊抗兔IgG(批号:A0208);辣根过氧化物酶标记山羊抗小鼠IgG(批号:A0216);BCA 蛋白浓度测定试剂盒(碧云天生物技术研究所)。
1.1.4 仪器
37 ℃二氧化碳孵箱(美国ThermoForma 公司),FV1000 激光共聚焦显微镜(日本OLYMPUS 公司),生物安全柜(海尔集团有限公司),5804R 高速冷冻离心机(德国eppendorf 公司),JY200C 电泳仪(北京君意东方电泳设备有限公司),酶标仪以及半干转运系统(均来自BIO-RAD 公司)。
1.2 方法
1.2.1 细胞培养
H9c2 细胞在37 ℃、5% CO2条件下,以10%FBS 低糖(5.5 mmol/L)DMEM 培养基培养,待细胞生长融合至80%时进行传代,并取4~6 代细胞进行实验。实验时用无血清低糖DMEM 培养细胞48 h,使各组细胞生长同步化后够进行实验。
1.2.2 激光共聚焦检测线粒体膜电位的变化
于超净台内,将生长到80%~90%融合状态的细胞用胰酶消化下来并离心,弃上清后用培养基重悬,混匀,每个共聚焦小皿中加入2 mL 细胞悬液,标记后置于37 ℃,5%CO2,饱和湿度孵箱培养48 h后;弃去小皿中的培养基,PBS 冲洗2 遍,每个小皿加入新培养基2 mL,并加入线粒体膜电位的特异性标记物TMRE(100 nM)2 μL,37 ℃孵箱孵育20 min后将小皿置于共聚焦显微镜观测台,随机选取视野观察,用波长为543 nm 氦氖激光激发TMRE 荧光染料产生红色荧光。
实验分组及处理方法:①Control 组,即高糖组(High Glucose,HG),小皿置于共聚焦显微镜观测台后选定视野并扫描图像,随后加入33 mmol/L 高糖培养基[3,4],观察时间为20 min,扫描图像。②通平养心方处理组(TP):在小皿进行换培养液后将小皿置于共聚焦显微镜观测台后选定视野并扫描图像,然后加入不同终浓度的(10、1、0.1、0.01、0.001 μg/mL)通平养心方进行图像扫描,于10 min 后对同视野进行图像扫描,随后加入高糖培养基观察时间为20 min,扫描图像。③SP600125 处理组(SP):小皿换液后选定视野并扫图,加入10 μM 的JNK 抑制剂SP600125 后进行图像扫描,于10 min 后对同视野进行图像扫描,随后加入高糖培养基观察时间为20 min,扫描图像。
1.2.3 MTT 法检测细胞活力
选择对数生长期的细胞,胰酶消化后重悬细胞,进行细胞计数,使得96 孔板每孔加入100 μL 约2000个细胞。按照实验分组处理细胞,在细胞贴壁生长48 h 后,每孔重新换培养基100 μL 后加入10 μL MTT 溶液,在细胞培养箱内继续孵育4 h。随后每孔再加入150 μL DMSO,在细胞培养箱内继续孵育15 min 左右,直至在普通光学显微镜下观察发现蓝紫色结晶物全部溶解后,酶标仪570 nm 波长处测定吸光度。
实验分组:①Control 组,低糖(5.5mmol/L)组;②HG 组,高糖(33mmol/L)组;③TP +HG 组,通平养心方(0.1 μg/mL)预处理10 min,再加入高糖培养基20 min;④TP 组,通平养心方(0.1 μg/mL)预处理10 min,再加入低糖培养基20 min。
1.2.4 Western Blot 检测p-JNK、p-GSK-3β 水平
收集各组细胞,加入裂解液于冰上裂解30 min,刮取细胞,4 ℃、12000 rpm 离心15 min。将上清移至1 mL Ep 管中。用BCA 蛋白定量试剂盒制备标准曲线,酶标仪测定562 nm 波长下蛋白的吸光度。制备10%分离胶和5%浓缩胶,将蛋白与2 ×上样缓冲液混匀,沸水煮5 min 使蛋白变性。上样总蛋白为60 μg,加入电泳缓冲液,80 V 电泳约40 min,待进入分离胶后改为150 V 约1 h。再以52 mA,转PVDF 膜2 h。5%脱脂奶粉封闭1 h 后,加入相应一抗(p-JNK 1 ∶1000,p-GSK-3β 1 ∶1000,GAPDH 1∶500),4 ℃过夜,TBST 洗膜3 次,每次10 min。加入过氧化物酶标记的山羊抗兔IgG(1∶1000),山羊抗小鼠IgG(1∶1000),室温孵育2 h。TBST 洗膜3次,每次10 min。ECL 显色,暗室内曝光。结果用ImageJ 软件分析,计算条带的吸光度值,采用目的蛋白与内参的比值来表示蛋白表达水平。
实验分组:①Control 组,加入低糖(5.5 mmol/L)培养基20 min;②HG 组,加入高糖(33 mmol/L)培养基20 min;③TP +HG 组,通平养心方预(0.1 μg/mL)处理10 min,再加入高糖培养基20 min;④TP组,通平养心方预(0.1 μg/mL)处理10 min,再加入低糖培养基20 min;⑤SP 组,JNK 抑制剂预处理组10 min,再加入低糖培养基20 min;⑥SP+HG 组,JNK 抑制剂预处理10 min,再加入高糖培养基20 min。
1.3 数据处理
实验所得数据均以Excel 表建立数据库,数据均采用均数±标准差()表示。应用SPSS13.0统计软件对数据进行t 检验、方差分析,统计学检验以P<0.05 为差异有统计学意义。
2 实验结果
2.1 不同处理组细胞TMRE 荧光强度的影响
33mmol/L 葡萄糖(HG)处理H9c2 细胞20 min后,TMRE 荧光强度明显减弱(降至45.1 ±2.8 %,P<0.05),提示此浓度的葡萄糖可以引起线粒体损伤,从而引起mPTP 的开放。与高糖组相比,用JNK抑制剂SP600125(10μM)及不同浓度(10、1、0.1、0.01、0.001 μg/mL)通平养心方预处理,各组均使高糖引起的TMRE 荧光减弱程度下降(P<0.05),其中0.1 μg/mL TP 组的抑制作用最为显著(90.1± 3.7%,P<0.05),与JNK 抑制剂作用类似,提示TP 可以抑制高糖引起的线粒体损伤,并且这种保护作用以0.1 μg/mL 组最为显著(表1,图1)。
表1 不同处理组TMRE 荧光强度变化(n=7,)Table 1 TMRE fluorescence intensities in different treatment groups(n=7,)

表1 不同处理组TMRE 荧光强度变化(n=7,)Table 1 TMRE fluorescence intensities in different treatment groups(n=7,)
注:与空白对照组比较,* P<0.05。Note:Compare with control,* P<0.05.
2.2 通平养心方降低高糖引起的心肌细胞毒性
与Control 组(低糖5.5 mmol/L)相比,0.1 μg/mL TP 预处理能显著对抗HG 对H9c2 心肌细胞的毒性作用,使细胞存活率从73.0 ±2.0%增加至89.3 ±3.5%(P<0.05;表2)。
表2 不同处理组对细胞活性的影响(n=20,)Table 2 Effects of different treatment groups on cell viability(n=20,)
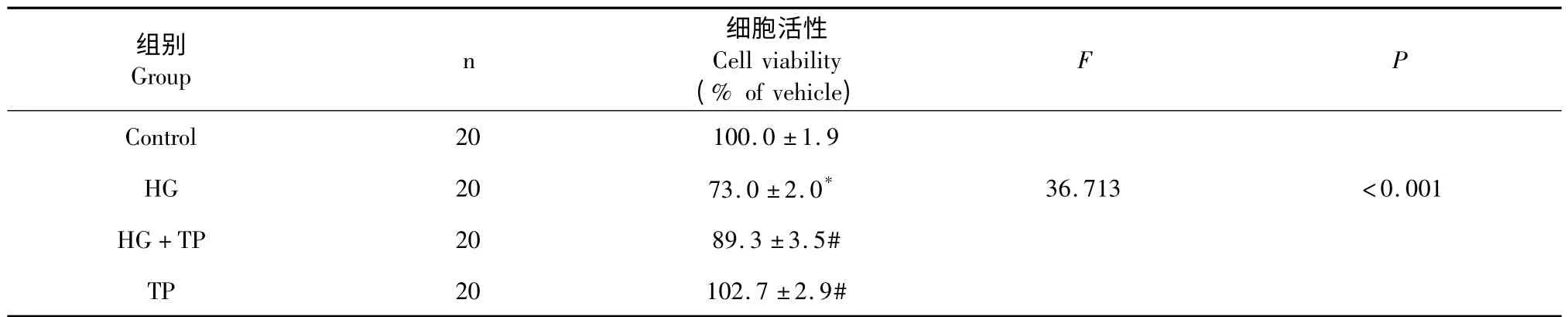
表2 不同处理组对细胞活性的影响(n=20,)Table 2 Effects of different treatment groups on cell viability(n=20,)
注:与空白对照组比较,* P<0.05,#P<0.05。Note:Compare with control,* P<0.05,#P<0.05.
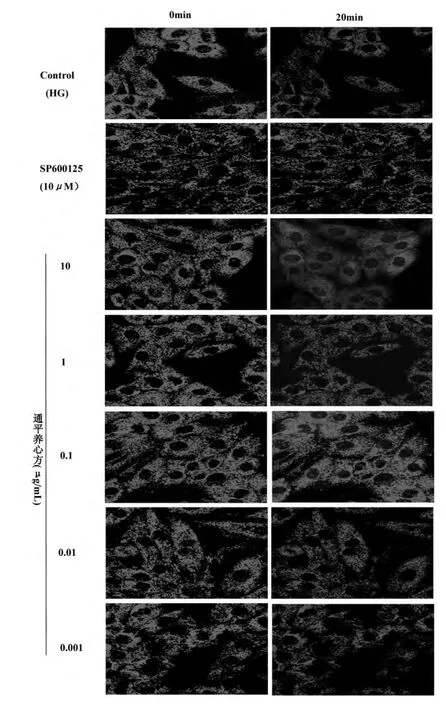
图1 激光共聚焦显微镜成像显示不同处理组TMRE 荧光强度(×400)Fig.1 TMRE fluorescence intensities in different treatment groups detected by LSCM(×400)
2.3 通平养心方对JNK 通路的影响
Western blot 结果显示(表3,图2),与Control组(低糖5.5 mmol/L)相比,HG 能够引起p-JNK 的表达明显增高(198.6 ±22.0%,P<0.05),0.1 μg/mL TP 预处理后使高糖引起的p-JNK 的表达增高被抑制(113.5 ±7.9%,P<0.05)。在加入JNK 抑制剂SP600125 预处理后,同样使得高糖引起的p-JNK的表达增高被抑制(129.7 ±7.8%,P<0.05),说明通平养心方与JNK 抑制剂SP600125 的作用相似,提示通平养心方可通过下调p-JNK 的表达发挥抗心肌氧化损伤作用。
2.4 通平养心方对GSK-3β 磷酸化的影响
Western blot 结果显示(表4,图3),与对照组相比,高糖能够引起p-GSK-3β(Ser9)表达明显降低,提示高糖引起的氧化应激通过抑制GSK-3β 磷酸化,促进mPTP 孔的开放。单独通平养心方处理组与HG 组相比,p-GSK-3β 的表达增高(130.9 ±7.3%,P<0.05),提示通平养心方可以促进GSK-3β 磷酸化。与HG 组相比,0.1 μg/mL TP +HG 处理组p-GSK-3β 表达增加(89.9 ±10.9%,P<0.05),而这种增加作用,与JNK 抑制剂SP600125 类似,说明在高糖引起的心肌损伤时,通平养心方可能是通过降低JNK 的活性,使p-GSK-3β 表达增加,抑制mPTP的开放,从而对心肌细胞发挥保护作用。
表3 p-JNK 蛋白的表达(n=6,)Table 3 The optical density of the expression of p-JNK(n=6,)
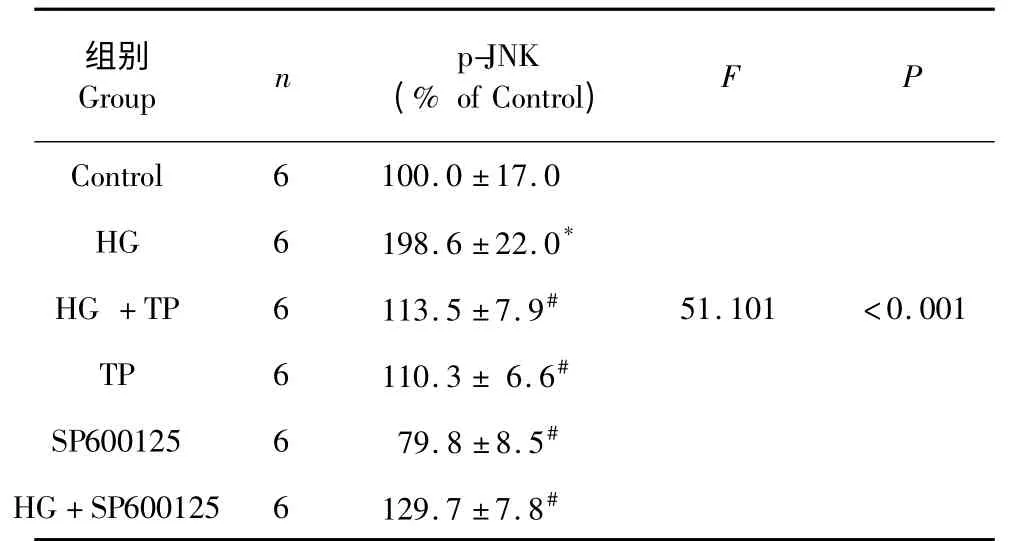
表3 p-JNK 蛋白的表达(n=6,)Table 3 The optical density of the expression of p-JNK(n=6,)
注:与空白对照组比较,* P<0.05;与高糖(HG 组)比较,#P<0.05。Note:Compare with control,* P<0.05;Compare with high glucose,#P<0.05.
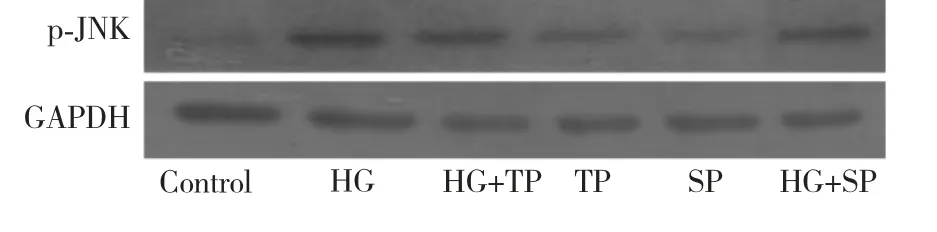
图2 p-JNK 蛋白的表达Fig.2 The optical density of the expression of p-JNK
表4 p-GSK-3β 蛋白的表达(n=6,)Table 4 The optical density of the expression of p-GSK-3β(n=6,)
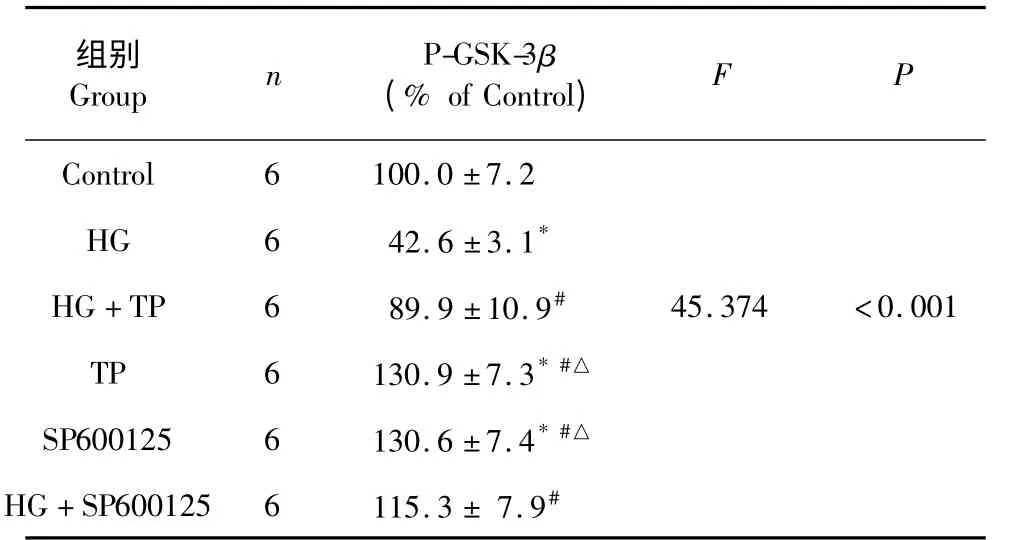
表4 p-GSK-3β 蛋白的表达(n=6,)Table 4 The optical density of the expression of p-GSK-3β(n=6,)
注:与空白对照组比较,* P<0.05;与高糖(HG 组)比较,#P<0.05;与高糖+通平组相比,△P<0.05。Note:Compare with control,* P<0.05;Compare with high glucose,#P<0.05;Compare with high glucose and TP,△P<0.05.
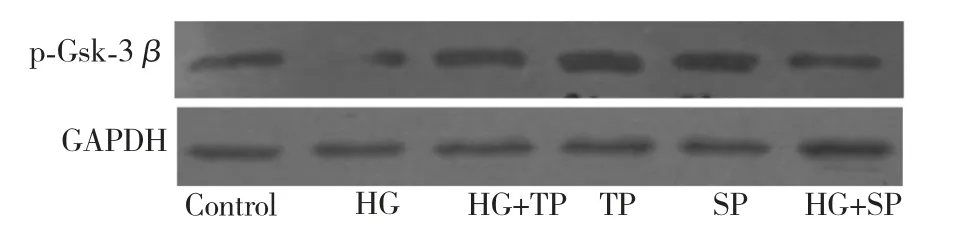
图3 p-Gsk-3β 蛋白的表达Fig.3 The optical density of the expression of p-Gsk-3β
3 讨论
糖尿病心肌病发病机制非常复杂,其中高血糖作为心肌损害的独立危险因素能造成心肌氧化代谢异常[5],持续的高糖状态使心肌细胞处于过度氧化应激状态,而过度的氧化应激可激活多条促凋亡信号通路[6]。其中JNK 通路可能参与了高糖诱导H9c2 细胞的凋亡过程。GSK-3β 作为JNK 通路下游因子,是调控心肌细胞mPTP 开放的关键,而mPTP对维持线粒体的正常结构和功能至关重要,应激条件下mPTP 开放会导致线粒体肿胀,膜电位消失,这是引起心肌损伤的重要环节[7]。许多心肌保护药物是通过抑制GSK-3β 的活性来阻止mPTP 开放,从而在心肌缺血/再灌注损伤中发挥保护作用的[8,9]。因此,JNK 通路可能也是高糖所致心肌损害的重要途径,由此推测,JNK 通路可能是治疗糖尿病心肌病的新靶点。
通过参考Cai 等[3]和Li 等[4]的相关研究,本研究主要采用33 mmol/L 作为高糖诱导心肌细胞损伤的条件。结果发现,在33 mmol/L 高糖处理条件下,H9c2 细胞TMRE 荧光强度明显减弱,细胞存活率明显降低,p-JNK 蛋白表达增加,GSK-3β 磷酸化水平显著降低。而这一作用被JNK 的抑制剂SP600125拮抗,进一步证明JNK 通路参与了高糖诱导的心肌细胞损伤(表3,图2)。由此提示,高浓度的葡萄糖对心肌细胞的损害是通过JNK-GSK-3β-mPTP 途径实现的。
通平养心方由《金匮要略》瓜蒌薤白白酒汤合三子养亲汤化裁而来,全方合用通阳散结,祛痰下气,活血通脉。临床观察对糖尿病心肌病有良好治疗作用。方中主要药物瓜蒌有保护缺血心肌,缩小梗死范围的作用。另外,我们研究发现,方中其他主要药物,如红景天的主要成分红景天苷可抑制心肌细胞mPTP 的开放发挥保护心肌作用[10]、葛根的主要成分葛根素对糖尿病大鼠心肌有保护作用[11]。由此推测通平养心方防治糖尿病心肌病作用的机制之一是通过心肌保护实现的。
研究结果提示,通平养心方预处理能保护高糖引起的心肌细胞损伤,抑制p-JNK 蛋白表达,提高GSK-3β 磷酸化水平,能够抑制mPTP 开放,减轻高糖应激对心肌细胞线粒体的损伤(表1,图1),增加细胞存活率(表2)。其中0.1 μg/mL 浓度的通平养心方最佳,其与JNK 的抑制剂SP600125 作用相似。
综上所述,通平养心方对高糖诱导的H9c2 细胞损伤具有一定的保护作用,其作用机制之一可能是通过JNK 通路,抑制p-JNK 蛋白表达、促进GSK-3β 的磷酸化、从而抑制mPTP 的开放实现的。
1 Li QF(李庆凤),Su K(苏珂).The research progress of the pathogenesis of diabetic cardiomyopathy.Chin General Prac(中华全科医学),2011,9:291-311.
2 Xiong Y(熊燕),Zhang M(张梅),Chen F(陈菲),et al.Mitochondrial dysfunction and cardiovascular disease.Chin J Pathophysi(中国病理生理杂志),2013,29:364-370.
3 Cai L,Li W,Wang GW,et al.Hyperglycemia-induced apoptosis in mouse myocardium mitochondrial cytochrome c-mediated caspase-3 activation pathway.Diabetes,2002,6:1938-1948.
4 Li Y,Li Y,Feng Q,et al.Calpain activation contributes to hyperglycaemia-induced apoptosis in cardiomyocytes.Cardiovasc Res,2009,84:100-110.
5 Liang JL(梁家亮),Yu XY(余细勇),Shan ZX(单志新),et al.The research of H9c2 cardiomyocytes apoptosis and activate JNK pathway induced by high glucose.J Prac Med J(实用医学杂志),2010,26:2094-2097.
6 Trachootham D,Lu W,Ogasawara MA,et al.Redox regulation of cell survival.Antioxid Redox Signal,2008,10:1343-1347.
7 Zhang M(张梦),Hu YX(胡亦新),Cui H(崔华).Resveratrol by raising the silent information adjustment factor 1 adjustment cigarettes extract induced myocardial mitochondria produce reactive oxygen species.Chin J Health Care Med(中华保健医学杂志),2013,15:163-172.
8 Xu J,Tian W,Ma X,et al.The molecular mechanism underlying morphine-induced akt activation:roles of protein phosphatases and reactive oxygen species.Cell Biochem Biophys,2011,61:303-311.
9 Song YO,Wang L,Poyil P,et al.Cadmium induces carcinogenesis in BEAS-2B cells through ROS-dependent activation of PI3K/AKT/GSK-3β/β-catenin signaling.Toxicol Appl Pharmacol,2012,264:153-160.
10 Li T(李婷),Zhang Y(张莹),Li L(李琳).Salidroside inhibition mechanism of myocardial cell apoptosis induced by hypoxia experiment research.Space Med Med Engineer(航天医学与医学工程),2011,24:21-24.
11 Chen XF(陈秀芳),Lei KF(雷康福),Dong M(董敏),et al.Effect of puerarin on myocardial damage in STZ induced diabeticrats.Chin J Pathophysi(中国病理生理杂志),2010,26:650-655.

