晚期结直肠癌患者维持治疗的必要性Δ
马伯敏,徐爱平,马妮娜(.山东鱼台县人民医院肿瘤科,山东济宁 272300;2.首都医科大学附属北京友谊医院肿瘤科,北京 00050)
对于化疗获益后的转移性结直肠癌(Metastatic colorectal cancer,mCRC)患者的后续治疗,仍然存在争议。持续治疗会导致药物副作用的累积,且长期暴露于化疗药物中,会降低患者对药物的敏感性;而中断治疗会导致化疗疗效明显降低,甚至影响患者的无进展生存时间(Progression-free survival,PFS)和总生存期(Overall survival,OS)。鉴于此,研究者提出了“维持治疗”的概念,即对于在标准的高强度治疗后获得疾病控制的患者,停用某些毒性明显的药物,而采用低强度、低毒性的药物进行持续化疗。与持续化疗相比,维持治疗并未对患者的生存产生影响,而且毒副作用更低,患者生活质量更好;与中断治疗相比,其能延长患者PFS。因此,维持治疗为上述争议提供了一种新的解决模式。本文主要探讨了mCRC维持治疗的必要性,以期对mCRC患者的治疗提供一定参考。
1 维持治疗与持续治疗比较
对于转移性结直肠癌,甲酰四氢叶酸(LV)、氟尿嘧啶(FU)和奥沙利铂的组合(FOLFOX)是标准的一线治疗方案,而奥沙利铂累积的神经毒性经常迫使仍处于缓解期的患者停药。在预定的周期完成之后,仅仅停止一种毒性较强的药物,使用其他药物维持,并且在疾病进展的时候重新应用原始方案,这便是OPTIMOX-1 的研究策略。在这个研究中,先前未经治疗过的mCRC 患者,随机分配为FOLFOX4 2 周方案直到疾病进展(A组);或经FOLFOX7治疗6个周期后,停止毒副作用较强的奥沙利铂,进行为期为12 个周期的无奥沙利铂维持治疗,当疾病进展后再给予FOLFOX7方案治疗(B组)[1]。OPTIMOX-1 的研究结果提示两组患者具有相似的PFS(9.0 个月vs.8.7 个月)、OS(19.3 个月vs.21.2 个月)和反应率(Response rate,RR)(58.5%vs.59.2%),但是维持治疗组的患者3/4级神经毒性显著减少(13.3%vs.17.9%),这表明奥沙利铂在预期的6个周期完成后是可以停药的,而单独应用LV/5-FU的维持治疗是一个非常有利的选择[1-2]。
自从贝伐单抗批准应用于结直肠癌的治疗后[3-7],贝伐单抗作为结直肠癌的维持治疗也进入了人们的视线。在MACRO/TTD 试验中,患者在接受每3 周给药的贝伐单抗、卡培他滨和奥沙利铂(XELOX)6 个周期后,被随机分配到持续使用XELOX联合贝伐单抗或贝伐单抗单药维持治疗组,两组均用药直到疾病进展。主要终点是PFS;次要的终点是OS、RR、中位缓解持续时间、肿瘤控制率、达到临床有效时间和安全性[8]。该研究的中位随访时间为29.0个月。结果提示,XELOX联合贝伐单抗的中位PFS为10.4个月,贝伐单抗单药组的中位PFS为9.7 个月,两组之间的差别没有统计学意义(P=0.38)。同样,联合组和单药组的中位OS 分别为23.2 个月和20.0 个月(P=0.66);RR 分别为47%和49%,比值比(OR)为0.95,差别均无统计学意义。随后,研究者又对中位缓解持续时间[11.0个月vs. 8.3 个月,风险比(HR)为1.17]、肿瘤控制率(73%vs.76%)、达到临床有效时间(4.0个月vs.3.9个月,P=0.86)进行了分析,均无明显差别。但是在安全性方面,贝伐单抗单药维持治疗的不良反应率低于联合化疗组。XELOX 联合贝伐单抗组的3/4级治疗相关毒副作用的发生率为55%,贝伐单抗单药组为47%。而与联合用药相比,贝伐单抗单药在神经毒性、手足综合征以及乏力方面更具优势,发生率明显降低,分别为26%vs.8%、13%vs.7%、10%vs.4%,其中神经毒性方面的优势具有显著的统计学意义(P<0.000 1)。因此,与持续治疗相比,维持治疗的疗效相当,但副作用明显降低。
在后续的CONcePT 研究中,患者随机分配至mFOLFOX-6联合贝伐单抗持续给药或者进入4个月mFOLFOX-6 联合贝伐单抗治疗后,使用5-FU/亚叶酸钙(LA)联合贝伐单抗维持治疗组。与持续性奥沙利铂组相比,间歇式奥沙利铂组获得了更好的至治疗失败时间(Time to treatment failure,TTF)(5.6 个月vs. 4.2 个月,P=0.025)和PFS(12 个月vs. 7.3 个月,P=0.044),患者的副作用更少,表明贝伐单抗+5-FU/LA的维持治疗是可行的。
因此,与持续化疗相比,停止使用某些毒性较强的药物,而采用低强度、低毒性的药物进行维持化疗,不仅不会影响患者的PFS、OS 和有效率,而且大大降低了药物的毒副作用,患者的耐受性和依从性更好,是非常有利的选择。
2 维持治疗与空白治疗比较
当然,在姑息治疗中,生活质量也是需要考虑的事情。鉴于OPTIMOX1 研究表明,停用奥沙利铂的维持治疗与持续应用FOLFOX4 化疗直到疾病进展或出现不能耐受的毒副作用会获得相同的效果,研究者提出,在完成预定的化疗周期后,不仅仅停用奥沙利铂,而是停用全部化疗药物,使患者进入一个完全无化疗间歇期(Completely chemotherapy-free interval,CFI)。预期患者经CFI 期后,在避免奥沙利铂累积的神经毒性、减少长期化疗带给患者心理与生理疲乏的同时,在疾病进展时重新应用FOLFOX 的治疗,可能会减轻由于长期暴露于化疗药物引起的药物耐药,从而提高FOLFOX 方案的疗效[9]。然而,研究结果提示,分配至维持治疗组(A组)的中位疾病控制时间(Duration of disease control,DDC)为13.1 个月,分配至CFI 组(B 组)的中位DDC 为9.2 个月(P=0.046),维持治疗组的中位PFS和中位OS分别为8.6、23.8个月,CFI组分别为6.6、19.5 个月。A 组和B 组初始应用FOLFOX 化疗的RR 分别为59.2%、59.6%,再次应用FOLFOX 的RR 分别为20.4%、30.3%。该研究得出结论:与维持治疗方案相比,完全停止化疗对患者的DDC 和PFS 会产生负面的影响。Chibandel 等比较了维持治疗组及观察组,认为与维持治疗相比,观察组患者PFS、DDC和OS均较短,提示间断治疗明显劣于维持治疗。
国内的Li YH 等[10]亦采用XELOX 方案为一线治疗,之后使用卡培他滨维持。与未应用维持治疗的患者相比,维持组DDC明显延长(14个月vs.9个月,P=0.041)。2013年,荷兰结直肠癌组的Ⅲ期CAIRO3 研究再次将贝伐单抗联合卡培他滨作为维持治疗(B组)与空白治疗(A组)相对照,疾病进展后再次应用XELOX+贝伐单抗方案。该研究的主要终点PFS2(疾病进展后再次治疗的PFS)是显著获益的(8.5 个月vs.11.7个月,HR=0.67,P<0.000 1),次要终点PFS1(初始治疗的PFS)[4.1 个月vs. 7.4 个月,HR=0.44,95%置信区间(CI)0.37~0.54,P<0.000 1]、TTP2(疾病进展后再次治疗的TTP)(11.5 个月vs. 15.4 个月,HR=0.58,95%CI 0.48~0.72,P<0.000 1)也是显著改善的。发表于今年的COIN-B试验将西妥昔单抗作为维持治疗与空白治疗相对照,研究者发现,对于KRAS 野生型的患者,10 个月无失败存活率(Failure-free survival,FFS),维持治疗组为52%,高于间歇组的50%;中位无失败生存期分别为14.3、12.2 个月,均为维持治疗组获益[11]。维持治疗与持续治疗或维持治疗与空白治疗对比试验见表1。
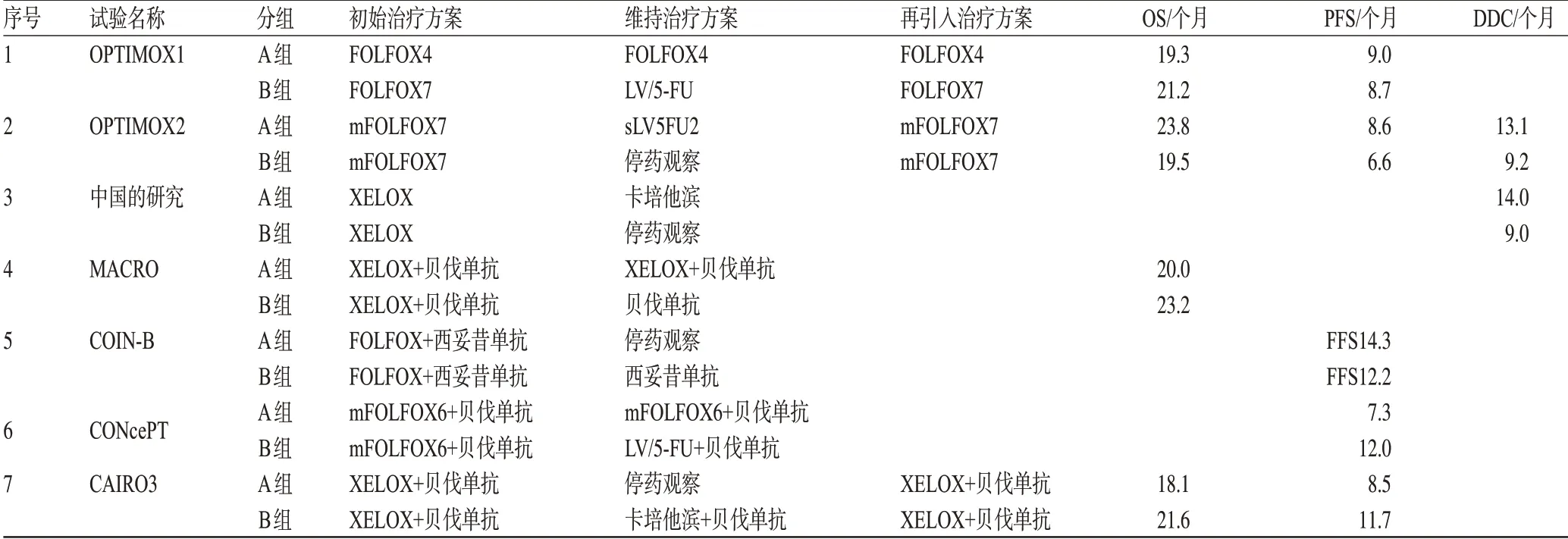
表1 维持治疗与持续治疗或维持治疗与空白治疗对比试验汇总
3 结语
综合几个试验的结果,提示完全空闲的无化疗间歇对患者是不合适的,会影响患者的PFS、甚至OS,而持续的化疗会给患者带来不可耐受的毒副作用。因此,对于没有进展的患者,选择某种形式的维持治疗是更好的选择。
[1] Tournigand C,Cervantes A,Figer A,et al.OPTIMOX1:a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer:a GERCOR study[J].J Clin Oncol,2006,24(3):394-400.
[2] de Gramont A,Buyse M,Abrahantes JC,et al. Reintroduction of oxaliplatin is associated with improved survival in advanced colorectal cancer[J].J Clin Oncol,2007,25(22):3224-3229.
[3] Fortner BV,Schwartzberg LS,Stepanski EJ,et al.Symptom burden for patients with metastatic colorectal cancer treated with first-line FOLFOX or FOLFIRI with and without bevacizumab in the community setting[J].Support Cancer Ther,2007,4(4):233-240.
[4] Grothey A,Sugrue MM,Purdie DM,et al.Bevacizumab beyond first progression is associated with prolonged overall survival in metastatic colorectal cancer:results from a large observational cohort study(BRiTE)[J].J Clin Oncol,2008,26(33):5326-5334.
[5] Kwon HC,Oh SY,Lee S,et al.Bevacizumab plus infusional 5-fluorouracil,leucovorin and irinotecan for advanced colorectal cancer that progressed after oxaliplatin and irinotecan chemotherapy:a pilot study[J].World J Gastroenterol,2007,13(46):6231-6235.
[6] Saltz LB,Clarke S,Diaz-Rubio E,et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer:a randomized phase Ⅲstudy[J].J Clin Oncol,2008,26(12):2013-2019.
[7] Senger DR,Van de Water L,Brown LF,et al. Vascular permeability factor(VPF,VEGF)in tumor biology[J].Cancer Metastasis Rev,1993,12(3/4):303-324.
[8] Diaz-Rubio E,Gomez-Espana A,Massuti B,et al.Firstline XELOX plus bevacizumab followed by XELOX plus bevacizumab or single-agent bevacizumab as maintenance therapy in patients with metastatic colorectal cancer:the phase ⅢMACRO TTD study[J].Oncologist,2012,17(1):15-25.
[9] Chibaudel B,Maindrault-Goebel F,Lledo G,et al.Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study[J].J Clin Oncol,2009,27(34):5727-5733.
[10] Li YH,Luo HY,Wang FH,et al. Phase Ⅱstudy of capecitabine plus oxaliplatin(XELOX)as first-line treatment and followed by maintenance of capecitabine in patients with metastatic colorectal cancer[J].J Cancer Res Clin Oncol,2010,136(4):503-510.
[11] Wasan H,Meade AM,Adams R,et al.Intermittent chemotherapy plus either intermittent or continuous cetuximab for first-line treatment of patients with KRAS wild-type advanced colorectal cancer(COIN-B):a randomised phase 2 trial[J].Lancet Oncol,2014,15(6):631-639.

