人脑胶质瘤中miR-106b~25基因簇表达的研究*
叶敏华 张安玲 王 坤 吴淼经 黄 强 祝新根
miRNA是继小干涉RNA(small interfering RNA,siRNA)之后发现的一种稳定的大小为20~25个核苷酸的非编码小RNA,参与细胞的凋亡、增殖、分化、发育和代谢等生理过程。以往的研究报道,miR-106b~25基因簇成员miR-106b、miR-93、miR-25在多种肿瘤中表达异常[1-6]。故推测miR-106b~25家族可能与胶质瘤形成关系密切。本文采用实时定量PCR和原位杂交的方法对胶质瘤细胞系和组织及组织芯片中miR-106b~25基因簇成员miR-106b、miR-93、miR-25的表达情况进行检测,探讨其表达变化与胶质瘤恶性程度的关系和意义。
1 材料与方法
1.1 对象
1.1.1 细胞系 人脑胶质母细胞瘤细胞系TJ899和TJ905为天津市神经病学研究所神经肿瘤室建立并保存;A172,U251,SNB19,LN229,LN308,U87恶性胶质瘤细胞系购自中国科学院上海细胞生物学研究所细胞库。
1.1.2 临床胶质瘤标本 取自天津医科大学总医院神经外科手术,所有标本均经病理证实,经伦理委员会认可。液氮速冻后保存于-80℃。
1.1.3 组织芯片 组织芯片由陕西超英生物科技有限公司制备。
1.1.4 试剂和仪器 DMEM培养基、胎牛血清及0.25%胰蛋白酶购自美国Hyclone公司;RNA提取和RT-PCR相关试剂:Trizol试剂购自美国Invitrogen公司;AMV试剂盒购自美国Promega公司;dNTP、RNAsin购自日本Takara公司;RT-PCR检测试剂盒Hairpin-itTMmiRNAs qPCR Quantitation Kit购自中国上海吉玛制药技术有限公司。原位杂交探针购自丹麦Exiqon公司,探针序列见表1;原位杂交试剂盒购自武汉博士德生物工程有限公司;DAPI细胞核分析试剂盒购自美国Sigma公司。
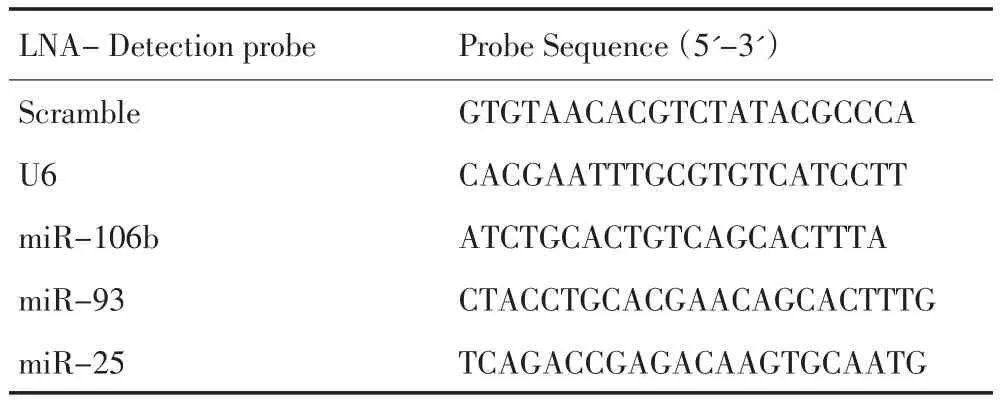
表1 miRNA探针序列(5'-地高辛标记)Table1 Probe Sequence of the miRNA(5'-DIG labeled)
1.2 方法
1.2.1 细胞与组织总RNA的提取 培养细胞及取液氮中保存的胶质瘤组织约40 mg用于总RNA提取,具体步骤参考文献[7]。提取的RNA用Nanodrop仪检测miRNA的质量和浓度(OD260/OD280为1.7~2.0),-80℃保存备用。
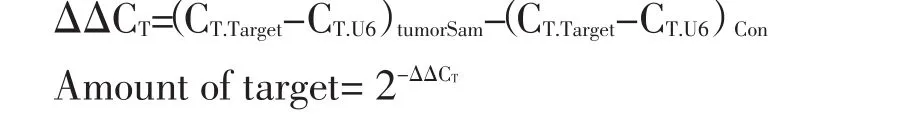
1.2.2 实时定量PCR 按照Hairpin-itTMmiRNAs qPCR Quantitation Ki(t上海吉玛制药技术有限公司)的说明进行逆转录过程。扩增条件为95℃、10 min;95℃、30 s,62℃、30 s,40次循环。RT-PCR过程使用MJ-Real time PCR仪(美国BioRad公司)完成,使用U6作为内参。Opticon 2软件计算ΔC(t)值(2-ΔΔCT的计算方法)表示。以tumorsam表示肿瘤标本或细胞系内的表达,Con表示经U6校正后1倍量的目标基因表达。ΔΔCT的具体计算方法如下:
1.2.3 原位杂交 胶质瘤组织石蜡切片60℃烤片过夜;梯度脱蜡水合;每张切片加上含探针的20 μL杂交液(探针浓度为0.03ng/μL)。常规杂交封片,具体步骤参考文献[7]。荧光倒置显微镜DP-70观察,拍照。
1.3 统计学处理
所用实验数据分析使用SPSS 11.6统计软件包,RT-PCR结果采用ANOVA单因素方差分析,原位杂交结果采用χ2检验,表达相关性采用Pearson相关分析,按照P<0.05作为检验水准。
2 结果
2.1 胶质瘤细胞系中miR-106b~25的表达
提取8种胶质母细胞瘤细胞系和1份正常脑组织标本,RT-PCR检测miRNA的表达。结果表明,以正常脑组织为表达量为基准,miR-106b在LN229、U251和TJ905中表达增高,表达量分别为5.568±5.424、4.324±3.166和 1.337±0.472。miR-93在除SNB19和U87外的所有检测细胞系中表达增高,表达量分别为A172:2.935±2.572;LN229:17.350±7.185;LN308:1.946±1.742;U251:3.600±2.151;TJ899:1.849±0.862;TJ905:4.142±3.139。miR-25在除A172外的所有检测细胞系中均高表达,表达量分别为LN229:27.895±3.147;LN308:1.763±0.933;U251:5.121±3.834;U87:3.103±4.150;TJ899:1.898±1.723;TJ905:3.823±2.118(图1)。检测的细胞系中,仅有U251、LN229和TJ905中3种miRNA同时表达升高。
2.2 新鲜组织中miR-106b~25的表达
收集胶质瘤标本43例,按2007年WHO脑肿瘤分类标准:Ⅰ级3例,Ⅱ级9例,Ⅲ级15例,Ⅳ级16例。其中,男性28例,女性15例,年龄27.00±15.81岁。
所有胶质瘤标本均提取总RNA,逆转录后RT-PCR结果显示,以病理级别Ⅰ级组织的平均表达量基准,随着肿瘤病理级别的升高,3种miRNA在各组中的平均表达量也逐步升高。其中,miR-106b和miR-93各组间的表达差异具有统计学意义(F=4.479,P=0.018和F=3.493,P=0.040)。而miR-25的表达无显著性差异(F=2.766,P=0.075,表2)。
2.3 组织芯片中miR-106b~25的表达
组织芯片共80个点,按照2007年WHO脑肿瘤分类标准:Ⅰ级10例,Ⅱ级13例,Ⅲ级34例,Ⅳ级18例,瘤旁组织5例;其中男性52例,女性28例,年龄40.50±16.65岁。
胶质瘤组织芯片中miR-106b~25的原位杂交结果显示3种miRNA的表达在高级别胶质瘤中的表达量明显高于低级别肿瘤中的表达量(图2)。不同级别间的阳性信号强弱分布存在明显差异,随着肿瘤级别的增高,强阳性信号比例增加,Spearman等级相关分析表明3种miRNA的信号强度分布均与胶质瘤的WHO病理分级呈正相关,在miR-106b、-93、-25中的相关系数分别为 rs=0.617,P<0.001;rs=0.438,P<0.001;rs=0.463,P<0.001(表3)。
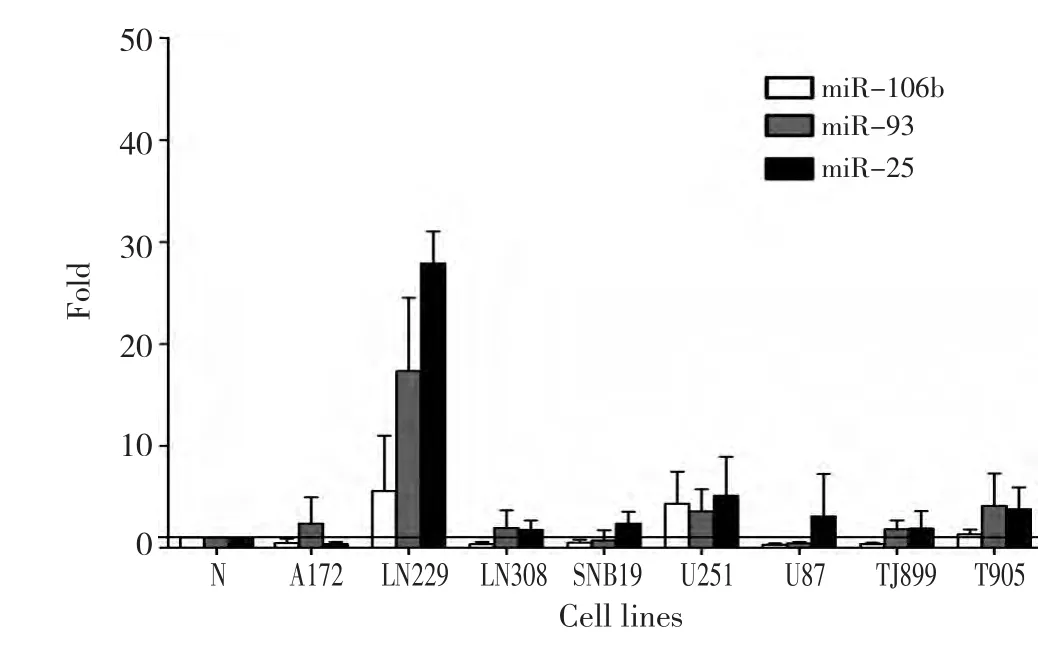
图1 RT-PCR检测体外培养细胞系(8种胶质母细胞瘤细胞系,N:正常脑组织标本)中miR-106b、-93、-25的表达量Figure1 Expression of miR-106b,miR-93,and miR-25 in cell lines(including 8 glioblastoma cell lines,determined via real-time PCR
2.4 胶质瘤细胞系中miR-106b、-93、-25表达的相关性分析
全基因组水平非编码DNA序列研究发现,有相当一部分miRNAs基因在染色体上的分布是非随机的,它们紧密相邻,排列成簇。而针对miRNA表达的研究表明,成簇排列的miRNA基因多会构成一个多顺反子而共同表达。但是,也有miRNA基因簇的成员尽管位于同一个转录体系中,但表达水平却不一致。而处于不同染色体上的旁系同源miRNA基因簇也存的高度表达一致性的情况,提示同源miRNA基因簇可能共享相同的顺式作用元件。本研究对胶质瘤组织标本中3种miRNA的定量表达结果进行相关性分析,发现3种miRNA的表达存在明显相关性,miR-106b与miR-93和miR-25之间的Pearson相关系数分别为0.796和0.652,而miR-93与miR-25之间的相关系数则为0.722,均达到了统计学显著性差异的标准(表4)。这些结果均显示miR-106b~25在胶质瘤细胞系中表达增高,提示其在胶质瘤的发展过程中可能发挥着一定的作用。3种miRNA的定量表达的相关性分析结果表明3种miRNA的表达具有明显相关性,可能存在协同转录。
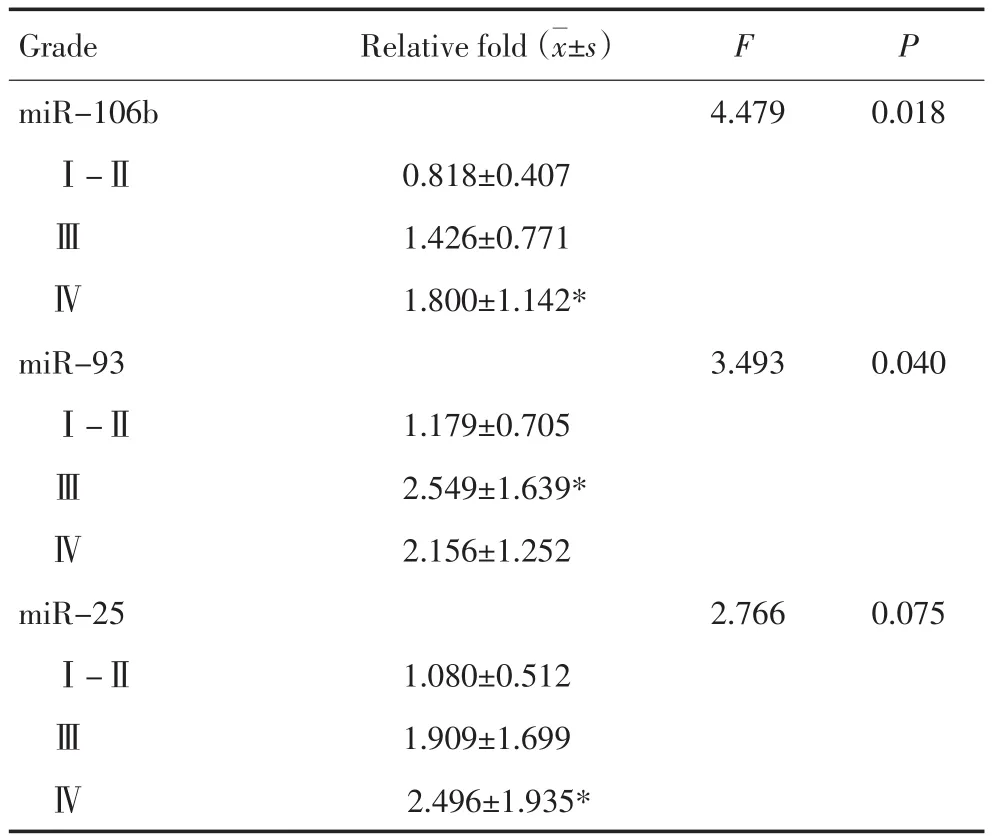
表2 实时定量PCR检测胶质瘤标本中miR-106b~25的表达Table1 2 Expression of miR-106b~25 in glioma samples determined via real-time PCR
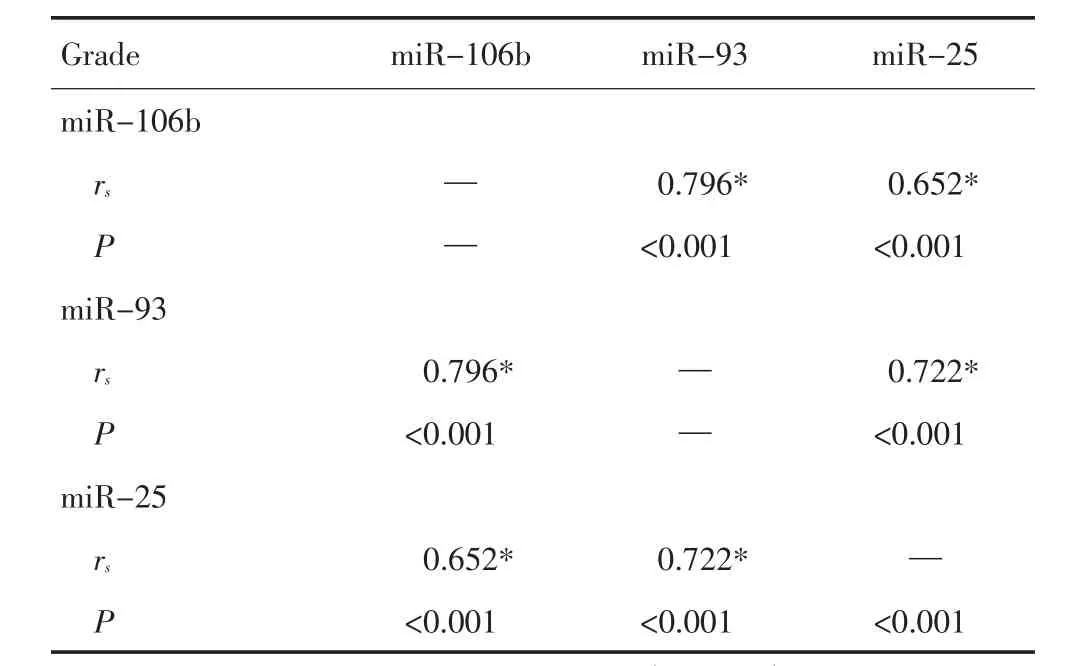
表4 miR-106b、-93、-25表达的相关性分析Table4 Correlation analysis of miR-106b,miR-93,and miR-25
3 讨论
miRNAs是目前为止被研究得最多的ncRNA,它们通过调控mRNA向蛋白的转化过程而参与转录后调节,在多种生物学过程中扮演着重要的角色。事实上,在许多肿瘤中都发现了表达异常的miRNA。目前小样本肿瘤miRNA表达谱筛选出的异常表达的miRNA在肿瘤诊疗中显示出一定程度的作用。如高表达的miR-155与低表达的let-7a-2与肺癌的不良预后相关[1]。而在乳腺癌中,miR-10b、-125b、-145、-21、-155与乳腺癌的激素受体状况、侵袭和转移有直接关系[2]。给负荷肝癌的小鼠注射miR-26a的类似物(mimics)可以减小瘤体积[3]。
肿瘤形成发展过程中,miRNA所起的作用已被众多实验研究证实。通过对下游蛋白表达的调控,miRNA可以发挥原癌或抑癌基因的作用。而肿瘤中异常表达的miRNA还可以作为肿瘤诊断及预后判断的生物标记物,甚至于治疗的靶点[4-6]。
miR-106b~25基因簇染色体定位于7q22.1,由miR-106b、miR-93及 miR-25 3个成员组成,与miR-17~92a-1以及 miR-106a~363为旁系同源物。其3个组成成员分别与另外2个基因簇的对应的成员有着完全相同的“种子序列”:miR-106b与miR-93本身种子序列就完全一致,对应的miR-17、-20a、-20b与它们的种子序列也完全一样,而miR-25则与miR-92a-1、-92a-2、-363为旁系同源,而缺少了另2个基因簇中所含miR-18家族的对应成员。miR-17~92基因簇是第一个被确认的原癌性miRNA[8],miR-106b~25因与其是同源物而引起我们的关注。以往的研究报道,miR-106b~25基因簇的成员在多种肿瘤中都可以观察到不同程度的异常高表达[9-14],而抑制miR-106b~25的3个成员可以抑制肝癌细胞的周期进展,G1期细胞比例增加[15],提高miR-106b~25的表达则可以促进BE食管细胞和肺成纤维细胞的增殖速率[16],表明该簇miRNA同样在肿瘤中起着原癌样的作用。在本研究中采用实时定量PCR和原位杂交的方法分别检测了胶质瘤细胞系、新鲜切除的肿瘤标本和胶质瘤组织芯片中该簇miRNA的表达情况,并发现三者在高级别胶质瘤中比低级别肿瘤中的平均表达量高。而针对miRNA与肿瘤级别的相关性分析表明该簇miRNA的表达量与肿瘤的级别呈正相关,显示出其在胶质瘤的发展过程中可能发挥着一定的作用,需要进一步研究证实。
综上所述,miR-106b~25基因簇的成员在各级别胶质瘤组织中呈不同程度高表达,可能成为胶质瘤级别分类及预后的生物学标记的候选基因。
1 Yanaihara N,Caplen N,Bowman E,et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
2 Mar-Aguilar F,Mendoza-Ramírez JA,Malagón-Santiago I,et al.Serum circulating microRNA profiling for identification of potential breast cancer biomarkers[J].Dis Markers,2013,34(3):163-169.
3 Fu X,Meng Z,Liang W,et al.miR-26a enhances miRNA biogenesis by targeting Lin28B and Zcchc11 to suppress tumor growth and metastasis[J].Oncogene,2013,385.[Epub ahead of print].
4 Guled M,Knuutila S.MicroRNAs and cancer[J].Duodecim,2013,129(16):1661-1669.
5 Raisch J,Darfeuille-Michaud A,Nguyen HT.Role of microRNAs in the immune system,inflammation and cancer[J].World J Gastroenterol,2013,19(20):2985-2996.
6 Fabbri M.MicroRNAs and cancer:towards a personalized medicine[J].Curr Mol Med,2013,13(5):751-756.
7 Li SS,Zhou X,Zhang Q,et al.Abnormal expression of STAT3 and miRNA-21 in oral squamous cell carcinoma[J].Chin J Clin Oncol,2013,40(6):323-327[.李莎莎,周 旋,张 强,等.STAT3与miRNA-21在舌鳞状细胞癌中异常表达的相关性研究[J].中国肿瘤临床,2013,40(6):323-327.]
8 Olive V,Li Q,He L.mir-17-92:a polycistronic oncomir with pleiotropic functions[J].Immunol Rev,2013,253(1):158-166.
9 Liu W,Gong YH,Chao TF,et al.Identification of differentially expressed microRNAs by microarray:a possible role for microRNAs gene in medulloblastomas[J].Chin Med J(Engl),2009,122(20):2405-2411.
10 Hui AB,Lenarduzzi M,Krushel T,et al.Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas[J].Clin Cancer Res,2010,16(4):1129-1139.
11 Wang YX,Zhang XY,Zhang BF,et al.Initial study of microRNA expression profiles of colonic cancer without lymph node metastasis[J].J Dig Dis,2010,11(1):50-54.
12 Kan T,Meltzer SJ.MicroRNAs in Barrett's esophagus and esophageal adenocarcinoma[J].Curr Opin Pharmacol,2009,9(6):727-732.
13 Pichiorri F,Suh SS,Ladetto M,et al.MicroRNAs regulate critical genes associated with multiple myeloma pathogenesis[J].Proc Natl Acad Sci USA,2008,105(35):12885-12890.
14 Peck B,Schulze A.A role for the cancer-associated miR-106b-25 cluster in neuronal stem cells[J].Aging(Albany NY),2011,3(4):329-331.
15 Zhao X,Yang Z,Li G,et al.The role and clinical implications of microRNAs in hepatocellular carcinoma[J].Sci China Life Sci,2012,55(10):906-919.
16 Kan T,Sato F,Ito T,et al.The miR-106b-25 polycistron,activated by genomic amplification,functions as an oncogene by suppressing p21 and Bim[J].Gastroenterology,2009,136(5):1689-1700.
- 中国肿瘤临床的其它文章
- 非小细胞肺癌组织中低表达microRNA表达谱*

