非小细胞肺癌组织中低表达microRNA表达谱*
于筱舟 魏 枫 闫 帆 于文文 任秀宝 李 慧
目前世界范围内,肺癌是最常见的恶性肿瘤之一和第一位肿瘤致死原因,预后较差[1]。肺癌的发生发展是一系列复杂的,多因素多步骤的过程。因此,寻找与癌症发生发展相关的基因和分子,对于肿瘤的诊断和治疗尤为重要。
microRNA(miRNA)是一类长度约为22个核苷酸的非编码RNA。自从1993年发现以来,microRNA在细胞功能调控的各方面发挥了巨大的作用[2-3]。成熟的microRNA通常形成RNA诱导的沉默复合体(miR-RISC),在细胞胞浆中和mRNA的3'非翻译区(3'UTR)互补结合。有时与开放阅读框架(ORF)和5'非翻译区(5'UTR)结合,从而抑制翻译或者使转录产物降解[4-5]。此外,一些microRNA可以在细胞核中与沉默复合体一起结合启动子区域抑制或者激活转录[6-7]。
在人类肿瘤当中,很多microRNA发生表达的上调或者下调,表现出促癌或者抑癌的作用[8]。其中,表达降低的相当一部分microRNA已经被证实具有抑癌的作用。因此低表达microRNA表达谱的测定有助于从分子生物学的角度帮助肿瘤的诊断和治疗。本研究主要通过芯片的方法初步筛选潜在下调的microRNA,进一步用荧光定量PCR的方法验证在肺癌中低表达的microRNA表达谱。此外根据肿瘤的分期进行分层分析,初步探索肿瘤患者所处的不同阶段与microRNA表达水平的联系。
1 材料与方法
1.1 材料
1.1.1 材料获取 选取2012年7月至2012年8月,47例本院手术患者手术切除标本。其中3例用于芯片检测,44例用于荧光定量PCR验证。在47例手术患者中,男性43例,女性4例,中位年龄为61岁,具体临床病理资料(表1)。所有患者均为初治,之间未接受任何抗肿瘤治疗,术后均得到病理证实。手术标本为肿瘤的核心区域和同一患者的正常肺组织区域,经病理观察,无明显炎症、出血和坏死。所有的手术标本在切除后立即存放于液氮保存。所有患者均以签署知情同意书。本实验流程符合伦理委员会要求。
1.1.2 试剂 总RNA提取试剂Trizol microRNA芯片Set v3(life technology),MegaplexTMPool,microRNA 逆转录试剂盒,universal master mixⅡ,microRNA探针(美国生命科技公司)。
1.2 方法
1.2.1 RNA提取和质量控制 在液氮中研磨组织,利用Trizol法提取组织总RNA。利用Thermo Biomate 3紫外可见蛋白核酸分析仪测定RNA样本OD值和浓度。
1.2.2 microRNA芯片检测和分析 利用MegaplexTMPool逆转录生成DNA,程序为16℃,2 min;42℃,1 min;50℃,1 s;85℃,5 min。在7900HT(life technology)型荧光定量PCR仪平台上运行和分析芯片结果。采用DataAssist(V3.01)软件进行结果分析。
1.2.3 荧光定量PCR验证microRNA表达情况 利用microRNA reverse transcription kit逆转录试剂盒和microRNA assay特异性引物逆转录RNA生成cDNA。反应条件为:16℃,30 min;42℃,30 min;85℃,5 min。之后在7500型荧光定量PCR仪系统上按照标准程序进行PCR。条件为:95℃,10 min;95℃,15 s;60℃,1 min;40个循环。选取U6为内参,利用ΔCT相对定量法测定microRNA表达情况。
1.3 统计学方法
应用SPSS 19.0统计软件分析,对于microRNA在肿瘤组织与癌旁正常对照的表达水平比较,数据不符合参数检验条件,采用配对样本的非参数秩和检验。数据符合参数检验的条件,采用对样本t检验。对于microRNA表达水平的分层分析中,采用独立样本的非参数秩和检验。P<0.05为有统计学差异。
2 结果
2.1 RNA提取
本实验采用Trizol法提取组织总RNA。提取后的总RNA用紫外分光光度计定量并且检测OD值。OD260/280范围为1.8~2.0。
2.2 microRNA筛选
RT-PCR原理的芯片结果数据利用DataAssist(V3.01)软件进行分析。发现与正常肺组织相比,有20个microRNA在肺癌组织中显著下调,分别为hsa-miR-1、 hsa-miR-22、 hsa-miR-27a、hsa-miR-27b、 hsa-miR-125a-5p、hsa-miR-125b、hsa-miR-142-5p、 hsa-miR-143、hsa-miR-148a、hsa-miR-148b、 hsa-miR-370、 hsa-miR-373、hsa-miR-381、 hsa-miR-489、 hsa-miR-519a、hsa-miR-376c、 hsa-miR-206、 hsa-miR-380-5p、hsa-miR-223-5p、hsa-miR-520c-3p(图1)。
2.3 microRNA表达水平验证
在44例癌组织和正常肺成对的标本中,利用实时荧光定量PCR进一步测定芯片筛选出的20种microRNA的含量。其中13种microRNA在癌组织中显著低表达,分别是hsa-miR-125a-5p、hsa-miR-143、hsa-miR-519a、 hsa-miR-223-5p、 hsa-miR-1、hsa-miR-520c-3p、 hsa-miR-489、 hsa-miR-27a、hsa-miR-373、 hsa-miR-125b、 hsa-miR-27b、hsa-miR-142-5p、hsa-miR-206(表2)。
2.4 分层分析肿瘤中低表达的microRNA与肿瘤分期和淋巴结转移情况的关系
对于13种在肿瘤中显著低表达的microRNA进行分层分析,有助于探索是否这些microRNA的表达水平和肿瘤患者所处的分期和淋巴结转移情况有着潜在的关联。分析结果发现,hsa-miR-125b不仅与肿瘤的分期相关,而且和肿瘤的淋巴结转移情况也有着显著的一致性。在早期肺癌患者中和淋巴结未见转移的患者中,hsa-miR-125b的表达水平较低(表2~4)。
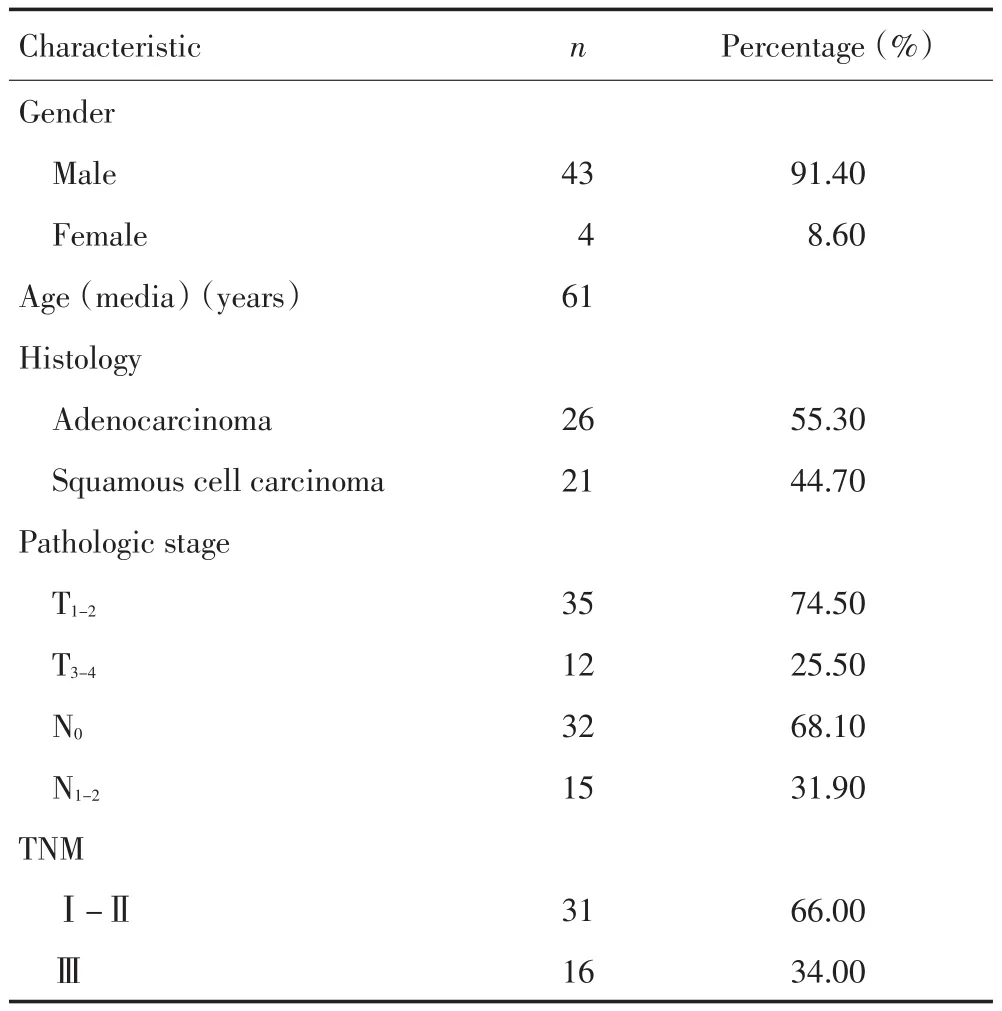
表1 患者临床病理资料Table1 Clinical data of the patients
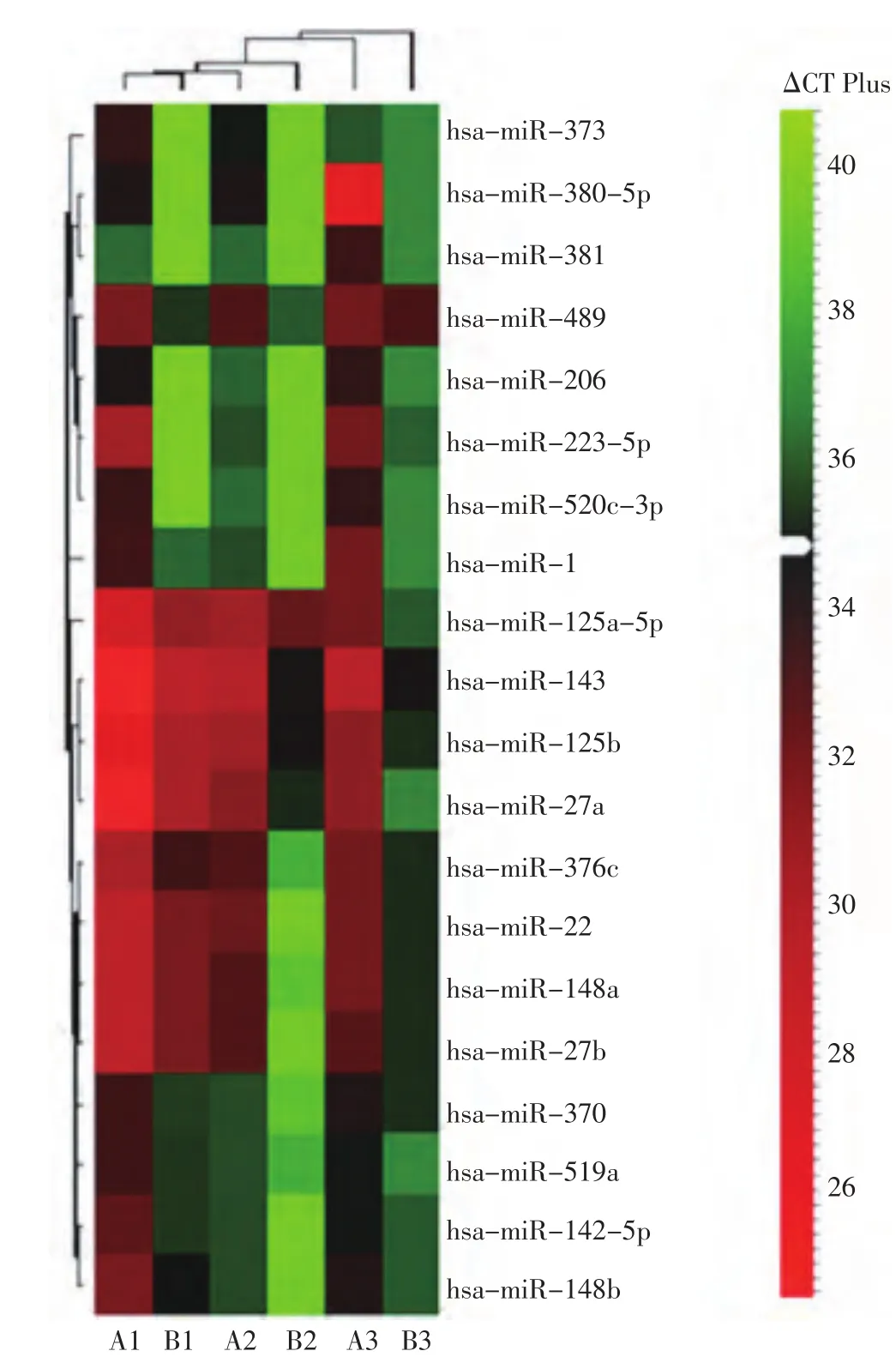
图1 芯片检测肺癌低表达microRNA表达谱Figure1 Microarray test for low expression profiling of microRNA in non-small cell lung cancer
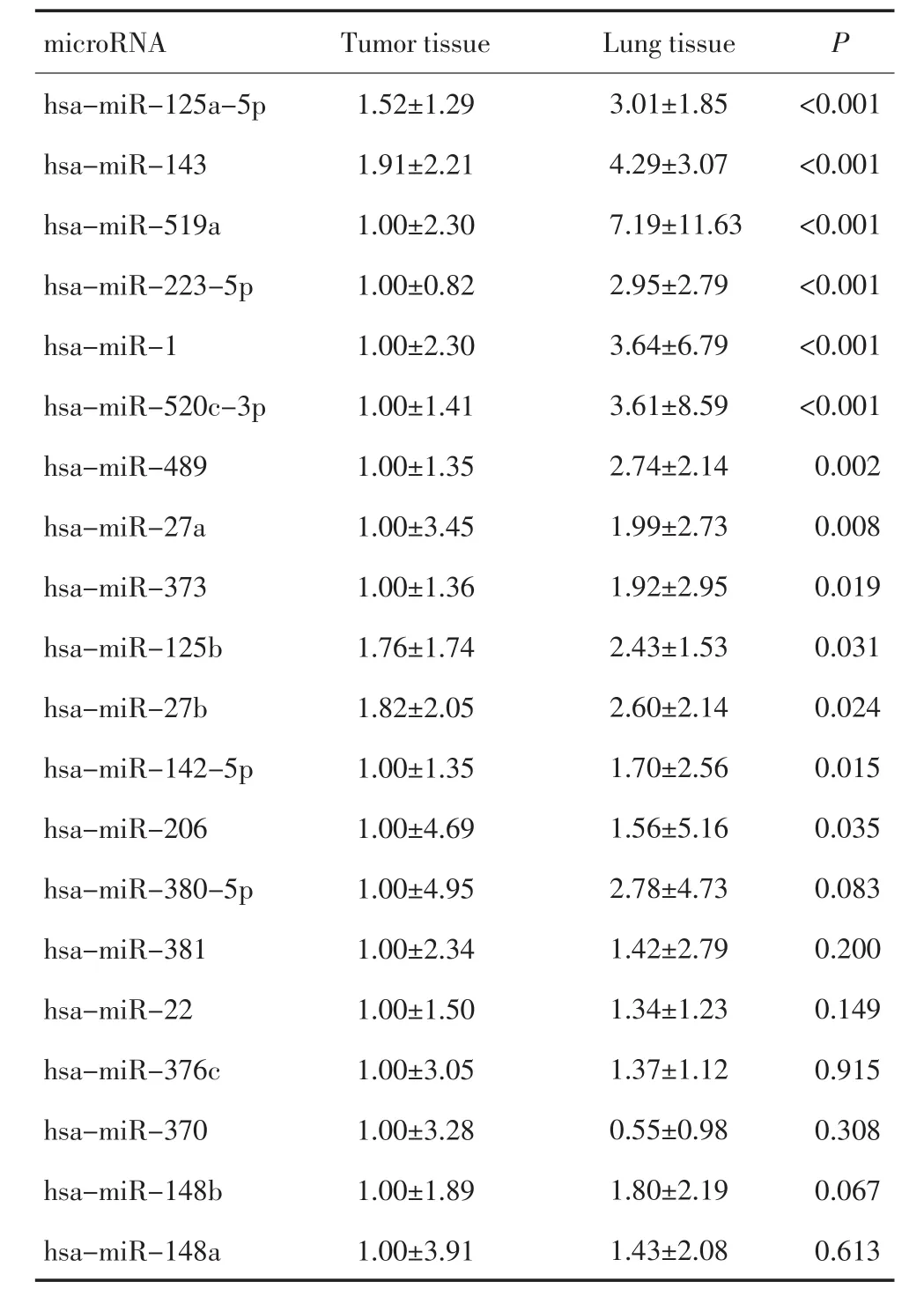
表2 实时荧光PCR验证44例手术标本中microRNA表达情况Table2 Real-time RT-PCR verification of microRNA expression in 44 paired tissues
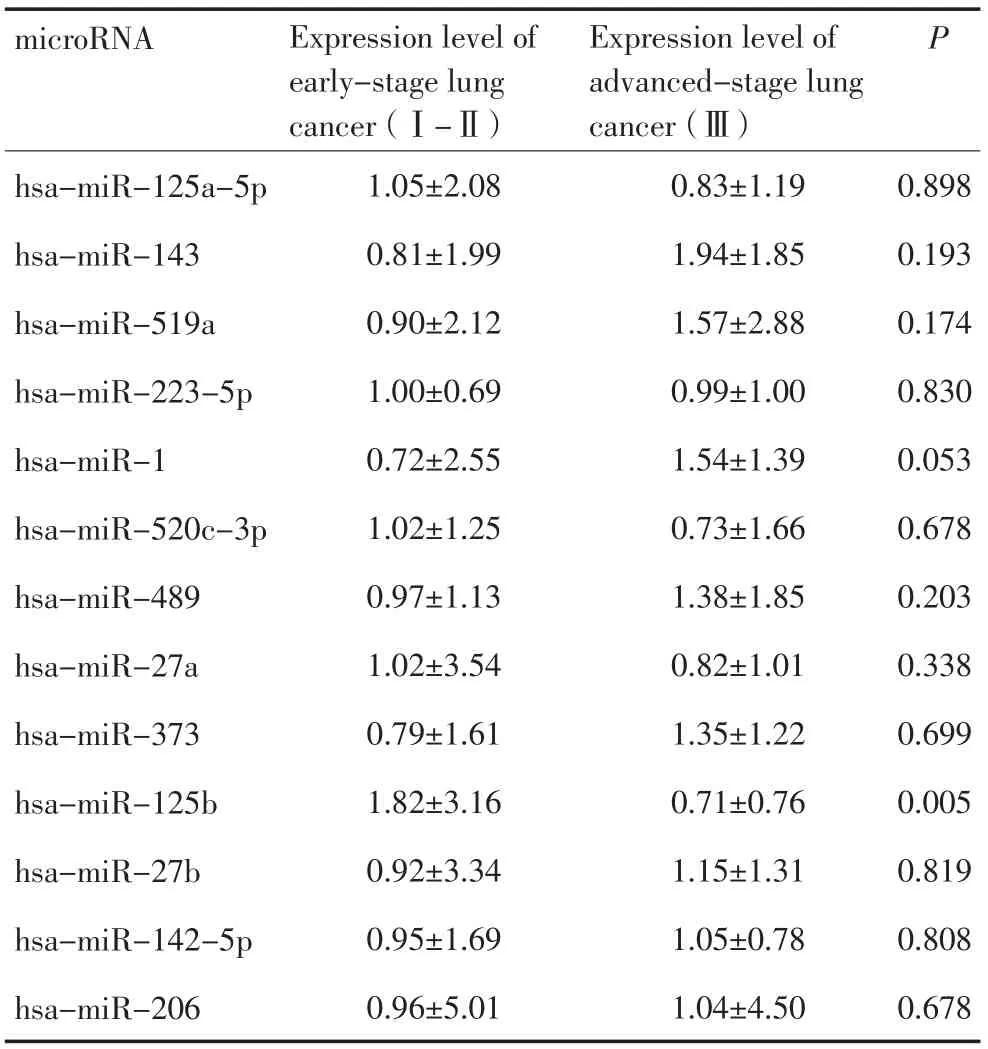
表3 肿瘤中低表达microRNA表达水平和肿瘤分期的关系Table3 Interaction between microRNA expression level and TNM stages
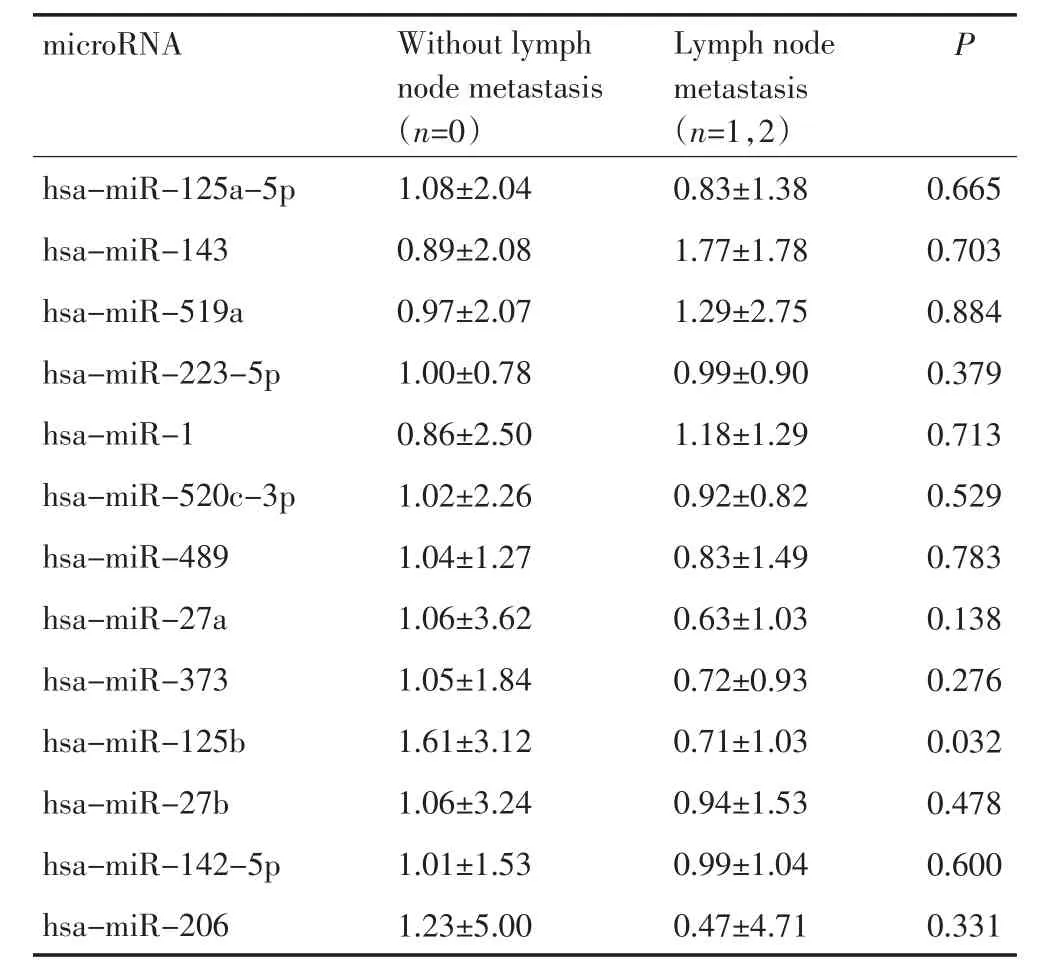
表4 肿瘤中低表达microRNA表达水平和肿瘤淋巴结转移情况的关系Table4 Interaction between microRNA expression level and lymph node metastasis
3 讨论
当前认为microRNA和肿瘤的发生发展,侵袭转移等方面密切相关。很多实验研究发现mcioRNA在肿瘤中会发生上调或者下调,而表达量的改变往往伴随着导致某些功能的改变,这些现象和机制为肿瘤的诊断和治疗提供了新方向。其中在肿瘤microRNA的研究中,目前发现表达量增加的microRNA较多,其中很多表达量上调的microRNA具有增加肿瘤的增殖、转移、免疫耐受、恶性程度及干细胞特性的作用。相比之下,对于下调microRNA的报道相对较少。而低表达的microRNA,很多往往和肿瘤的抑制密切相关。所以对于低表达microRNA表达谱的补充研究,对于肿瘤抑制的机制和肿瘤治疗新策略的发现具有重要的意义。
在本研究中确定显著下调的13种microRNA在其他肿瘤当中也有部分报道,其中microRNA在一些肿瘤当中显著高表达,如hsa-miR-125a-5p在胃癌、食管癌等肿瘤中可以显著高表达[9-10]。hsa-miR-125b在多种肿瘤中显著上调[11]。另外一些microRNA在一些肿瘤中显著下调,如hsa-miR-206也可以在骨肉瘤中下调[12]。hsa-miR-27b 在 口 腔 肿 瘤 中 显 著 下 调[13]。hsa-miR-143在胰腺癌、直结肠癌和鼻咽癌等肿瘤中显著下调,具有抑癌作用[14-16]。hsa-miR-1是当前研究较多的microRNA之一,在多种肿瘤中显著下调并且具有抑癌作用[17]。有些microRNA在肿瘤中的研究同样表现出两面性:如hsa-miR-520c-3p,一方面在纤维肉瘤、乳腺癌中表现出促癌基因的特点[18];另一方面,在肝细胞癌、前列腺癌中抑制肿瘤生长[19]。hsa-miR-489在口腔鳞癌中显著上调,发挥促癌作用,甚至可以成为潜在的预后指标[20],在下咽鳞癌中却显著下调[21],成为一个重要的抑癌microRNA。hsa-miR-27a可以在肝癌等多种癌症中高表达,发挥促癌的作用[22],同样也可以在白血病中下调[23]。hsa-miR-373既可以在肝癌中上调[24],同样可以在直结肠癌中下调[25]。hsa-miR-519a可以在肝癌中下调[26],但是卵巢癌中高表达并且伴随分期进展而表达量进一步升高[27]。目前对于hsa-miR-223-5p 和hsa-miR-142-5p在肿瘤中的研究报道仍然较少。
通常microRNA的表达水平具有不严格的组织,细胞和部位的特异性,也就是说在不同的组织或细胞来源的肿瘤中,同一种肿瘤的瘤组织和外周血标本中,microRNA的表达水平是可以不同甚至相反的。于是,分别对于不同肿瘤和不同类型标本的microRNA表达谱的进行测定,都具有重要意义。尤其非小细胞肺癌的发生和发展与其他肿瘤相比,差异较大,预后又相对不好,因此测定肺癌microRNA的表达谱,对于从分子生物学角度进一步研究非小细胞肺癌有着重要的意义。
我国和亚洲地区的非小细胞肺癌患者的发病情况、病理类型和预后等方面与西方患者有很大区别,如对于靶向药物的反应性。因此测定我国非小细胞肺癌患者的microRNA表达谱对于疾病治疗的探索,寻找预后因素,用药选择的研究,有着非常重要的意义。本研究采用芯片技术储备筛选,之后较大样本进一步验证的方法,测定出13种明显在肺癌中低表达的microRNA,对于microRNA在非小细胞肺癌中的表达下调为前沿报道。此外,初步探索microRNA的表达情况和肿瘤TNM分期和淋巴结分期的关联,对于今后的机制和治疗等方面具有一定意义。
非小细胞肺癌中低表达microRNA表达谱的研究,对于肿瘤诊断的意义和肿瘤耐药性的关系以及肿瘤治疗等方面的研究将是今后工作的重点。
1 Meng J,Xie W,Cao L,et al.shRNA targeting HDGF suppressed cell growth and invasion of squamous cell lung cancer[J].Acta Bioc Biop Sin,2010,42(1):52-57.
2 Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
3 Vrba L,Jensen TJ,Garbe JC,et al.Role for DNA methylation in the regulation of miR-200c and miR-141 expression in normal and cancer cells[J].PLoS One,2010,5(1):e8697.
4 Iorio MV,Croce CM.MicroRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBO Mol Med,2012,4(3):143-159.
5 Lee D,Shin C.MicroRNA-target interactions:new insights from genome-wide approaches[J].Ann N Y Acad Sci,2012,1271:118-128.
6 Zardo G,Ciolfi A,Vian L,et al.Transcriptional targeting by microRNA-polycomb complexes:a novel route in cell fate determination[J].Cell Cycle,2012,11(19):3543-3549.
7 Toscano-Garibay JD,Aquino-Jarquin G.Regulation exerted by miRNAs in the promoter and UTR sequences:MDR1/P-gp expression as a particular case[J].DNA Cell Biol,2012,31(8):1358-1364.
8 Guo X,Chen Y,Xu Z,et al.Prognostic significance of VEGF-C expression in correlation with COX-2,lymphatic microvessel density,and clinicopathologic characteristics in human non-small cell lung cancer[J].Acta Bioc Biop Sin,2009,41(3):217-222.
9 Wu WY,Xue XY,Chen ZJ,et al.Potentially predictive microRNAs of gastric cancer with metastasis to lymph node[J].World J Gastroenterol,2011,17(31):3645-3651.
10 Zhao BS,Liu SG,Wang TY,et al.Screening of microRNA in patients with esophageal cancer at same tumor node metastasis stage with different prognoses[J].Asian Pac J Cancer Prev,2013,14(1):139-143.
11 Wu N,Lin X,Zhao X,et al.MiR-125b acts as an oncogene in glioblastoma cellsand inhibitscellapoptosisthrough p53 and p38MAPK-independent pathways[J].Br J Cancer,2013,109(11):2853-2863.
12 Namlos HM,Meza-Zepeda LA,Baroy T,et al.Modulation of the osteosarcoma expression phenotype by microRNAs[J].PLoS One,2012,7(10):e48086.
13 Lo WY,Wang HJ,Chiu CW,et al.miR-27b-regulated TCTP as a novel plasma biomarker for oral cancer:from quantitative proteomics to post-transcriptional study[J].J Proteomics,2012,77:154-166.
14 Tavano F,di Mola FF,Piepoli A,et al.Changes in miR-143 and miR-21 expression and clinicopathological correlations in pancreatic cancers[J].Pancreas,2012,41(8):1280-1284.
15 Zhang JX,Song W,Chen ZH,et al.Prognostic and predictive value of a microRNA signature in stage II colon cancer:a microRNA expression analysis[J].Lancet Oncol,2013,14(13):1295-1306.
16 Chen HC,Chen GH,Chen YH,et al.MicroRNA deregulation and pathway alterations in nasopharyngeal carcinoma[J].Br J Cancer,2009,100(6):1002-1011.
17 Nohata N,Hanazawa T,Enokida H,et al.microRNA-1/133a and microRNA-206/133b clusters:dysregulation and functional roles in human cancers[J].Oncotarget,2012,3(1):9-21.
18 Huang Q,Gumireddy K,Schrier M,et al.The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis[J].Nat Cell Biol,2008,10(2):202-210.
19 Miao HL,Lei CJ,Qiu ZD,et al.MicroRNA-520c-3p inhibits hepatocellular carcinoma cell proliferation and invasion through induction of cell apoptosis by targeting glypican-3[J].Hepatol Res,2013.[Epub ahead of print].
20 Scapoli L,Palmieri A,Lo Muzio L,et al.MicroRNA expression profiling of oral carcinoma identifies new markers of tumor progression[J].Int J Immunopathol Pharmacol,2010,23(4):1229-1234.
21 Kikkawa N,Hanazawa T,Fujimura L,et al.miR-489 is a tumour-suppressive miRNA target PTPN11 in hypopharyngeal squamous cell carcinoma(HSCC)[J].Br J Cancer,2010,103(6):877-884.22 Wu XJ,Li Y,Liu D,et al.miR-27a as an oncogenic microRNA of hepatitis B virus-related hepatocellular carcinoma[J].Asian Pac J Cancer Prev,2013,14(2):885-889.
23 Scheibner KA,Teaboldt B,Hauer MC,et al.MiR-27a functions as a tumor suppressor in acute leukemia by regulating 14-3-3theta[J].PLoS One,2012,7(12):e50895.
24 Wu N,Liu X,Xu X,et al.MicroRNA-373,a new regulator of protein phosphatase 6,functions as an oncogene in hepatocellular carcinoma[J].FEBS J,2011,278(12):2044-2054.
25 Tanaka T,Arai M,Wu S,et al.Epigenetic silencing of microRNA-373 plays an important role in regulating cell proliferation in colon cancer[J].Oncol Rep,2011,26(5):1329-1335.
26 Wang W,Zhao LJ,Tan YX,et al.Identification of deregulated miRNAs and their targets in hepatitis B virus-associated hepatocellular carcinoma[J].World J Gastroenterol,2012,18(38):5442-5453.
27 Kim TH,Kim YK,Kwon Y,et al.Deregulation of miR-519a,153,and 485-5p and its clinicopathological relevance in ovarian epithelial tumours[J].Histopathology,2010,57(5):734-743.
- 中国肿瘤临床的其它文章
- 人脑胶质瘤中miR-106b~25基因簇表达的研究*

