水处理仿生膜研究进展
曾艳军,张 林,陈欢林
(浙江大学化学工程与生物工程学系,杭州310027)
1 前言
反渗透是目前应用最广泛的水处理膜过程之一,尽管在过去的五十多年里反渗透膜得到了快速的发展,但目前能量效率最高的反渗透装置生产每立方米水仍需要耗能2~4 kW·h,是理论极限值(约为1 kW·h/m3)的2倍作用[1]。因此如何大幅度提高反渗透膜的水通量和截留选择性是反渗透膜研究的一个主要方向。
水分子进出细胞的方式是生命活动中水分代谢的重要部分。20世纪80年代中期,美国科学家彼得·阿格雷发现了细胞膜水通道蛋白,探明了水以高通量与高选择性方式透过细胞膜并非是简单的自由扩散过程,而是通过细胞膜上的一类水通道蛋白完成的。这一发现为制备高水通量分离膜提供了新思路。近年来,随着分子工程学科以及高分辨率分析技术的发展,科学家对生物分子结构与功能有了更深的认识,模拟生物结构的能力也有了提高,因此,水处理仿生膜的研究开始兴起[2]。
2006年在欧洲膜会议上英国威尔士大学的Bowen教授指出在改善水处理膜的水通量与专一选择性上需要借鉴生物膜原理[3]。随后,美国伊利诺伊大学香槟分校的Kumar等也提出了将水通道蛋白嵌入水处理膜中的概念,掀开了水处理仿生膜研究领域的帷幕[4]。目前,水处理仿生膜研究开发工作的报道大部分来自于欧美、新加坡、以色列等水处理技术水平发达的国家和地区。丹麦AQUAPORIN A/S公司则是目前世界上唯一一家致力于水通道蛋白渗透技术研发的公司,所掌握的水通道蛋白渗透技术在国际上处于领先地位。国内,水务行业巨头之一的国中水务公司拟出资1 250万美元与Aquaporin A/S公司成立合资公司,从事中国水处理市场仿生膜的研发和商业化生产。
基于此,本文首先从单个细胞膜出发,介绍与水进出细胞密切相关的磷脂双分子层和水通道蛋白;然后从两个方向阐述水处理仿生膜领域的研究进展:水通道蛋白嵌入式仿生膜与人造水通道仿生膜;最后讨论水处理仿生膜面临的挑战与发展前景。
2 细胞膜与水的渗透
细胞膜基本结构的研究始于20世纪30年代,之后在大量实验现象的基础上以及得益于生物化学学科的快速发展,科学家对细胞膜的基本结构有了比较明确的认识,目前普遍认可的细胞膜基本结构是Singer和Nicolson[5]在静态单位膜模型[6]基础上提出的流动镶嵌模型(fluid mosaic model):细胞膜的骨架由液态流动的磷脂双分子层组成,磷脂的极性部分向外,非极性部分向内,整个膜具有液体流动性。流动镶嵌模型突出了膜的液态流动性和膜上蛋白质分布的不对称性。
2.1 磷脂双分子层
磷脂双分子层是由连续分布的磷脂分子构成的对称薄膜。磷脂分子结构与甘油三酯类似:即每个磷脂分子含有一个甘油分子,该甘油分子的两个羟基分别与两个脂肪酸相结合,第三个羟基则与一分子磷酸基团结合,磷酸基团再与一个碱基结合。与完全疏水的甘油三酯不同的是,磷脂分子的磷酸和胆碱是亲水性的基团,脂肪酸的长链烃基是疏水性的非极性基团,因而属于两性分子[7]。
当众多的磷脂分子位于水溶液表面时,磷脂的亲水性磷酸和胆碱极性基团将通过范德华力与极性的水分子相互吸引,同时磷脂的疏水性脂肪链受到排斥,聚集在一起。根据磷脂分子脂肪链的长度、饱和度和温度等因素,形成脂肪链聚集在疏水核心区域的微团、脂质体、磷脂双层三种不同形式的磷脂分子复合物结构(见图1)。通常在实验室条件下,由于表面张力的原因,利用生物磷脂所能形成的最常见结构是双层磷脂分子紧密排列围绕成环状的脂质体,其中心包含有水溶液。因此,脂质体的实质是环绕成圆形的磷脂分子双层膜构成的小囊泡,本质与细胞的磷脂双层骨架是相同的。由于体外环境磷脂双层不稳定,很难形成,因此目前关于细胞膜磷脂双层结构的研究多以脂质体为对象。
2.2 水通道蛋白
生物的许多基本功能都是通过以膜蛋白为载体的跨膜运输来实现[8],包括细胞内外物质转运、能量交换、信息传递等。这些膜蛋白分子有的是部分镶嵌在磷脂双分子层膜中,有的则贯穿于磷脂双分子层,并可以在膜内自由移动,使细胞膜的功能得以实现。最典型的代表是水的跨膜运输,细胞膜本身的水通量并不大,高的水通量主要依赖于细胞膜上镶嵌的水通道蛋白。
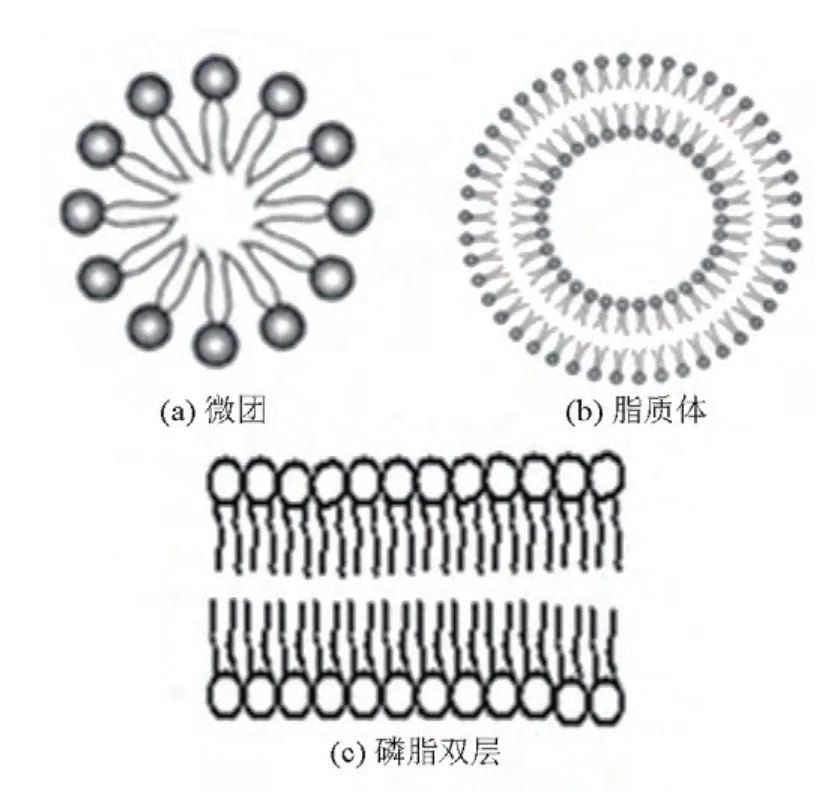
图1 磷脂分子在水溶液中存在的三种结构形式Fig.1 The three structures of phospholipid molecules in the aqueous soution
水通道蛋白是一类高度保守的疏水小分子膜整合蛋白,它的分布广,已在哺乳动物、两栖类、植物、酵母、细菌以及其他多种有机体内被发现。不同亚型水通道蛋白的氨基酸序列及三维结构非常相似,以哺乳动物体内的水通道蛋白分子为例,其分子大小通常在26~34 kDa,氨基酸序列同源性为19%~52%[9]。在各种水通道蛋白中,以AQP1型的分子结构研究最为清楚,它在细胞膜中以四聚体的形式存在,但每一个单体在功能上都作为一个独立的水通道。AQP1单体的基本结构是一条含六个跨膜螺旋的单肽链,这六个跨膜螺旋肽链构成一个不等边四边形,另有两个插入细胞膜的非跨膜螺旋,该螺旋上含有天冬氨酸-脯氨酸-丙氨酸(NPA)的重复串联序列,构成水通道的孔[10]。由于整个肽链的两半呈拓扑学的反相重复结构,因此构成了目前广为接受的水通道蛋白三维结构的“沙漏模型(hour glass model)”[11]。
水通道蛋白的水通量比现有的反渗透膜水通量大很多,主要原因是两者的传输机理不同。反渗透膜被认为是遵循溶解-扩散机理,而水通道蛋白则通过疏水的纳米孔道传输水分子:水分子经过水通道蛋白时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道。水通道蛋白中的孔道最狭窄部分约0.23 nm,由于孔径很小,低于水流连续流动对孔径的最低要求(1.6 nm),窄孔道造成的不连续效应是导致水通道蛋白高水通量的重要原因之一。
水通道蛋白的另一个特点是对水分子具有高度选择性。到目前为止,发现除了少数几种水通道蛋白对甘油等中性小分子溶质具有渗透性外,大部分水通道蛋白严格排斥水分子以外的所有物质,包括结合水分子的氢离子(水合氢离子,H3O+)、甘油和各种离子等。以AQP1为例,水通道蛋白的专一性分离机理目前认为由以下三个机制共同作用所致:首先,AQP1的中心孔道呈哑铃形,狭窄的部分对大多数比其孔径大的水合离子有筛分作用;其次,靠近选择性过滤区域(最狭窄的部分)带正电的精氨酸残基对正电离子具有静电排斥作用;最后,在运输过程中,水分子通过与孔道附近的残基形成氢键使得分子发生重排,打破之前使氢离子在主体水流中快速传输的氢键,从而阻止氢离子的传递[12]。
由上述磷脂双分子层和水通道蛋白的结构及水分子传输机理可见,若能将水通道蛋白引入膜内并稳定存在,或仿制出镶嵌水通道的膜,必将大大提高现有膜的分离水平。
3 水处理仿生膜
目前围绕水处理仿生膜的研究有两个主要方向:一是将水通道蛋白嵌入到磷脂双分子层或人工合成的有机支撑基质中形成生物-有机杂化膜,膜的高通量与高选择性依靠水通道蛋白完成,本文将该方法得到的膜命名为水通道蛋白嵌入式仿生膜;二是模拟水通道蛋白的结构,人工合成具有相似结构的水通道,制备成膜,称之为人造水通道仿生膜。
3.1 水通道蛋白嵌入式仿生膜
虽然将水通道蛋白直接嵌入至有机支撑基质中制得杂化膜,并应用于水处理是最容易实现的仿生膜制备方法。但在细胞膜中,水通道蛋白所处的环境条件温和,水传输动力主要依赖渗透压,而水通道蛋白嵌入式仿生膜则需要在高盐度、高压力、有污染的条件下使用。因此,支撑基质的性质与水通道蛋白活性的保持至关重要。
3.1.1 支撑基质
细胞膜中磷脂双分子层作为基质不仅起到固定水通道蛋白的作用,而且磷脂双分子层中的疏水核心区域与水通道蛋白相接触很好地保持了水通道蛋白的构像与定向,若没有疏水区域对水通道蛋白的保护,蛋白分子间疏水相互作用会导致蛋白质的沉淀与失活。因此,面向工业应用的仿生水处理膜难以采用稳定性差、易降解的磷脂双分子层,需要寻找结构类似,性质稳定的替代材料。
两亲性嵌段共聚物同时含有亲水链段与疏水链段,能够像磷脂双分子层一样自组装成囊泡等构型,因此可以为膜蛋白的嵌入提供磷脂双分子层相似的环境。Meier课题组发表了一系列有关嵌段共聚物应用于水处理仿生膜上的文章,深入探究了两性嵌段共聚物代替磷脂双分子层作为水处理仿生膜基质的优势[13,14],相比于磷脂双分子层,两亲性嵌段共聚物具有以下优势[15]。
1)两亲性嵌段共聚物机械与化学稳定性高。磷脂双分子层在渗透压或者其他压力下,拉伸面积超过5%时就会发生破裂[16];磷脂双分子层容易受到pH、离子强度与温度的影响,受热容易发生相转化,渗透性因pH、离子强度变化大易导致溶质的泄漏。化学合成的嵌段共聚物其热稳定性与韧性均比磷脂好。在Kumar[12]等的研究结果中,聚-2-甲基2-恶唑啉-b-聚-2-甲基硅氧烷-b-聚-2-甲基2-恶唑啉(PMOXA-PDMS-PMOXA)(见图2)嵌段共聚物可以承受pH 2~12的范围,离子强度高达1M。
2)两亲性嵌段共聚物选择面广。通过分子设计等方法,两亲性嵌段共聚物的各种参数,包括链结构、电荷、化学组成、亲疏水基团的比例以及嵌段的数目等均可以调节。因此,可以根据应用对象有针对性地筛选、设计和合成合适的共聚物[6]。此外,不同的嵌段可以赋予膜不同的性能,例如,苏黎世联邦理工学院的Konradi等[17]发现具有生物惰性的PMOXA链段可以防蛋白质吸附,若将其嵌入有机支撑基质,可以提高基质的耐污染性。在过去的十多年,由亲水的PMOXA与疏水的PDMS合成的PMOXA-PDMS-PMOXA嵌段共聚物是最常用的水通道蛋白嵌入式仿生膜基质[16,17],这些研究结果也证实了PMOXA-PDMS-PMOXA嵌段共聚物是水通道蛋白最合适的嵌入基质。虽然PDMS(大于10nm)的疏水带大小与大多数膜蛋白的疏水带(通常为4~5 nm)有差异,但PDMS疏水嵌段的柔软性与多分散性使其快速进入膜蛋白临近的空间,弯曲折叠,从而与膜蛋白的疏水带相匹配。

图2 聚-2-甲基2-恶唑啉-b-聚-2-甲基硅氧烷-b-聚-2-甲基2-恶唑啉的化学结构示意图Fig.2 Chemical structure of PMOXA-PDM S-PMOXA
3.1.2 嵌入式仿生膜研究现状
在种类繁多的水通道蛋白中,由于Aquaporin Z(AqpZ)可以在E.coli中被大量表达,嵌入磷脂双分子层后仍可以保持优良的通量与盐截留率,在不同的溶液条件下可保持良好的活性,因此有大量的AqpZ水通道蛋白基础研究数据[18]。研究人员通过对AqpZ嵌入式仿生膜水通量数据的计算发现AqpZ嵌入式仿生膜的水通量可以高达601 L/(m2·h·bar),比目前最好的商业反渗透膜通量高出了两个数量级。面对如此高的分离性能,若能将嵌有水通道蛋白的仿生膜从目前的平方毫米大小放大至平方厘米级并在高盐度、高压力、有污染的工业条件下保持水通道蛋白的活性,则有望实现工业化应用。为此,研究人员进行了各种尝试。
为了增强嵌有水通道蛋白的聚合物囊泡与支撑层之间的稳定性,防止囊泡在测试与应用过程中被水流冲走,Wang[21]等在聚碳酸酯印迹蚀刻的基质(PCTE)表面附上一层60 nm厚的金层,然后在金层上沉积单层的具有光活性的丙烯酸酯官能团。嵌有AqpZ的聚合物囊泡在临界压力下嵌入上述处理后的支撑层中,再通过紫外引发支撑层上的丙烯酸残基与聚合物囊泡上的丙烯酸甲酯头基交联聚合,制备得到的膜在正渗透模式中对NaCl的截留率为98.8%,通量达到16 L/(m2·h)。新加坡国立大学的Chung[22]等为了解决同样的问题利用二硫共价键将嵌有AqpZ的聚合物囊泡固定在PCTE基质上。上述方法都是利用共价键链接将嵌有AqpZ的聚合物囊泡固定在基质上,需要经过化学反应。Sun[23]等则通过简单的磁力辅助使嵌有AqpZ的聚合物囊泡固定在基质上:首先在囊泡中放入磁性纳米颗粒,然后使用一个磁铁加速囊泡在基质上的沉淀,提高了嵌有AqpZ的囊泡在基质上的吸附量。为了寻找到适合于批量化生产的水通道蛋白仿生膜的制备方法,Zhao[24]等利用界面聚合反应过程的易操作特点,将嵌有AqpZ的磷脂囊泡加入间苯二胺(M-phenylene diamine,MPD)水相溶液中,在聚砜底膜上与均苯三甲酰氯(trimesoyl chloride,TMC)界面聚合得到嵌有AqpZ的反渗透复合膜。该方法过程简单,易于放大,但在膜制备过程中,水通道蛋白的活性容易受到油相有机溶剂的破坏。
针对水通道蛋白嵌入式仿生膜放大应用所面对的在高盐度有污染的工业条件下保持水通道蛋白活性的问题,目前尚未有新的思路。而针对如何消除高压力影响水通道蛋白活性的问题,研究者普遍认为将水通道蛋白嵌入式仿生膜应用于正渗透过程是物得其所。
3.2 人造水通道仿生膜
利用天然水通道蛋白制备仿生膜需要解决水通道蛋白与基质的相容性问题,以及水通道蛋白活性保持的问题,基于水通道蛋白的独特结构人工合成水通道则可以避免上述问题。但水通道蛋白结构复杂,现有的技术手段难以合成复杂的蛋白超级结构,因此模拟水通道蛋白中关键滤器部分更符合目前的技术现状,而且从复杂的自然结构转向相对简单的水通道系统还有助于我们更好地理解水通道蛋白的水传输机理以及结构与性能之间的关系[25]。目前,人造水通道可分为两类:一类是碳纳米管(CNTs),一类是人造有机纳米通道。
3.2.1 碳纳米管
碳纳米管自发现以来[26],其独特的纳米结构和物化性能引起了人们极大关注,利用它的纳米级孔道以及孔道内类似于生物膜呈非极性、憎水的特点而将其用于分离领域是碳纳米管应用研究的重要方向之一。
2001年Nature上首次报道了利用分子模拟的方法研究水分子在CNT内的扩散行为和传输原理[27],随后,很多研究者开始跟进[28,29],得到了水分子在碳纳米管中的传递行为及分布状态,并通过实验验证了模拟结果。研究还发现,水分子在纳米管道内的传递和分布明显区别于在宏观介质内的传递行为[30],其在CNT中的传递速度要比在其他介质孔道中(如沸石等)高出几个数量级,因而具备了作为水通道的条件。
以CNT为水通道的仿生膜制备最大的瓶颈问题之一是CNT会在高分子基质中发生团聚。为了解决这一问题,常用的方法是对碳纳米管进行表面处理或者化学修饰。功能化的碳纳米管可以通过化学键与有机高分子的官能团结合,从而改善碳纳米管与有机高分子基质的相容性,提高CNT与高分子混合基质膜的结构性能。Deng[31]等首先将CNT置于混合强酸和二氯亚矾/l,6-己二醇中进行羧基化和羧酸化改性,再将改性的CNT与二异氰酸异佛乐酮(IPDI)反应,得到IPDI修饰的CNT,该修饰的CNT碳纳米管只需要经过简单的共混就能完全分散在聚氨酯铸膜液中,通过相转化法制备成膜。采用类似的方法,也可以将苯二胺[32],氯苯酸[33]和酞氯[34]引入到CNT上,改善CNT与聚合物基质的相容性。Zhao等[35]以CNT为水通道,通过羧酸化改性CNT分散到MPD水溶液中,与TMC界面聚合反应制备得到含CNT的混合基质反渗透膜,提高了膜的通量和耐污染性能。
上述膜中CNT呈无序排列,纳米孔道难以发挥水通道的作用,因此,若能够实现CNT在膜内的定向排列则有望制得高选择性和高通量的水通道膜。但是,碳纳米管结构十分柔软,采用传统的制膜方法难以将其有序地分散在高分子基质中。Chen[36]等将聚亚胺酯浸入到四氢呋喃溶液中进行溶胀,然后将超声后的CNT混入其中,在溶剂极性的驱动下,CNT能够有序地分散在聚亚胺酯高分子中。Hinds[37]等制备出垂直排列的CNT阵列,然后采用旋涂法将聚苯乙烯填充到CNT阵列的空隙中,制得了CNT定向排列膜,但由于CNT阵列难以制备,该方法的应用价值有限。Zhao等[38]提出了一种热压加撕拉的方法实现了CNT在聚合物支撑膜表面定向排列的方法,但该方法所获得的CNT未贯穿在分离层内,也难以完全发挥其水通道的作用。
由上述介绍可见,以CNT为水通道分离膜的关键是如何更好地发挥CNT的作用,因此提高CNT与聚合物基质间的相容性,易于操作的CNT定向排列方法的设计将是未来的重点研究方向。
3.2.2 人造有机纳米通道
人造有机纳米孔道是通过氢键、静电、π-π相互作用等非共价键作用力组装的有机亚单元,其孔径介于3~10埃,厚度为3~4 nm。人造有机纳米孔道是研究人员模拟水通道蛋白的关键结构设计合成的人造水通道,对于探究水通道结构与传输水机理具有重要意义,目前尚未将其应用于实际的水处理实验中。
2005年Fei等[39]首次通过N,N′-二醋酸溴化咪唑与锌反应合成了基于两亲性络合物的水通道。合成的聚合物单元通过二羧酸根阴离子桥连并组装成螺旋通道,依靠咪唑残基之间π-π的堆叠相互作用以及螺旋内部的氢键作用力维持其形状,两个聚合物分子在螺旋中形成一个整圈,圈与圈之间的距离为6.2埃。X-射线衍射与固态NMR表征发现,在通道中有单层水链且收缩部位的半径接近2.6埃。2007年Peterca等[40]报道了利用外部π-π堆叠相互作用自组装树形缩二氨酸,形成内部孔径为14.5埃的圆柱型螺旋孔,符合纳米通道尺度。将孔道置于单层的磷脂囊泡中,通过光学显微镜与渗透冲击实验证明其具有分离水分子与其他溶质的能力。Le等[41]用尿素丝带合成咪唑化合物,通过内部π-π堆叠以及强疏水相互作用力自组装成管状通道,这些通道通过内部固态水之间强的氢键维持。呈长斜方形的四个咪唑化合物形成了直径为2.6埃的收缩口,非常接近水通道蛋白中最狭窄部位的孔径。2012年Hu等[42]使用酰肼修饰的柱芳烃[5]及其衍生物合成了管状结构的单分子水通道,直径约为6.5埃,将该通道嵌入磷脂囊泡中,通过时间分辨的动态光散射研究了水分子传递行为。通道内部交替的疏水与亲水区域打破了水流线,从而阻碍质子通过孔道。Zhou[43]等通过大量氢键之间的相互作用以及π-π堆叠的相互作用将大环组装成平均孔径为6.5埃的纳米孔道,将该纳米孔道嵌入磷脂膜中所得的膜不仅对离子有很高的选择性而且水通量也很高。
除了上述5种人造有机纳米水通道外,鲜见有其他类型的报道,而且现有的这5种水通道也难以引入到分离膜中,因此设计和合成更具实用价值的纳米水通道将至关重要。
4 结语
水处理仿生膜研究的时间不长,但在很多方向上已经取得了一定进展,并展现了良好的应用前景。随着研究的深入,对水通道蛋白的结构与透水机理也有了更深的认识,因此,仿生膜也正朝着工业化方向发展。
目前,水通道蛋白嵌入式仿生膜面临的两大核心问题是膜的放大制备和应用过程中保持水通道蛋白的活性。总体而言,水通道蛋白嵌入式仿生膜仍处于研究阶段,距离商业化还有很长的路。未来仍需强化水通道蛋白嵌入式仿生膜结构与性能数据的积累,促进对水通道蛋白水传输机理的理解,为研究人员合成人造水通道提供参考。
对于以CNTs为水通道的膜而言,迫切需要解决的两个问题是CNTs在高分子中的分散性与简单易行的CNTs定向方法,若能有效解决这两个问题,该类膜的批量化制备和规模化应用将很容易实现。人造有机纳米水通道是一个非常新的领域,大部分的工作还停留在合成与表征阶段,渗透截留的性能测试研究很少,主要因为对水通道蛋白结构与机理的研究还不够深入,人造有机纳米孔道的合成设计缺少指导性的原则,只能半经验式的模拟水通道蛋白的关键部位。但随着对蛋白分子的结构与功能的进一步认识,对超分子结构与自组装结构设计能力的加强,未来必定能合成具有精密结构的水通道。
总之,水处理仿生膜的优越性能是其他膜过程难以比拟的,仿生膜制备技术上的突破是水处理仿生膜发展的关键。相信在不同领域研究人员的共同努力下,水处理仿生膜一定会实现工业化应用。
[1] Shannon M A,Bohn PW,Elimelech M,et al.Science and technology for water purification in the coming decades[J].Nature,2008,452(7185):301-310.
[2] Bencharit S.History of progress and challenges in structural biology[J].J Pharmacogenom Pharmacoproteomics S,2012,4:2153-0645.
[3] BowenW R.Biomimetic separations—learning from the early development of biological membranes[J].Desalination,2006,199(1):225-227.
[4] Kumar M,Grzelakowski M,Zilles J,et al.Highly permeable polymeric membranes based on the incorporation of the functional water channel protein Aquaporin Z[J].Proceedings of the National Academy of Sciences,2007,104(52):20719-20724.
[5] Singer S J,Nicolson G L.The fluid mosaic model of the structure of cell membranes[J].Science,1972,175(23):720-731.
[6] Robertson JD.The ultrastructure of cell membranes and their derivatives[C]//Biochemical Society Symposium,1958,16:3-43.
[7] 徐国恒.细胞膜的双层磷脂结构与功能术[J].生物学通报,2006,4(9):11-14.
[8] 马文宝,张立志.仿生膜的研究进展[J].化工进展,2008,26(11):1538-1545.
[9] 王 晶,桑建利.水通道蛋白的基本结构与特异性通透机理[J].生物学通报,2011,2:19-21.
[10] 才丽平,赵金茹,林庶茹,等.水通道蛋白研究进展[J].解剖科学进展,2003,9(2):167-170.
[11] Jung JS,Preston G M,Smith B L,et al.Molecular structure of the water channel through aquaporin CHIP.The hourglass model[J].Journal of Biological Chemistry,1994,269(20):14648-14654.
[12] Kumar M,Payne M M,Poust S K,et al.Biomimetic Membranes for Sensor and Separation Applications[M].New York:Springer,2012:43-62.
[13] Taubert A,Napoli A,Meier W.Self-assembly of reactive amphiphilic block copolymers as mimetics for biological membranes[J].Current Opinion in Chemical Biology,2004,8(6):598-603.
[14] Zhang X,Tanner P,Graff A,et al.M im icking the cellmembrane with block copolymer membranes[J].Journal of Polymer Science Part A:Polymer Chem istry,2012,50(12):2293-2318.
[15] Lee JCM,Bermudez H,Discher BM,et al.Preparation,stability,and in vitro performance of vesicles made with diblock copolymers[J].Biotechnology and Bioengineering,2001,73(2):135-145.
[16] Rosoff M.Vesicles,Surfactant Science Series Volumer 62,Chap 9,Needham D,Zhelev D V.The Mechanochem is try of Lipid Vesicles Examined by M icropipette Manipulation Techniques in Vesicles[M].New York:Marcel Dekker,Inc.,1996:373-444.
[17] Konradi R,Pidhatika B,Mühlebach A,et al.Poly-2-methyl-2-oxazoline:A peptide-like polymer for protein-repellent surfaces[J].Langmuir,2008,24(3):613-616.
[18] Nardin C,Meier W.Hybrid materials from amphiphilic block copolymers and membrane proteins[J].Reviews in Molecular Biotechnology,2002,90(1):17-26.
[19] Graff A,Fraysse Ailhas C,Palivan C G,et al.Amphiphilic copolymer membranes promote NADH:Ubiquinone oxidoreductase activity:Towards an electron transfer nanodevice[J].Macromolecular Chemistry and Physics,2010,211(2):229-238.
[20] Borgnia M J,Kozono D,Calamita G,et al.Functional reconstitution and characterization of AqpZ,thewater channel protein[J].Journal of Molecular Biology,1999,291(5):1169-1179.
[21] Wang H,Chung T S,Tong YW,et al.Highly Permeable and selective pore spanning biomimetic membrane embedded with aquaporin Z[J].Small,2012,8(8):1185-1190.
[22] Zhong PS,Chung T S,Jeyaseelan K,etal.Aquaporin-embedded biomimetic membranes for nanofiltration[J].Journal of Membrane Science,2012,407:27-33.
[23] Sun G,Chung T S,Chen N,et al.Highly permeable aquaporin-embedded biomimetic membranes featuring a magnetic-aided approach[J].RSC Advances,2013,3(24):9178-9184.
[24] Zhao Y,Qiu C,Li X,et al.Synthesis of robust and high-performance aquaporin-based biomimetic membranes by interfacial polymerization-membrane preparation and RO performance characterization[J].Journal of Membrane Science,2012,423:422-428.
[25] Barboiu M,Gilles A.From natural to bioassisted and biomimetic artificial water channel systems[J].Accounts of Chemical Research,2013,46(12):2814-2823.
[26] Wang J,Zhu Y,Zhou J,etal.Diameter and helicity effects on static properties of water molecules confined in carbon nanotubes[J].Physical Chemistry Chemical Physics,2004,6(4):829-835.
[27] Hummer G,Rasaiah J C,Noworyta J P.Water conduction through the hydrophobic channel of a carbon nanotube[J].Nature,2001,414(6860):188-190.
[28] Konduri S,Tong H M,Chem path S,et al.Water in single—walled alum inosilieate nanotubes:Diffusion and adsorption Properties[J].The Journal of Physical Chemistry C,2008,112:15367-15374.
[29] Sokhan V P,Nieholson D,Quirke N.Fluid flow in nanoPores:Aeeurate boundary conditions for carbon nanotubes[J].The Journal of Chem ical Physics,2002,117:8531-8539.
[30] Liu Y,Wang Q,Zhang L,et al.Dynamics and density profile of water in nanotubes as one—dimensional fluid[J].Langmuir,2005,21:12025-12030.
[31] Deng J,Zhang X,Wang K,et al.Synthesis and properties of poly(ether urethane)membranes filled with isophorone diisoeyanate—grafted carbon nanotubes[J].Journal Membranes Science,2007,288:261-266.
[32] KalaPPa P,Lee JH,Rashmi J,et al.Effeet of Polyaniline funetionalized carbon nanotubes addition on the Positive temperature coeffieient behavior of carbon black/high—density polyethylene nanocomposites[J].IEEE Trans.Nanoteelmol.,2008,7:223-228.
[33] Jeon IY,Lee H J,ChoiY S,et al.Semimetallic transport in nanoeornposites derived from grafting of linear and hyperbranehed poly(phenylenesulfide)s onto the surface of functionalized multi—walled carbon nanotubes[J].Macromoleeules,2008,41:7423-7432.
[34] Zou W,Du Z J,Liu Y X,et al.Funetionalization of MWNTs using polyaeryloyl chloride and the properties of CNT-epoxy matrix nanocomposites[J].Composites Science and Technology,2008,68:3259-3264.
[35] Zhao H,Qiu S,Wu L,et al.Improving the performance of polyamide reverse osmosis membrane by incorporation of modified multi-walled carbon nanotubes[J].Journal of Membrane Science,2014,450:249-256.
[36] ChenW,Tao X.Self-organizinga lignment of carbon nanotubes in thermoplastic polyurethane[J].Macromolecual Rapid Communications,2005,26:1763-1767.
[37] Hinds B J,ChoPra N,Rantell T,et al.A ligned multi walled carbon nanotube membranes[J].Seience,2004,303:62-65.
[38] Zhao H,Zhou Z,Dong H,et al.A facile method to align carbon nanotubes on polymeric membrane substrate[J].Scientific Reports,2013,3:34-80.
[39] Fei Z,Zhao D,Geldbach T J,et al.A Synthetic zwitterionic water channel:Characterization in the solid state by X-ray crystallography and NMR spectroscopy[J].Angewandte Chemie,2005,117(35):5866-5871.
[40] Kaucher M S,Peterca M,Dulcey A E,et al.Selective transport of water mediated by porous dendritic dipeptides[J].Journal of the American Chemical Society,2007,129(38):11698-11699.
[41] Le Duc Y,M ichau M,Gilles A,etal.Imidazole-quartet water and proton dipolar channels[J].Angewandte Chemie,2011,123(48):11568-11574.
[42] Hu X B,Chen Z,Tang G,et al.Single-molecular artificial trans membrane water channels[J].Journal of the American Chemical Society,2012,134(20):8384-8387.
[43] Zhou X,Liu G,Yamato K,et al.Self-assembling subnanometer pores with unusual mass-transport properties[J].Nature Communications,2012,3:949.

