同种异体异位气管移植物排斥反应的动态变化及SUMO1表达*
何 莹, 马俊磊, 宫念樵, 赵 波
1华中科技大学同济医学院附属同济医院器官移植研究所,卫生部器官移植重点实验室,器官移植教育部重点实验室,武汉 430030
2华中科技大学同济医学院附属同济医院胸外科,武汉 430030
气管移植作为一种简便而有效的研究模型,在探索肺移植病理生理的发生发展中具有重要意义[1]。同种异体气管移植后,移植物将会承受强烈的急性排斥反应,并可能在相对较短的时间内发展为典型的慢性排斥反应[2]。目前对这一动态变化过程认识尚不充分,需要进行系统的研究。近来发现在组织损伤和纤维化的过程中,多伴随小泛素相关修饰物1(small ubiquitin-like modifier 1,SUMO1)的表达,SUMO化修饰没有组织特异性[3],探索其在气管移植物急性和慢性排斥反应中的表达特点,有助于明确气管移植的内在规律,进而建立相应的治疗方法。
1 材料与方法
1.1 实验动物
选用健康雄性8~10周纯系小鼠,体重20~25 g,BALB/c小鼠作为供者,C57BL/6小鼠作为受者,均购自中国科学院上海实验动物中心,饲养在保持恒温(23℃)、恒湿(50%)的清洁动物饲养房,且经过同济医学院医学伦理委员会批准。
1.2 同种异体异位气管移植术
腹腔注射戊巴比妥钠(100mg/kg)麻醉供者小鼠,颈前区备皮,常规消毒后,取颈前正中切口,切开皮肤,钝性分离皮下组织及颈前诸肌群,充分暴露并游离气管。切下全部气管,均匀剪切长度为1cm的气管段,置入冰生理盐水中备用。腹腔注射戊巴比妥钠(60mg/kg)麻醉受者小鼠,颈后背部手术区域备皮及消毒,切开皮肤,皮下游离袋状区域,将待移植的供体气管置入其中,用8-0prolene线将移植气管缝合固定。缝合皮肤,消毒切口。术后小鼠单独隔笼饲养,连续3 d腹腔注射8 000U青霉素,预防感染。
1.3 分组及样本采集
实验动物随机分为2组:①同系移植组,供受者均为C57BL/6小鼠;②同种异体移植组,供者为BALB/c小鼠,受者为C57BL/6小鼠。于术后第7、14、30天处死受体,获取气管移植物。每一时间点每组麻醉后颈椎脱臼处死6只受体。
1.4 组织病理学检查
移植气管取出后置入4%甲醛固定,常规包埋,制成5μm厚切片,行苏木精-伊红染色,光学显微镜下行组织形态学评估。
1.5 SUMO1表达的检测
将石蜡切片置于65℃烘箱中烘片2h,脱蜡至水,用PBS冲洗3次,每次5min,后置于EDTA缓冲液中微波修复,中火至沸后断电,间隔10min低火至沸。自然冷却后PBS洗3次,每次5min。将切片放入3%过氧化氢溶液,室温下孵育10min,以阻断内源性过氧化物酶。用PBS洗3次,每次5 min,甩干后5%BSA封闭20min(封闭电荷)。去除BSA液,每张切片加入50μL稀释的一抗(兔抗小鼠SUMO1)覆盖组织,4℃过夜。PBS洗3次,每次5min。去除PBS液,每张切片加50~100μL相应种属的二抗(抗兔/鼠通用型免疫组化试剂盒REALTMEnVision+/HRP RABBIT/MOUS),4℃孵育50min。PBS洗3次,每次5min。去除PBS液,每张切片加50~100μL新鲜配制DAB溶液,显微镜控制显色。显色完全后,蒸馏水或自来水冲洗,苏木精复染,1%盐酸乙醇分化(1s),自来水冲洗,氨水返蓝,流水冲洗。切片经过梯度乙醇(70%~100%)10min 1个梯度,脱水干燥,二甲苯透明,中性树胶封固,显微镜下拍照。
1.6 移植气管管腔阻塞率的检测
点击CAD软件中的工具-查询-面积,从待测图片中描出气管软骨内表面的轮廓,首尾相连,代表气管内膜线,点击确定,可得软骨环内面积,同样方法描出气管实际剩余内腔面的曲线,首尾相连,点击确定即得实际剩余管腔面积。阻塞程度(%)=(软骨环内面积-实际剩余管腔面积)/软骨环内面积×100%,正常气管该值<3%,每个标本最终数据取其两端和中间断面阻塞程度的均值。
1.7 有核细胞总数和SUMO1阳性细胞数的检测
有核细胞总数反映炎症过程中的浸润细胞数量。每一移植物在两端及正中分别获取组织切片,人工计数每一切片中的有核细胞总数和SUMO1阳性细胞数,计算平均值和SUMO1阳性细胞的百分数(SUMO1阳性细胞占有核细胞总数百分比)。
1.8 统计学分析
2 结果
2.1 移植气管呈现出从急性排斥到慢性排斥的动态变化
术后第7天,同系移植物出现气道上皮轻度损伤,有少数炎性细胞浸润,同种异体移植物气道上皮严重损伤,出现大量的单核细胞浸润;术后第14天,同系移植物气道上皮部分修复,同种异体移植物气道上皮脱落、坏死,开始出现纤维增生并逐渐加重;术后第30天,同系移植物气道上皮充分修复接近正常上皮,同种异体移植物上皮细胞完全消失,黏膜下层肿胀,支气管平滑肌束断裂、萎缩,软骨变形,管腔纤维组织增生明显,导致管腔填塞(图1)。同种异体气管移植物经历了典型的急排期、过渡期和慢排期的动态过程。
移植气管管腔阻塞率呈明显的慢性排斥反应动态变化。术后第7天,同系移植物为(3.3±0.5)%,同种异体移植物为(3.5±0.4)%,两组阻塞程度相近,差异无统计学意义(P>0.05);术后第14天,同系移植物为(3.8±0.6)%,同种异体移植物为(29.8±3.5)%,差异有统计学意义(P<0.01);术后第30天,同系移植物为(4.0±0.3)%,同种异体移植物为(92.5±3.1)%,差异有统计学意义(P<0.01)。
2.2 移植气管SUMO1的表达
同系移植组SUMO1主要在黏膜上皮细胞中表达,但总体表达量相对同种异体移植组明显为低,第7天及第14天仅在部分上皮细胞中表达,第30天全部上皮细胞都有表达。同种异体移植组SUMO1表达明显,第7天气管各层细胞均有表达,尤以黏膜下层中大量浸润的淋巴细胞和巨噬细胞中表达明显;第14天,黏膜下层增厚,SUMO1在浸润的单核细胞和增生的纤维母细胞中均高表达;第30天,黏膜下层增厚更明显,SUMO1表达更为明显(图2)。

图1 同系移植组和同种异体移植组在各时段的病理变化(苏木精-伊红染色,×100)Fig.1 Pathological changes at different time after transplantation in isograft and allograft groups(HE staining,×100)
因同种异体移植组气管上皮细胞脱落,仅对移植物有核细胞总数和SUMO1阳性细胞数进行统计。术后第7天,同系移植组和同种异体移植组每组织切面有核细胞计数分别为(294.5±83.1)、(299.5±64.2),差异无统计学意义(P>0.05),SUMO1阳性细胞数分别为(151.8±59.2)、(237.3±57.2),差异有统计学意义(P<0.05);术后第14天,同系移植组和同种异体移植组有核细胞计数分别为(617.3±70.1)、(774.6±197.4),差异无统计学意义(P>0.05),SUMO1阳性细胞数分别为(220.0±33.9)、(489.0±145.3),差异有统计学意义(P<0.05);术后第30天,同系移植组和同种异体移植组有核细胞计数分别为(276.3±119.0)、(875.0±113.6),差异有统计学意义(P<0.05),SUMO1阳性细胞数分别为(105.6±92.1)、(781.0±73.5),差异有统计学意义(P<0.05)(图3、4)。SUMO1阳性细胞表达率,术后第7天,同系移植物为(37.2±6.3)%,同 种 异 体 移 植 物 为 (80.8±7.0)%,差异有统计学意义(P<0.05);术后第14天,同系移植物为(35.6±2.3)%,同种异体移植物为(62.8±8.6)%,差异有统计学意义(P<0.05);术后第30天,同系移植物为(34.5±2.4)%,同种异体移植物为(89.7±4.1)%,差异有统计学意义(P<0.05)。

图2 同系移植组和同种异体移植组各时段SUMO1的表达(DAB显色,×200)Fig.2 Immunohistochemical analysis of the expression of SUMO1in isograft and allograft groups(DAB,×200)

图3 每组织切面有核细胞计数Fig.3 The number of nucleated cells of each transverse section at different time after transplantation
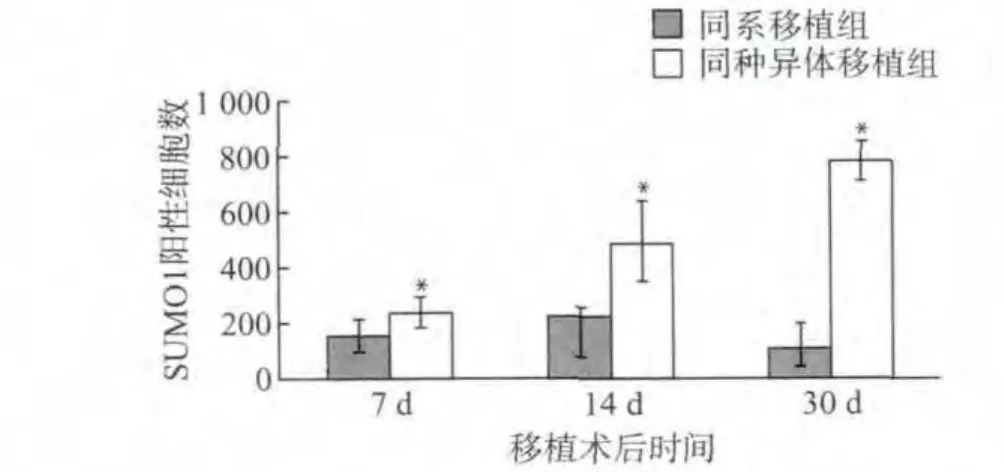
图4 每组织切面SUMO1阳性细胞计数Fig.4 The number of SUMO1-positive cells of each transverse section at different time after transplantation
3 讨论
肺移植后发生强烈的急性排斥和慢性排斥反应,使得移植肺的近期和远期存活很不理想[4]。寻求合适和方便的研究模型,动态观察急性排斥和慢性排斥发生发展的过程,探索其机制,进而寻求相应的治疗措施,对推动肺移植的发展,具有重要的意义。
王林毛等[5]在小鼠同种异体异位气管移植实验中,得出术后7d出现明显的炎性细胞浸润,上皮细胞明显脱落,说明典型的急性排斥反应正在发生,属于急排期;术后14d,仍有明显淋巴细胞浸润,纤维母细胞增生程度逐渐增大,出现早期纤维化表现,属于过渡期;术后30d,上皮细胞完全消失,出现较多纤维细胞,管腔被纤维组织填塞,接近闭塞,属于慢排期。在这一模型中,我们选取3个时间点,可以系统观察气管移植后各种排斥反应的典型改变。小鼠同种异体异位气管移植物经历了典型的急排期、过渡期和慢排期的动态过程,是研究急性排斥和慢性排斥反应动态过程的优良模型。
移植气管上皮的完整性是维持管腔通畅的先决条件。移植气管严重的缺血损伤、急性排斥反复发作和感染等都可以损伤气管上皮,同时气管上皮也是免疫损伤的靶器官,导致上皮细胞严重耗损。机体对损伤组织吸收清除,并以上皮细胞再生或纤维结缔组织增生的方式予以修复,是闭塞性细支气管炎发生的始发环节。从过渡期到慢排期血管内膜增生,管腔狭窄或闭塞,间质缺血缺氧而出现纤维化,是慢性排斥反应共同的病理基础。这种瘢痕性修复的实质是间质成纤维细胞增生、胶原蛋白分泌和细胞外基质合成及降解不平衡,是组织在病理状态下适应环境的一种修复状态。闭塞性细支气管炎作为肺移植术后长期存活者中导致移植肺慢性失功能的最重要的原因,其发生率约为50%[6]。闭塞性细支气管炎的发生机制及对其防治的研究是医学研究的热点之一[7]。本实验在3个时间点对病理变化、气道上皮及管腔阻塞的观察,证实了这一动态的过程。
SUMO是一类高度保守的泛素类蛋白,目前在哺乳动物中发现4种亚型:SUMO1,SUMO2,SUMO3,SUMO4。其中前三者在各种组织中均表达,SUMO1主要修饰生理蛋白,SUMO2/3主要修饰应激蛋白,参与氧化应激、热休克、DNA损伤等过程,而SUMO4则主要在肾脏、淋巴结和脾脏中高表达[8]。作为机体的一种防御系统,SUMO1经相关的酶修饰后,与靶蛋白共价连接,调控靶蛋白在细胞内的分布。其主要的机制是通过阻碍泛素对靶蛋白的共价修饰,提高靶蛋白的稳定性。同时SUMO1还参与细胞核内的一系列生理过程,如核运输、信号传递、细胞周期调控、基因表达调控及DNA的修复。近年研究证实SUMO也参与了 NF-κB及TGF-β1等通路的信号传递,调控细胞的增殖、分化、免疫应答、炎症反应、细胞外基质合成等过程[9]。已发现SUMO化异常与肿瘤、老年痴呆、自身免疫性疾病等的发病密切相关[10-12]。SUMO1可能参与气管移植物急性排斥和闭塞性细支气管炎的发生过程。
在急排期,SUMO1在淋巴细胞和巨噬细胞中高表达,可能参与了天然免疫所诱导的急性排斥反应,使上皮细胞损伤更严重。在过渡期到慢排期,纤维母细胞增生程度逐渐增大,并转化为纤维细胞,SUMO1的表达也逐渐增强,说明其在气管纤维化形成过程中有意义。在术后排斥的全过程中,SUMO1在淋巴细胞、巨噬细胞、成纤维细胞中均高表达,说明SUMO1参与了急性排斥反应和慢性排斥反应,并发挥相应的调节作用。已知SUMO1可以通过修饰 TGF-β1增强 TGF-β1的信号传导[13],也可通过修饰Smad进而增强TGF-β1对纤维化的促进作用[14]。SUMO1大量修饰血小板衍生生长因子(PDGF),增强其的表达,通过不同的信号通路,使效应细胞的基因改变[15]。因此,在移植气管的排斥反应中,SUMO1可能通过修饰TGF-β1和PDGF,促进胶原的大量分泌,减少降解,加剧气管纤维化。通过药物或者基因治疗,降低SUMO1的表达,可能有助于减轻排斥反应,延长移植物的存活,提高气管移植和肺移植的疗效。
[1] Hertz M I,Jessurun J,King M B,et al.Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways[J].Am J Pathol,1993,142(6):1945-1951.
[2] Boehler A,Chamberlain D,Kesten S,et al.Lymphocytic airway infiltration as a precursor to fibrous obliteration in a rat model of bronchiolitis obliterans[J].Transplantation,1997,64(2):311-317.
[3] Müller S,Hoege C,Pyrowolakis G,et al.SUMO,ubiquitin’s mysterious cousin[J].Nat Rev Mol Cell Biol,2001,2(3):202-210.
[4] Vandemheen K L,Aaron S D,Poirier C.Development of a decision aid for adult cystic fibrosis patients considering referral for lung transplantation[J].Prog Transplant,2010,20(1):81-87.
[5] 王林毛,吴凯,高文,等.异位气管移植模型中上皮细胞的增殖与凋亡[J].中国组织工程研究与临床康复,2011,15(18):3288-3292.
[6] Hosenpud J D,Bennett L E,Keck B M,et al.The Registry of the International Society for Heart and Lung Transplantation:fifteenth official report—1998[J].J Heart Lung Transplant,1998,17(7):656-668.
[7] Trulock E P,Christie J D,Edwards L B,et al.Registry of the International Society for Heart and Lung Transplantation:twenty-fourth official adult lung and heart-lung transplantation report—2007[J].J Heart Lung Transplant,2007,26(8):782-795.
[8] LomelíH,Vázquez M.Emerging roles of the SUMO pathway in development[J].Cell Mol Life Sci,2011,68(24):4045-4064.
[9] Hay R T.SUMO:a history of modification[J].Mol Cell,2005,18(1):1-12.
[10] Bettermann K,Benesch M,Weis S,et al.SUMOylation in carcinogenesis[J].Cancer Lett,2012,316(2):113-125.
[11] Subramaniam S,Sixt K M,Barrow R,et al.Rhes,a striatal specific protein,mediates mutant-huntingtin cytotoxicity[J].Science,2009,324(5932):1327-1330.
[12] Onengut-Gumuscu S,Concannon P.Mapping genes for autoimmunity in humans:type 1diabetes as a model[J].Immunol Rev,2002,190:182-194.
[13] Miyazono K,Kamiya Y,Miyazawa K.SUMO amplifies TGF-beta signalling[J].Nat Cell Biol,2008,10(6):635-637.
[14] Imoto S,Ohbayashi N,Ikeda O,et al.Sumoylation of Smad3 stimulates its nuclear export during PIASy-mediated suppression of TGF-beta signaling[J].Biochem Biophys Res Commun,2008,370(2):359-365.
[15] Reigstad L J,Martinez A,Varhaug J E,et al.Nuclear localisation of endogenous SUMO-1-modified PDGF-C in human thyroid tissue and cell lines[J].Exp Cell Res,2006,312(6):782-795.

