“铜与浓硝酸反应”演示实验的改进
吴 鹏
(江苏省镇江第一中学 江苏 镇江 212016)
一、问题的提出
在讲解“硝酸的强氧化性”时,有两个重要的演示实验,即金属铜分别与浓硝酸、稀硝酸反应。 各种版本教材上的演示实验各不相同:比如鲁科版教材中,只是在反应的试管口放蘸有氢氧化钠溶液的棉花,这很难防止气体的散逸。 而在苏教版教材是用分液漏斗加硝酸,不会有气体溢出,生成的气体用排水法收集,一定程度上做到了尾气处理,但在反应过程中无法做到使实验即时停止。 这些设计既不利于学生近距离观察,在实验过程中又总有一定量的氮氧化物排入空气,学生忌惮于它们的毒性,会产生畏惧感,从而导致教材上演示实验的教学功能被削弱。 如何既能让学生看得清楚明白,又能消除氮氧化物的污染,这就要求在实验装置上进行大胆的改进。
二、设计原理
铜与浓硝酸的反应要在一个相对封闭的容器中进行,才可以消除氮氧化物的散逸,既然分液漏斗可以用旋塞控制液体的流量,同样也可以防止气体的泄露,这是我的第一个灵感。 另一个灵感来源于实际操作中,我还发现在反应后可以再次利用分液漏斗做倒吸实验,明显的倒吸现象正是氮氧化物相互转化的生动表现,这让我激动不已。 具体的操作看下面的步骤说明。
三、改进的实验装置及操作步骤
1. 检查装置的气密性及检漏
在分液漏斗的上口塞紧插有铜丝的橡胶塞,打开玻璃旋塞,将下口伸入水中,用手捂住上部,若下口处出现气泡,松开手,形成一段水柱,则说明该分液漏斗气密性良好。 至于检漏,向分液漏斗加水,只要玻璃旋塞处及塞着橡皮塞的上口不漏水即可。
2. 铜丝与浓硝酸接触反应
按照图1 所示, 将分液漏斗放在铁圈中, 关闭玻璃旋塞, 向分液漏斗中加入硝酸,将插入铜丝的橡胶塞塞紧上口。抽动铜丝将其伸入浓硝酸中, 让铜丝接触硝酸发生反应。铜丝与浓硝酸反比较剧烈,立即产生大量红棕色气体,溶液呈蓝绿色。铜丝与浓硝酸反应一段时间后,要将铜丝抽出,脱离酸液,反应立即停止。
3. 倒吸实验
打开玻璃旋塞,用蒸馏水接收反应后的溶液,溶液变成蓝色。 当漏斗中的液体几乎全部放出时,关闭旋塞。 随即将漏斗下口伸入水中(按图2 所示),再次打开旋塞,并轻轻摇晃漏斗, 你就会看到有水倒吸入漏斗中,液面不断上升,红棕色逐渐消失。 待气体颜色褪尽,关闭玻璃旋塞,用注射器刺穿橡胶塞,向分液漏斗内推入空气,气体变为浅红棕色。
4. 尾气处理
将分液漏斗的旋塞关闭, 待课后带入实验室,在通风橱中处理尾气。
四、改进实验的优点
1. 分液漏斗相对封闭, 很好地避免气体的散逸,环保效果十分明显,充分体现绿色化学的思想。
2. 容器容积相对较大,学生看得清清楚楚。 还可以将分液漏斗从铁架台上取下,拿到学生中去近距离观察,学生印象十分深刻。
3. 通过抽动铜丝可以很好地控制反应进程,做到随时停止反应。
4. 倒吸等实验现象强化了学生对氮氧化物转化的认识。
五、说明
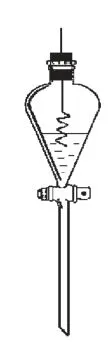
图1

图2
1. 铜与浓硝酸反应时间不宜过长,看到明显的现象即可抽出铜丝。 毕竟是在相对封闭的容器中进行的制气实验,分液漏斗的气压不能过大。
2. 将反应后的溶液放出时动作要快,避免红棕色气体外逸。
3. 在做倒吸实验时,要轻轻摇晃漏斗,但要注意下口必须浸没于水中。

