法洛四联症患儿类视黄酸受体α基因启动子区序列分析
张 婧 马晓静 王慧君 马 端 黄国英,3
·论著·
法洛四联症患儿类视黄酸受体α基因启动子区序列分析
张 婧1马晓静1王慧君1马 端2,3黄国英1,3
目的 对法洛四联症(TOF)患儿类视黄酸受体α(RXRA)基因启动子区序列进行分析,探讨RXRA基因变异与TOF的关联性。方法 采取病例对照研究方法,以2007年4月至2012年12月心导管检查及外科手术证实为TOF患儿为TOF组,以同时期年龄和性别与TOF组匹配的健康儿童为对照组。采集静脉血,提取基因组DNA, PCR扩增RXRA基因转录起始位点(TSS)上游1 417 bp的启动子区序列,扩增产物采用ABI Prism Bigdye系统进行测序。结果 TOF组纳入213例(男135例,女78例),平均年龄1.8岁;对照组纳入500名(男310名,女190名),平均年龄2.5岁。①RXRA基因TSS上游1 191 bp处检测出1个杂合突变,即-1 191A>AG(TSS定为+1);检测出3个新发SNP,即-1 287C>CT、-800C>CA及-760C>CT。②利用http://www.cbrc.jp/research/db/TFSEARCH.html网站进行分析,发现在该4个位点及其附近有多个转录因子结合位点。-1 191A>AG导致新的CpG位点产生,-800C>CA导致原有CpG位点消失。这些新产生的CpG位点的甲基化可能会影响转录因子的结合,从而影响RXRA基因转录水平,进一步导致RXRA蛋白水平的变化。结论 TOF患儿RXRA基因启动子区序列变化可能通过影响RXRA表达水平而导致TOF的发生。
先天性心脏病; 法洛四联症; 类视黄酸受体α; 启动子
心脏圆锥动脉干畸形(CTD)是一类导致发绀和低氧血症的复杂先天性心脏病,包括法洛四联症(TOF)、肺动脉闭锁、大动脉转位、右室双出口和永存动脉干等多种表型。CTD的共同病因是流出道的发育障碍[1]。TOF是最主要的CTD,主要表现为右室流出道部分的发育异常,如主动脉骑跨,室间隔缺损和右室肥厚,是造成婴儿和新生儿死亡最主要的原因之一,因此研究TOF发病机制,对于开展产前筛查、预防和干预具有重要意义。
类视黄酸受体α(retinoid x receptor alpha,RXRA)是视黄酸(retinoid acid, RA)信号通路中的重要受体[2], RA信号通路已被证实在心脏发育的多个环节包括流出道的发育中发挥重要作用[3~6],提示RXRA在心脏发育中的重要作用。此外,RXRA基因敲除小鼠(Rxrα-/-) 可出现CTD表现[7,8]。据此推测,RXRA可能是TOF的候选致病基因。但目前并未见先天性心脏病患者中RXRA基因的相关研究,缺乏有力的人群研究证据。启动子等转录调控区的变异在疾病的发生或基因的功能方面具有重要的意义,是目前多基因病遗传易感基因鉴定和发病机制研究的热点。因此,本研究期望通过TOF患儿RXRA基因启动子区序列分析,探讨其序列变异与TOF的关系,为进一步的遗传学研究提供基础。
1 方法
1.1 TOF组纳入标准 ①复旦大学附属儿科医院(我院)经心导管检查及外科手术证实为TOF的患儿;②智力发育正常;③无明显面容异常;④X线胸片及B超等常规检查均未发现合并其他主要脏器畸形者。
1.2 对照组纳入标准 选取同期在我院儿保门诊进行微量元素检测儿童的剩余血样,年龄、性别与TOF组尽量匹配。样本量与TOF组的比例不低于2∶1。
1.3 伦理学 本研究经我院伦理委员会批准,患儿由其父母签署知情同意书后进入本研究。
1.4 基因测序分析
1.4.1 基因组DNA提取 采集外周静脉血2 mL,采用QIANGEN全血抽提试剂盒提取外周血DNA,使用美国THERMO公司 NANODROP 1000紫外分光光度测试仪测定DNA的A值及DNA浓度值,A260/A280比值在1.7~1.9,于-20℃保存备用。
1.4.2 PCR扩增 通过NCBI数据库获得RXRA基因序列(GeneBank accession no.NT 019501),利用Primer 3在线软件(http://frodo.wi.mit.edu/primer3/) 共设计了3对引物(表1),扩增基因启动子区1 417 bp(-1~-1 417, 转录起始位点定为+1)。
PCR使用TAKARA公司产品,包括HS Taq酶、反应缓冲液、dNTP和提供的相应体系。由于RXRA基因启动子区GC含量高达80%,PCR反应体系中加入了7-deaza-dGTP进行优化,反应条件为95℃预变性5 min,96℃变性10 s、68℃退火、延伸4 min,共40个循环。
表1RXRA基因启动子区PCR扩增引物序列
Tab 1 The PCR primers for the promoter regions ofRXRAgene

PCRprimersSequence(5′⁃3′)LocationPCRproducts/bpP1⁃Fgcccggctctccgcctcctc-461479P1⁃Rgagttgttgcaaaagtcgcccaacaatg+17P2⁃Faaaatagccaccggccacaaagtctg-887481P2⁃Racactcgcgcacacacacacttgc-407P3⁃Fgtcccaagtggaaccaagac-1417692P3⁃Racactttcacgccctaccc-716
Notes PCR primers were designed based on the genomic DNA sequence ofRXRAgene (NT_019501), in which transcription started at the position of +1 of exon 1
1.4.3 基因测序分析 PCR扩增后,经1.5%琼脂凝胶电泳检测目的片段,取1 μL PCR产物进行SAP纯化,纯化产物使用美国ABI公司的Bigdye试剂盒进行测序反应。测序数据由上海佰真公司读取。获得的数据采用Mutation Surveyor Val V3.24 软件,与 GenBank 中的已知序列( 序列号: NT 019501)进行比对,以检出可能存在的单核苷酸多态(SNP)或突变。同时利用在线生物信息预测软件TFSerach(http://www.cbrc.jp/research/db/TFSEARCH.html)对检测出的SNP或者突变进行功能预测;对检测到的SNP利用UCSC Genome Bioinformatics 网站(http://genome.ucsc.edu/)分析是否为已报道的SNP。
1.5 统计学方法 基因型频率和等位基因频率以百分比表示,比较采用χ2检验。采用SPSS 17.0 软件进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2007年4月至2012年12月,TOF组纳入213例(男135例,女78例,男∶女为1.73∶1),平均年龄1.8岁;对照组纳入500名(男310名,女性190名,男∶女为1.63∶1),平均年龄2.5岁。
2.2RXRA基因启动子区测序结果 213例TOF患儿RXRA基因启动子区测序验证如图1A显示,在TSS上游1 191 bp处检测出1例(0.47%)杂合突变,即-1 191A>AG(图1B)。该突变在500例对照组中未发现。在TSS上游1 287、800及760 bp处各检测到1个SNP,即-1 287C>CT、-800C>CA及-760C>CT(图1C~E)。表2显示了,该3个SNP基因型频率和等位基因频率在TOF组和对照组间的差异均无统计学意义(P均>0.05)。在UCSC Genome Bioinformatics 网站并未查询到上述突变及SNP报道。

图1 TOF患儿RXRA基因启动子区序列变异
Fig 1 The discovered sequence variants within the promoter regions ofRXRAgene in TOF patients and controls
Notes A:Schematic representation of the sequence variants within theRXRAgene promoter regions. All the sequence variants were depicted. The transcription started at the position of +1 in the first exon. B(-1 191A>AG), C(-1 287C>CT), D(-800C>CA),E(-760C>CT):Chromatograms of the sequence variants in forward orientations. Top panel showed wild type and bottom panel heterozygous
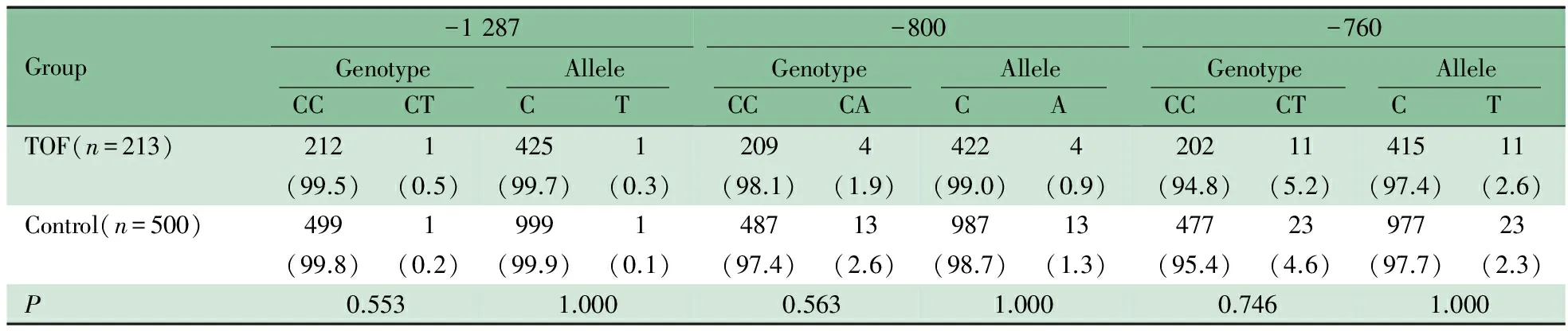
表2 TOF组和对照组RXRA 3个SNP基因型和等位基因频率[n(%)]

在http://www.cbrc.jp/research/db/TFSEARCH.html网站预测,-1 191位点下游92 bp存在转录因子Sp1结合位点,-1 287位点下游2 bp处可结合转录因子GATA-1,-800位点可结合转录因子p300,-760位点可结合转录因子HSF (图2)。
3 讨论
RA是维生素A在体内代谢生物活性形式 , RA在脊椎动物早期胚胎发育中起着重要的作用。过量或缺乏 RA 均可导致心脏发育畸形。RA 能影响早期心肌前体细胞区域化[9]、心管形成[10]以及流出道发育[11,12]等重要过程。但是目前RA 影响心脏发育的具体分子机制尚不明确。RA的生物活性主要通过视黄酸受体(RAR)及类视黄酸受体(RXR)介导靶基因的转录调控来实现[2]。
RAR及RXR均有α、β和 γ 3种亚型,不同亚型的受体在心脏发育中的作用已经明确。小鼠RAR基因的单一突变并不影响心脏的发育[13~15],而Rar/Rxr 敲除小鼠则出现包括大动脉转位的心脏畸形[16]。另外,Rxra-/-小鼠可呈现大范围的流出道畸形[7]及明显的流出道心内膜垫异常[8],而RXRB及RXRG基因敲除小鼠心脏发育正常[17],提示RXRA是视黄酸信号通路介导的心脏发育过程中最重要的受体亚型,RXRA可能在流出道的发育中起重要的调控作用。尽管动物研究提示RXRA基因是TOF的致病候选基因,但目前尚无关于在TOF患者中的相关研究。
启动子是位于结构基因5′端上游的DNA序列,能活化RNA聚合酶,使之与模板DNA准确的结合并具有转录起始的特异性,控制基因表达(转录)的起始时间和表达的程度。启动子对基因转录水平的调控主要表现为顺式作用元件、反式作用因子及RNA聚合酶三者之间的相互协同作用,其实质是蛋白质与DNA、蛋白质与蛋白质之间的相互作用[18]。启动子区序列变异通过影响转录因子等反式作用因子与顺式作用元件的结合,而导致基因转录水平的变化。除了基因水平的变化,多项研究表明,表观遗传学机制如基因启动子区DNA甲基化水平的改变能够调控转录水平。DNA的甲基化多发生在CpG二核苷序列上[19,20]。一般来说,基因启动子区内CpG位点的甲基化可能通过两种方式影响该基因转录活性:一是DNA序列的甲基化改变染色质的结构,影响转录因子与顺式作用元件的结合而发挥调控作用[21];二是甲基CpG结合蛋白(MBPs)结合到甲基化CpG位点,与其他转录复合抑制因子相互作用或招募组蛋白修饰酶改变染色质结构[22]。
本研究在TOF患儿RXRA基因启动子区检测出1例杂合突变-1 191A>AG,该突变会导致新的CpG位点产生。已有研究显示,该多态性位点的甲基化,可以调控基因的表达[23]。另外有研究发现RXRA基因启动子区高甲基化与RXRA的表达抑制有关[24]。同时本文通过在线软件http://www.cbrc.jp/research/db/TFSEARCH.html预测,-1 191位点附近存在转录因子Sp1结合位点(图2)。Sp1能够与多个基因的启动子区内部序列结合,诱导基因激活[25]。Li等[26]研究发现,CIDE-A基因启动子区CpG的甲基化可以通过影响Sp1/Sp2的结合从而调节该基因的转录。因此,推测-1 191A>AG突变导致新的CpG位点的产生,该CpG位点的甲基化使染色质结构凝集,阻碍转录因子Sp1与该位点下游调控序列的结合,从而抑制RXRA表达。这与本课题组前期检测到的TOF患儿RXRAmRNA表达水平较正常对照降低的结果是一致的(另文发表)。
另外,本研究在TOF患儿RXRA基因启动子区检测出3个新发SNP,即-1 287C>CT、-800C>CA及-760C>CT(图1)。与-1 191位点不同,-800位点和-760位点本身即是转录因子结合位点(图2),这2个位点的序列改变可直接影响转录因子对调控序列的识别,从而阻碍相应转录因子的结合,抑制基因的转录。另一方面,-800C>CA改变导致原有CpG位点的消失,也可通过表观遗传学的改变影响RXRA转录。需要指出的是,对-760C>CT和-800C>CA这2个新发SNP的基因型频率和等位基因频率进行统计学分析,发现其基因型频率和等位基因频率在TOF组和对照组的差异无统计学意义。这有可能需要进一步扩大样本量以确认这两个多态性位点是否为TOF的易感性位点。
结论:TOF患儿RXRA基因启动子区序列变异可能通过直接影响转录因子的结合或者通过表观遗传学的机制影响RXRA转录水平,从而在TOF的发生中产生作用。同时,其影响转录的具体机制尚需进一步的功能实验验证。
[1]Nakajima Y. Second lineage of heart forming region provides new understanding of conotruncal heart defects. Congenit Anom (Kyoto), 2010, 50(1):8-14
[2]Mangelsdorf DJ, Borgmeyer U, Heyman RA, et al. Characterization of three RXR genes that mediate the action of 9-cis retinoic acid. Genes Dev,1992 (6): 329-344
[3]Lammer E, Chen D, Hoar R, et al. Retinoic acid embryopathy. New Engl J Med, 1985, 313(14):837-841
[4]Pexieder T, Blanc O, Pelouch V, et al. Late fetal development of retinoic acid induced transposition of the great arteries. In Clark MR, Takas A, edition Developmental Mechanisms of Heart Disease. NY: Futura Publishing Company.1995, 297-307
[5]Taylor IM, Wiley MJ, Agur A. Retinoic acid-induced heart malformations in the hamster. Teratology, 1980, 21(2): 193-197
[6]Sucov HM, Dyson E, Gumeringer CL, et al. RXRa mutant mice establish a genetic basis for vitamin A signaling in heart morphogenesis. Genes Dev, 1994, 8(9): 1007-1018
[7]Gruber PJ, Kubalak SW, Pexieder T, et al. RXRα deficiency confers genetic susceptibility for aortic sac, conotruncal, atrioventricular cushion, and ventricular muscle defects in mice. J Clin Invest,1996, 98(6):1332-1343
[8]Kubalak SW, Hutson DR, Scott KK, et al. Elevated transforming growth factor beta2 enhances apoptosis and contributes to abnormal outflow tract and aortic sac development in retinoic X receptor alpha knockout embryos. Development, 2002, 129(3):733-746
[9]Keegan BR, Feldman JL , Begemann G, et al. Retinoic acid signaling restricts the cardiac progenitor pool. Science, 2005, 307 (5707): 247-249
[10]Collop AH, Broomfield JA, Chandraratna RA, et al. Retinoic acid signaling is essential for formation of the heart tube in Xenopus. Dev Biol, 2006, 291 (1): 96-109
[11]Cipollone D, Amati F, Carsetti R, et al. A multiple retinoic acid antagonist induces conotruncal anomalies, including transposition of the great arteries, in mice. Cardiovasc Pathol, 2006, 15 (4):194 - 202
[12]Ratajska A, Zlotorowicz R, Blazejczyk M , et al. Coronary artery embryogenesis in cardiac defects induced by retinoic acid in mice. Birth Defects Res A Clin Mol Teratol, 2005, 73 (12): 966-979
[13]Li E, Sucov HM, Lee KF, et al. Normal development and growth of mice carrying a targeted disruption of the alpha 1 retinoic acid receptor gene. Proc Natl Acad Sci USA, 1993, 90(4):1590-1594
[14]Lohnes D, Kastner P, Dierich A, et al. Function of retinoic acid receptor gamma in the mouse.Cell, 1993, 73(4):643-658
[15]Luo J, Pasceri P, Conlon RA, et al. Mice lacking all isoforms of retinoic acid receptor beta develop normally and are susceptible to the teratogenic effects of retinoic acid. Mech Dev,1995, 53(1):61-71
[16]Kastner P, Grondona JM, Mark M, et al. Genetic-analysis of RXR-alpha, developmental function-convergence of RXR and RAR signaling pathways in heart and eye morphogenesis. Cell, 78(6):987-1003
[17]Krezel W, Dupe V, Mark M, et al. RXR gamma null mice are apparently normal and compound RXR alpha t/-/RXR beta -/-/RXR gamma -/- mutant mice are viable. Proc Natl Acad Sci USA,1996, 93(17):9010-9014
[18]Pedersen AG, Baldi P, Chauvin Y, et al. The biology of eukaryotic promoter prediction- a review. Comput Chem, 1999, 23(3-4):191-207
[19]Suzuki MM, Bird A. DNA methylation landscapes: provocative insights from epigenomics. Nature Rev Genet, 2008, 9(6):465-476
[20]Bird AP. CpG-rich is lands and the function of DNA methylation.Nature, 1986, 321:209-213
[21]Bird AP, Wolffe AP. Methylation-induced repression-belts, braces, and chromatin. Cell, 1999, 99(5): 451-454
[22]Feng Q, Zhang Y. The MeCP1 complex represses transcription through preferential binding, remodeling, and deacetylating methylated nucleosomes. Genes Dev, 2001, 15(7):827-832
[23]Abdolmaleky HM, Yaqubi S, Papageorgis P, et al. Epigenetic dysregulation of HTR2A in the brain of patients with schizophrenia and bipolar disorder. Schizophr Res, 2011, 129(2-3): 183-190
[24]Volate SR, Muga SJ, Issa AY, et al. Epigenetic modulation of the retinoid X receptor alpha by green tea in the azoxymethane-Apc Min/+ mouse model of intestinal cancer. Mol Carcinog, 2009, 48(10):920-933
[25]Opitz OG,Rustgi AK.Interaction between Spl and cell cycle regulatory proteins is important in transactivation of a differentiation-related gene.Cancer Res,2000,60(11):2825-2830
[26]Li D, Da L, Tang H, et al. CpG methylation plays a vital role in determing tissue- and cell-specific expression of the human cell-death-inducing DEF45-like effector A gene through the regulation of Sp1/Sp3 binding. Nucleic Acids Res, 2008,36(1): 330-341
Genetic analysis of the RXRA gene promoter in tetralogy of Fallot patients
ZHANGJing1,MAXiao-jing1,WANGHui-jun1,MADuan2,3,HUANGGuo-ying1,3
(1Children′sHospital,FudanUniversity,Shanghai201102,China; 2KeyLaboratoryofMolecularMedicine,MinistryofEducation,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China; 3ResearchCenterforBirthDefects,FudanUniversity,Shanghai200032,China)
HUANG Guo-ying, E-mail:gyhuang@shmu.edu.cn
ObjectiveCongenital heart disease (CHD) is the most common birth defect in humans. The genetic causes for CHD remain largely unknown. Tetralogy of Fallot (TOF) is one major component of conotruncal defects (CTD), a complex CHD induced by abnormal development of the outflow tract. Retinoid X receptor alpha (RXRA), a ligand-dependent transcript factor, plays a critical role in multiple aspects of cardiogenesis including the development of outflow tract (OFT). Taken together,RXRAmay be a potential candidate gene of TOF. To date,RXRAgene promoter region has not been analyzed and reported in TOF patients. We hypothesized that the sequence variants withinRXRAgene promoter region may change RXRA levels and the development of TOF. In this study, the promoter regions ofRXRAgene were genetically analyzed.MethodsCase group included DNA samples from patients with TOF, which had been confirmed by cardiac catheterization and surgery. Control group consisted of DNA samples from randomly selected healthy children. Genomic DNA was extracted from peripheral blood. PCR was used to amplify the 1 417 bp promoter region from genomic DNA. PCR products were sequenced by ABI Prism Bigdye system.ResultsThe promoter regions ofRXRAgene were genetically analyzed in 213 TOF patients and 500 healthy controls. One novel heterozygous mutation, -1 191A>AG (according to the transcription start site), was found in one TOF patients, but in none of controls. Three novel single-nucleotide polymorphisms, -1287C>CT, -800C>CA and -760C>CT were found in both TOF patients and controls. There were no statistically significant changes in the genotype and allele frequencies of the three SNPs between TOF patients and control group (P>0.05). Several transcription factor binding sites were found within the region containing these single-nucleotide variations by searching http://www.cbrc.jp/research/db/TFSEARCH.html. ConclusionsThe A at position -1 191 following C, and C at position -800 was followed by G, thus these single-nucleotide variations provided additional candidate cytosines (CpG) for methylation that may enhance the level of gene expression.The sequence variants withinRXRAgene promoter may contribute to the TOF etiology by altering the expression levels ofRXRAgene.
Congenital heart disease; Tetralogy of Fallot; Retinoid X receptor alpha; Promoter
国家自然科学基金重点项目:30930096;上海市科学技术委员会科研计划连续资助项目:11JC1401400
1 复旦大学附属儿科医院 上海,201102; 2 复旦大学上海医学院分子医学重点实验室 上海, 200032; 3 复旦大学出生缺陷研究中心 上海, 200032
黄国英,E-mail:gyhuang@shmu.edu.cn
10.3969/j.issn.1673-5501.2013.02.005
2013-02-26
2013-03-11)
丁俊杰)

