HIV/AIDS患者艾滋病相关支原体感染及其对免疫功能影响分析
胡一珉,濮韵秋,张文懿,和琳,吴建茹,还锡萍,徐金水,王蓓
(1.东南大学公共卫生学院,江苏南京 210009;2.江苏省疾病预防控制中心,江苏 南京 210009)
艾滋病(acquired immune deficiency syndrome,AIDS)是艾滋病病毒(human immunodeficiency virus,HIV)侵犯人的免疫系统,造成以免疫功能下降和各种感染为主要特征的一组综合征[1]。其机会性感染的病原体种类繁多,可侵犯呼吸系统、消化系统、神经系统。生殖支原体(mycoplasma genitalium,Mg)、发酵支原体(mycoplasma fermentans,Mf)和梨支原体(mycoplasma pirum,Mpi)自发现以来,一直被认为是艾滋病病程进展的协同因子,称为“艾滋相关支原体”。作者以江苏省部分男性HIV-1感染者为研究对象,检测其艾滋病相关支原体感染状况,探索支原体的感染在自然病程中对不同序列特征患者免疫功能的影响。
1 对象与方法
1.1 研究对象
以江苏省疾病预防控制中心确认的100例男性HIV-1感染者为研究对象,由调查对象自己填写调查表,调查员仅负责解释说明。文盲或年幼患者由调查员询问研究对象或其父母,代为填写。采用国家统一的问卷进行调查,主要内容包括:出生年月、民族、住址、婚姻状况、职业、文化程度、感染途径等。
1.2 标本采集
采集首段尿(first void urine,FVU)用于支原体检测。用尿杯按要求收集与上次排尿间隔2 h以上的首段尿10~20 ml,转入尿液标本保存管,常温保存。编号登记(包括地区、姓名等信息)后,送实验室检测Mg、Mf和 Mpi。
采集患者全血5~6 ml于EDTA-K3抗凝管,并于4 h内送至江苏省疾病预防控制中心实验室,用于CD4+T细胞计数,随后离心分离血浆,进行IL-2、IL-4、IL-6、IL-10、TNF-α 及 IFN-γ 细胞因子检测及 HIV RNA提取。
1.3 支原体检测
1.3.1 标本处理及试剂准备 将送回实验室的尿液标本置入离心管中,3 500 r·min-1离心15 min,弃去上层尿液。用1 ml生理盐水溶解沉淀,吹打混匀,用于 PCR 检测 Mg、Mf和Mpi。
裂解液配制:KCl溶液(1 mol·L-1)5.0 ml,MgCl2溶液(1 mol·L-1)0.25 ml,Tris-HCl缓冲液(1 mol·L-1,pH 8.0)1.5 ml,20%Tween-20 2.5 ml,用双蒸水定容至100 ml。用前裂解液与蛋白酶 K(200 μg·ml-1)以50∶2的体积混合。
1.3.2 Mg、Mf和Mpi的检测 (1)将-20℃冰箱保存的标本取出解冻,振荡混匀标本,吸取400 μl置于0.5 ml离心管内,15 000r·min-1离心 5 min,吸弃上清液。加裂解液30 μl,振荡混匀后置入55℃水浴1 h,再置入95℃保温5 min。10 000 r·min-1离心1 min,上清液即为PCR扩增用模版液。在提取模板及PCR反应过程中需设置阳性和阴性对照。
3种支原体的特异性DNA片段引物序列见表1。

表1 Mg、Mf和Mpi的特异性DNA片段引物Tab 1 The specific primers for Mg,Mf and Mpi detection
Mg、Mpi的检测采用套式PCR方法,第1次PCR反应体系为:正、反向引物各 0.5 μl,dNTP(10 mmol·L-1)0.4 μl,10 × PCR Buffer 2 μl,MgCl2(25 mmol·L-1)1.2 μl,Taq 酶(5 U·μl-1)0.3 μl,模板 5 μl,加双蒸水至总体系20 μl;第2次PCR反应体系为:正、反向引物各 1.25 μl,dNTP(10 mmol·L-1)1.0 μl,10 × PCR Buffer 5 μl,MgCl2(25 mmol·L-1)3 μl,Taq酶(5 U·μl-1)0.5 μl,模板(第 1 次扩增产物)1 μl,加双蒸水至总体系50 μl。Mf采用普通PCR方法检测,反应体系为:正、反向引物各 1.25 μl,dNTP(10 mmol·L-1)1.0 μl,10 × PCR Buffer 5 μl,MgCl2(25 mmol·L-1)4 μl,Taq 酶(5 U·μl-1)0.5 μl,模板 5 μl,加双蒸水至总体系 50 μl。
PCR扩增条件:Mg、Mpi的两次PCR扩增热循环参数均为94℃预变性2 min,然后按94℃30 s→55℃30 s→72℃40 s共循环40个周期,最后1个循环72℃延长至5 min。Mf PCR扩增热循环参数为94℃预变性2 min,然后按94℃30 s→55℃30 s→72℃30 s共循环40个周期,最后1个循环72℃延长5 min。
电压80 V、40 min,在全自动电泳成像分析仪中观察电泳结果。
1.4 CD4+T细胞计数
TruCOUNT绝对计数管中准确加入20 μl MultiTEST四色试剂和50 μl全血,充分混匀,室温阴暗处放置15 min;加入450 μl FACS溶血液,充分混匀,室温阴暗处放置30 min;向另外3个TruCOUNT绝对计数管中分别加入50 μl TruCOUNT Control Beads(low/medium/high)作为绝对计数质控;运行MultiSET程序上机检测。
1.5 细胞因子检测
采用eBioscience公司ELISA试剂盒进行检测。
1.6 统计学处理
所有检测及调查结果均录入Excel数据库,经审核后导入SPSS 11.5形成分析数据库进行统计分析。分类资料用频数和百分比进行统计描述,用卡方检验行统计分析,计数资料采用两独立样本非参数检验分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 HIV/AIDS患者的基本情况
100例病例收集范围涉及苏北、苏南、苏中地区,其中苏南40例,苏中38例,苏北地区22例。年龄18~70岁,平均(36.7±10.1)岁。感染途径包括异性传播、同性传播、注射毒品及输血/血制品传播,以性传播途径居多。大多数为江苏省本地人口,占87.7%。
2.2 HIV/AIDS患者支原体检出情况
检测结果显示,3种艾滋病相关支原体Mg、Mf、Mpi的感染率分别为22.0%、7.0%、23.0%。100例男性HIV/AIDS患者中由性传播途径感染者占74.0%,性传播途径感染HIV者与其他途径感染者之间的各种支原体感染率的差异无统计学意义。通过性传播途径感染HIV的患者又可分为通过异性性行为感染HIV以及通过同性性行为感染HIV两种人群,结果发现,Mf的感染情况在这两种人群之间存在显著性差异(χ2Mf=4.381,P=0.036),通过同性性行为感染HIV者中Mf的感染率高于异性性行为感染HIV者,详见表2。
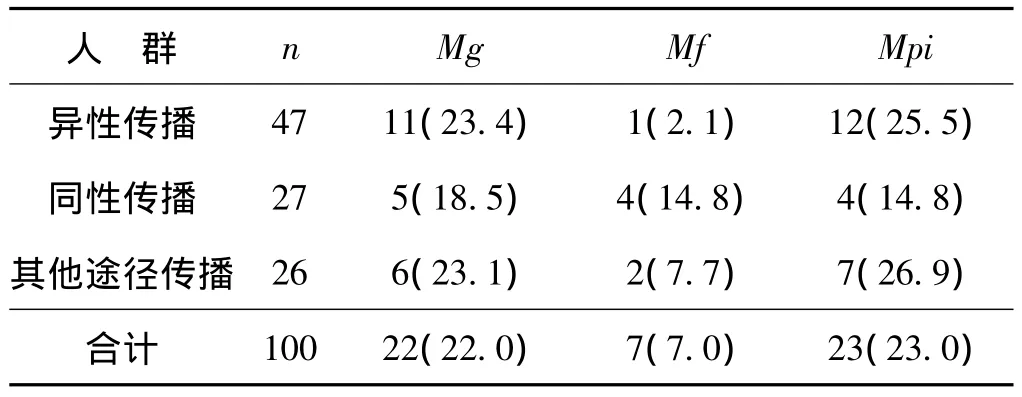
表2 HIV/AIDS患者中不同传播来源人群之间支原体感染情况 例Tab 2 The prevalence of Mycoplasmas among patients infected through different ways cases
AIDS患者的Mg和Mpi感染率有高于HIV感染者的趋势,由于样本例数较少,差异尚无统计学意义。见表3。

表3 HIV/AIDS患者之间支原体感染情况 例Tab 3 The prevalence of Mycoplasmas between HIV infected and AIDS patients cases
2.3 支原体感染与CD4+T细胞水平的关联性
因目前HIV/AIDS患者的治疗指南为“CD4计数500以上不建议治疗”,所以将患者分为两组,比较其支原体感染在不同CD4+T细胞分组时的情况。未发现支原体感染与其CD4+T细胞计数有关联,详见表4。
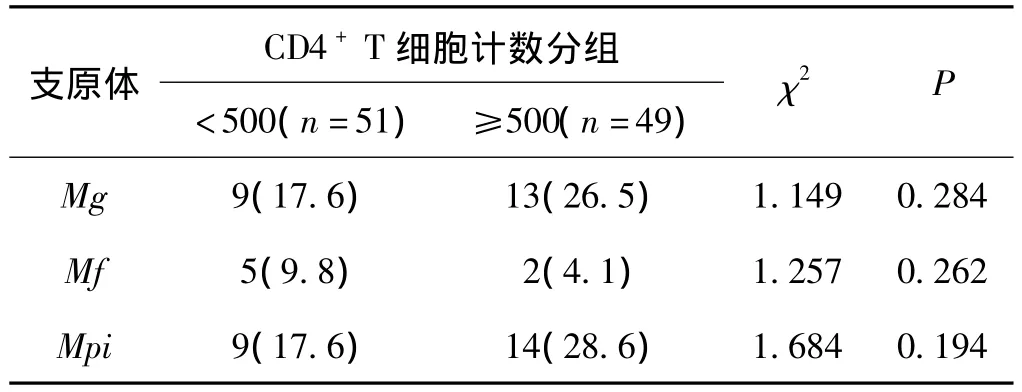
表4 致病性支原体感染与CD4+T细胞水平的关联性例Tab 4 The relevance of Mycoplasmas infection and CD4+T cells count
2.4 HIV/AIDS患者Th1/Th2细胞因子变化
感染了艾滋病相关支原体的男性HIV/AIDS患者外周血IL-4水平明显高于未感染艾滋病相关支原体的男性HIV/AIDS患者(WIL-4=6 272.0,P=0.015),而TNF-α水平明显低于未感染艾滋病相关支原体的男性 HIV/AIDS 患者(WTNF-α=84 005.5,P=0.016),其他因子差异无统计学意义,详见表5。

表5 艾滋病相关支原体与男性HIV+/AIDS患者细胞因子水平比较 pg·ml-1Tab 5 The cytokine levels between AIDS-associated Mycoplasmas infected patients and non-infected patients pg·ml-1
3 讨 论
早期感染HIV后,有一段很长的无症状潜伏期,在此期间,任何一种传染性病原体通过刺激免疫系统都可能在病程中起到某种作用,作为一种机会性感染因子,支原体也可能通过此途径起作用[2]。支原体感染一般是慢性的,可引起特异性体液免疫和细胞免疫。支原体感染的持续存在可能与两种机制有关:一是支原体表面抗原变异,二是支原体对宿主的分子拟态,二者均可使其出现免疫逃逸[3]。本研究从流行病学的角度探讨了艾滋病相关支原体在100例江苏省男性HIV/AIDS中的感染特征,提示支原体在HIV感染及艾滋病中不能忽视。
免疫平衡是维持机体自稳的重要保障[4]。CD4+T淋巴细胞计数是判断HIV感染者疾病进展的最可靠指标[5]。当CD4+T淋巴细胞减少到一定程度时,免疫系统遭到彻底破坏,免疫功能极度低下,临床上常见的机会性感染发生,病程即已进入AIDS期[6]。每个HIV感染者的潜伏期长短不同,这与HIV感染者的年龄、性别、体质和营养及种族都有一定关系,但是这种差别的实质主要是由于CD4+T淋巴细胞数减少的速度不同。因此,CD4+T淋巴细胞被公认是HIV感染后评判其疾病进展的最好指标[7]。随着艾滋病病情的加重,除CD4+T细胞的数量显著减少外,同时存在Th1/Th2细胞因子的失衡。在正常人体内Th1/Th2细胞分泌的细胞因子保持着动态平衡[8],如果这一平衡发生漂移,就会导致疾病的发生[9-10]。当Th1状态占优势时,细胞免疫增强,抗病毒能力较强,而当Th2状态占优势时,对HIV的易感性将大大增强,导致病情的进一步发展[11]。感染了艾滋病相关支原体的男性HIV/AIDS患者外周血IL-4、TNF-α的表达水平明显低于未感染艾滋病相关支原体的男性HIV/AIDS患者,提示艾滋病相关支原体与HIV共感染的状态会对Th1/Th2型细胞因子的动态稳定产生影响。
本次研究虽然样本例数较少,尚不能得出肯定的结论,但初步的分析结果给今后研究提供了依据,提示进一步探索支原体感染在HIV自然病程中的对其免疫功能的影响及机制具有重要意义,同时也需要对更多的HIV感染者和AIDS患者进行更长期的随访追踪调查才能得到较为肯定的结论。
[1]李莉平.HIV致病价值的研究进展[J].细胞与分子免疫学杂志,2007,23(9):886-889.
[2]BLANCHARD A,MONTAGNIER L.Role of mycoplasma infection in the cytopathic effect induced by human immunodeficiency virus type 1 in infected cell lines[J].Annu Rev Microbiol,1994,48(1):687-712.
[3]王蓓,成浩.致病性支原体与HIV交互作用机制研究进展[J].东南大学学报:医学版,2010,29(5):575-580
[4]樊竑冶,董冠军,傅更锋,等.ART治疗对 HIV感染者CD4+FoxP3+T细胞水平的影响[J].东南大学学报:医学版,2012,31(3):318-322
[5]汪习成,吴昊,李太生,等.HIV/AIDS患者外周血T淋巴细胞功能亚群的变化[J].中华实验和临床病毒学杂志,2006,20(4):395-395.
[6]BURGISSER P,HAMMANN C,KAUFMANN D,et al.Expression of CD28 and CD38 by CD8+T lymphocytes in HIV-1 infection correlates with markers of disease severity and changes towards ormalization under treatment.The Swiss HIV Cohort Study[J].Clin Exp Immunol,1999,115:458-463.
[7]ELLIOTT A M,MAWA P A,JOSEPH S,et al.Associations between helminth infection and CD4+T cell count,viral load and cytokine responses in HIV-1-infected Ugandan adults[ J].Trans R Soc Tro P Med Hy,2003,97:103-108.
[8]MAGGI E,BISWAS P,del PRETE G,et al.Accumulation of Th-2-like helper Tcells in the conjunctiva of patients with vernal conjunctivitis [J].JImmunol,1991,146(4):1169-1174.
[9]任莉莉,李富荣,齐晖,等.外周血CD4+淋巴细胞及Th1/Th2细胞因子变化与HIV/AIDS疾病发展的相关性[J].中国现代医学杂志,2005,15(20):3123-3125.
[10]饶和平,冯磊,李丹,等.人免疫缺陷病毒感染者辅助性T淋巴细胞因子变化及机会性感染的临床观察[J].中华预防医学杂志,2007,41(1):42-45.
[11]张笑人,张冬青.细胞因子[M].上海:上海科学技术文献出版社,2000:82-99.

