强化乳铁蛋白配方奶粉对人乳喂养婴儿生长发育和铁代谢影响的前瞻性多中心非随机对照研究
陈 科 章 岚 付桂英 李 华 林兆莉 李惠兰 张 颖 付云蓉 谢胡咪娜 曹艳梅 尚 佳 贾明珍 田维政 张长容 杨 萍 杨海宁 柴灵莺 毛 萌
·论著·
强化乳铁蛋白配方奶粉对人乳喂养婴儿生长发育和铁代谢影响的前瞻性多中心非随机对照研究
陈 科1章 岚1付桂英1李 华2林兆莉2李惠兰2张 颖3付云蓉3谢胡咪娜4曹艳梅4尚 佳5贾明珍5田维政6张长容6杨 萍7杨海宁7柴灵莺8毛 萌9
目的 了解添加强化乳铁蛋白(LF)配方奶粉对婴儿生长发育和铁代谢的影响。方法 本研究为前瞻性多中心非随机对照试验,生后以人乳喂养的4~6月龄健康足月儿自愿添加配方奶粉者纳入本研究,按门诊顺序分别纳入强化组(LF 38 mg·100 g-1,铁元素4 mg·100 g-1)和对照组(LF 0,铁元素4.2 mg·100 g-1,其余成分与强化组相同)。两组干预时间均为3个月。两组婴儿在干预前后分别测定身长、体重、头围、Hb、血清铁蛋白(SF)、血清转铁蛋白受体(sTfR);同时计算TFR-F指数、机体总铁含量(TBIC)、年龄别身高Z评分(HAZ)、年龄别体重Z评分(WAZ)、身高别体重Z评分(WHZ),比较上述指标的干预前后和组间差异。结果 213名婴儿完成了研究,强化组115名,对照组98名。强化组和对照组婴儿人均日摄入配方奶粉量(94.3±9.8)vs(88.2±8.7) g,P>0.05;人均日铁剂摄入量(3.8±0.4)vs(3.7±0.6) mg,P>0.05。强化组人均日LF摄入量为(35.8±3.7) mg。强化组与对照组干预后各指标改变值比较,体重:(2 213±82)vs(2 033±77) g, WAZ: (0.82±0.22)vs(-0.05±0.01), WHZ: (0.74±0.32)vs(0.20±0.06), Hb: (13.9±4.1)vs(7.2±1.8) g·L-1, SF: (1.37±0.08)vs(0.55±0.04) μg·L-1, TFR-F指数:(0.86±0.11)vs(0.39±0.05),TBIC: (19.4±8.8)vs(9.1±3.4) mg·kg-1,P均<0.05。同时干预后强化组贫血、铁缺乏和缺铁性贫血检出率均显著低于对照组,贫血: 4.1%vs7.5%,铁缺乏:13.9%vs24.4%,缺铁性贫血:1.7%vs8.2%,P均<0.05。结论 添加强化LF配方奶粉干预可以显著改善人乳喂养婴儿生长发育以及铁营养状况。
乳铁蛋白; 婴儿; 人乳喂养; 铁代谢稳态;生长发育
缺铁性贫血(IDA)目前仍是严重影响我国婴儿健康的一个重要公共卫生问题。WHO提出解决贫血问题的新方法是寻找更好的促进铁吸收的方式[1]。乳铁蛋白(LF)是母乳中具有重要生物学活性的蛋白质,具有调节体内铁离子运转、储存,提高肠细胞对铁的生物利用率等作用[2]。目前LF已被添加到包括婴儿配方奶粉在内的多种营养品中[3]。添加到配方奶粉中的LF是否仍能发挥其调节机体铁代谢稳态和促进生长发育的生物学作用,国内外报道并不一致。King等[4]和Chierici等[5]的研究分别发现,在配方奶中添加LF可以显著提高其血细胞比容和血清铁蛋白(SF)水平;但Hernell等[6]的研究则认为,配方奶粉中添加LF对婴儿血清铁水平并无明显影响。铁的代谢包括吸收、储备和利用,上述研究并未从铁代谢角度就LF对铁的影响进行全面评估。本研究以生后人乳喂养婴儿为研究对象,假设LF干预后Hb至少应有10 g·L-1以上的提高作为验证目标,探讨强化LF的配方奶粉喂养对婴儿铁代谢的影响,期望为进一步预防和治疗婴儿贫血和铁缺乏症提供科学依据。
1 方法
1.1 研究方案 本研究为前瞻性多中心非随机对照试验。4~6月龄(入组)时行问卷调查,并行体格发育指标、Hb水平和铁代谢指标检测,按照约20 g·kg-1·d-1量的原则免费且唯一添加由浙江贝因美科工贸股份有限公司提供的、市场销售的(含和不含LF)婴儿配方奶粉喂养。不同研究现场对符合纳入标准的入组婴儿按照门诊先后顺序分别进入含LF婴儿配方奶粉(强化)组和不含LF婴儿配方奶粉(对照)组。观察8月龄时体格发育指标、Hb水平和铁代谢指标。
1.2 知情同意和伦理 在尽可能保证母乳喂养的前提下,婴儿父母或主要监护人充分了解研究目的和过程,以书面形式同意参与本研究。强化组婴儿配方奶粉:LF 38 mg·100 g-1, 铁元素4 mg·100 g-1,对照组婴儿配方奶粉:LF 0,铁元素4.2 mg·100 g-1,两组其余配方成分相同。本研究方案获得成都市妇女儿童中心医院伦理委员会批准。
1.3 利益关系说明 本研究为浙江贝因美科工贸股份有限公司研究院资助项目(基金号:RD00713007),成都市妇女儿童中心医院作为研究牵头单位,负责设计、实施、测量和质量控制,产生数据独立于资助公司进行分析;两组婴儿家长免费从资助公司获得配方奶粉,但本文主要和次要观察指标均为量化指标,受配方奶粉资助的婴儿家长对研究结果没有主观影响。
1.4 研究现场 选取成都市妇女儿童中心医院便于组织的6所区级妇幼保健院作为研究现场,分别为:成都市青白江区妇幼保健院、金牛区妇幼保健院、大邑县妇幼保健院、成华区妇幼保健院、新都区妇幼保健院,眉山市东坡区妇幼保健院。
1.5 样本量估算 本研究纳入人乳喂养健康婴儿,采用两组间t检验样本量估计法;干预后LF组Hb水平较对照组干预后高10 g·L-1左右认为有临床意义;标准差为15 g·L-1;检验水准:0.05,双侧;检验效能:0.95;利用SAS 9.0样本量计算程序两组至少需要有效样本量120例,考虑到20%的失访,最终两组共需要有效样本量为144例。

1.7 剔除标准 ①观察期间除添加本研究提供的婴儿配方奶粉外,还添加了其他配方奶粉者;②入组时和8月龄时婴儿体格发育指标、Hb水平和铁代谢指标不完整者。
1.8 观察指标
1.8.1 主要观察指标 ①婴儿体格发育指标:由不同研究现场的妇幼保健院测量。身长、体重、头围等测定方法参照文献[7],采用WHO推荐的身高、体重(美国国家卫生统计中心)标准作为参考 (http://www.who.int/childgrowth/software/en)计算Z评分,对其营养状态进行评价,包括年龄别身高Z评分(HAZ)、年龄别体重Z评分(WAZ)、身高别体重Z评分(WHZ);② Hb水平:分别在不同研究现场检验科采用氰化高铁法检测。③不良反应:观察期间出现与配方奶粉相关的腹泻、呕吐、便血、湿疹、急性荨麻疹和血管神经性水肿等,当出现上述不良反应时中止添加配方奶粉喂养。
1.8.2 次要观察指标 ①SF、血清转铁蛋白受体(sTfR)和CRP。不同研究现场在干预前和干预后分别抽取静脉血约1.5 mL,取0.5 mL加入肝素抗凝管当即行Hb测定;余血分装入干燥管中室温下3 000 g离心5 min,分离血清-20℃冰箱冷冻保存,送至成都市妇女儿童中心医院中心实验室统一检验;SF采用酶联免疫定量检测法,单位为μg·L-1,sTfR采用微粒子增强透射免疫法,单位为mg·L-1,CRP采用免疫比浊法。②TFR-F指数:sTfR与SF浓度的对数比值(sTfR/logSF)。③机体总铁含量(TIC) = -[log(sTfR/SF)-2.822 9]/0.120 7。③贫血及铁缺乏(ID)评价标准:Hb<110 g·L-1;ID:血清SF<12 μg·L-1;IDA:同时符合贫血及ID标准者。④通过配方奶粉用量记录本统计配方奶粉消耗数量,以此为基础统计组人均日摄入配方奶粉量:总配方奶粉摄入量/干预人数/干预天数,组人均日铁剂摄入量:总铁剂摄入量/干预人数/干预天数,组人均日LF摄入量:总LF摄入量/干预人数/干预天数。
1.9 调查问卷内容 符合纳入标准婴儿父母或主要监护人入组前,在所在妇幼保健院接受问卷调查。包括儿童性别、年龄、居住环境、疾病史、健康状况、被动吸烟史、父母受教育程度、家庭经济收入、家庭常驻人口数等内容。
2 结果
2.1 一般情况 2012年3月至2013年3月6个研究现场的妇幼保健院符合本文纳入标准的婴儿260例,19例婴儿父母拒绝参与本研究,5例婴儿同时使用其他配方奶粉,22例8月龄时体格发育指标、Hb水平和铁代谢指标不完整(22/241,9.1%),1例观察期间出现与配方奶粉相关不良反应,213例进入本文分析。强化组110例,对照组103例,对照组5例婴儿父母在入组时要求进入强化组,最终强化组115例,对照组98例(图1)。婴儿配方奶粉生产批号,强化组:20121008B89M、20110613D03Z、20111018C03Z和120529D03Z;对照组:20100908D05Z、2010112D05Z和20121018C03Z。

图1 研究对象纳入排除流程图
Fig 1 Flow chart of subjects selection
两组婴儿一般临床资料如表1所示,强化组和对照组婴儿的性别构成、母亲年龄、孕周、月龄,干预前体重、身长和头围等指标差异均无统计学意义。
强化组和对照组婴儿人均日摄入配方奶粉量和人均日铁剂摄入量差异均无统计学意义,(94.3±9.8)vs(88.2±8.7) g、(3.8±0.4)vs(3.7±0.6) mg;强化组人均日LF摄入量为(35.8±3.7) mg。两组婴儿干预前体重、身长、头围、WAZ、HAZ、WHZ和Hb等差异均无统计学意义;血清SF、sTfR、TFR-F指数和TBIC等指标差异均无统计学意义。
2.2 干预对主要观察指标的影响 表2显示,两组婴儿干预前后体重、身长、头围、WAZ、HAZ、WHZ和Hb指标的改变量差异均有统计学意义;但是身长、头围以及HAZ的改变量两组差异均无统计学意义。
2.3 干预对次要观察指标的影响 表2显示,两组婴儿干预前后血清SF、TFR-F指数和TBIC指标的改变量差异均有统计学意义,sTfR的改变量两组间差异无统计学意义。
表3显示, 两组婴儿干预前贫血、 ID和IDA检出率差
IndexFortifiedgroup(n=115)Controlgroup(n=98)t/χ2PFemale63(54.8)52(53.1)0.0630.802Pregnantage/years25.3±2.826.1±3.11.9620.051Gestationalage/weeks38.4±5.838.7±5.50.3500.699Ageatrecruited/months5.1±0.85.3±0.91.7010.091Weightatrecruited/g6514±2316518±2280.1270.899Heightatrecruited/cm64.8±11.465.1±12.10.1850.853HCatrecruited/cm41.9±9.842.7±8.40.6420.522Educationofmaincaregivers/years10.8±2.210.9±2.00.3470.729Monthlyhouseholdincome/yuan2816±1262849±1311.90.059Passivesmokingexposure18(15.6)15(15.3)0.0051Livingrural28(24.3)21(21.4)0.2530.615Familypopulation<431(27.0)24(24.5)0.1670.683WAZ0.21±0.110.19±0.091.4590.147HAZ0.42±0.170.39±0.111.551.22WHZ0.22±0.080.23±0.100.7960.427Hb/g·L-1112±12110±121.1520.251SF/μg·L-125.4±14.122.7±13.51.4250.156sTfR/mg·L-10.98±0.171.01±0.211.1330.259TFR⁃Findex1.01±0.20.97±0.181.5360.126TBIC/mg·kg-14.75±0.224.71±0.241.2590.209
Notes HC: head circumference ;WAZ:Z- score of weight by age; HAZ:Z-score of height by age; WHZ:Z-score of weight by height; Hb: hemoglobin; SF:serum ferritin; sTfR:serum transferring receptor; TFR-F index:sTfR-SF index; TBIC: total body iron content
异均无统计学意义;干预后较干预前贫血、ID和IDA检出率明显下降,差异均有统计学意义;干预后强化组贫血、ID和IDA检出率则显著低于对照组,差异均有统计学意义。
3 讨论
本研究为商业公司资助项目,在研究设计、实施、测量和质量控制,特别是产生数据过程中和分析数据时均独立于资助公司,但影响研究结果的可能性仍然存在。两组婴儿家长均免费从资助公司获得婴儿配方奶粉,可能在基线水平调查项目的回答上对资助公司有利,但本文主要和次要观察指标均为量化指标,受益方婴儿家长主观影响研究结果没有可能。本研究干预实施虽然不是随机化分组,以不同研究现场门诊先后顺序分别进入强化组和对照组,而且进入对照组有5位婴儿家长改变意愿进入强化组,但两组婴儿的性别构成、母亲年龄、孕周、月龄、干预前体重、身长、头围、主要抚养者受教育年限、家庭人均月收入、被动吸烟暴露、居住环境、家庭常住人口数、人均日摄入配方奶粉量和人均日铁剂摄入量差异均无统计学意义,入组人群可能的选择偏倚没有对两组基线水平带来影响。
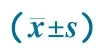
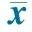
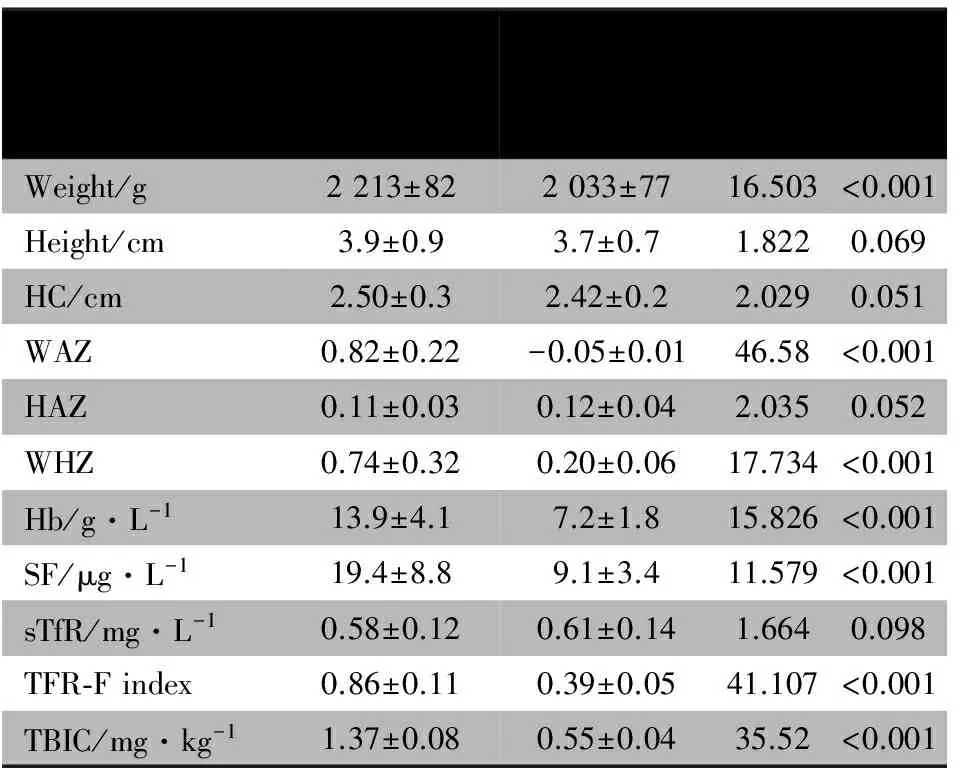
ChangeofindexFortifiedgroup(n=115)Controlgroup(n=98)t/χ2PWeight/g2213±822033±7716.503<0.001Height/cm3.9±0.93.7±0.71.8220.069HC/cm2.50±0.32.42±0.22.0290.051WAZ0.82±0.22-0.05±0.0146.58<0.001HAZ0.11±0.030.12±0.042.0350.052WHZ0.74±0.320.20±0.0617.734<0.001Hb/g·L-113.9±4.17.2±1.815.826<0.001SF/μg·L-119.4±8.89.1±3.411.579<0.001sTfR/mg·L-10.58±0.120.61±0.141.6640.098TFR⁃Findex0.86±0.110.39±0.0541.107<0.001TBIC/mg·kg-11.37±0.080.55±0.0435.52<0.001
Notes HC: head circumference; WAZ:Z- score of weight by age; HAZ:Z-score of height by age; WHZ:Z-score of weight by height; Hb: hemoglobin; SF:serum ferritin; sTfR:serum transferring receptor; TFR-F index:sTfR-SF index; TBIC: total body iron content
表3 强化组和对照组婴儿营养性疾病检出率的变化[n(%)]
Tab 4 The effect of lactoferrin fortified on detection rate of nutritional disease of infants in two groups[n(%)]
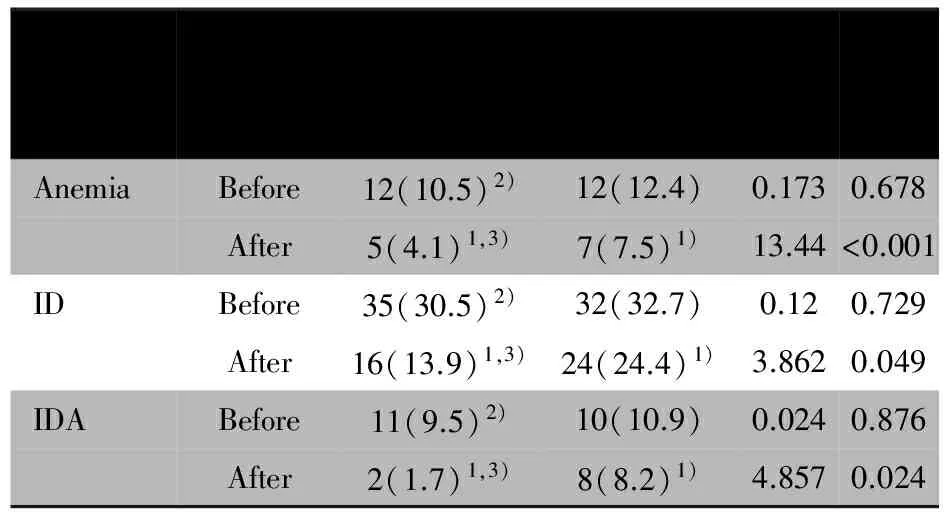
IndexFortifiedgroup(n=115)Controlgroup(n=98)t/χ2PAnemiaBefore12(10.5)2)12(12.4)0.1730.678After5(4.1)1,3)7(7.5)1)13.44<0.001IDBefore35(30.5)2)32(32.7)0.120.729After16(13.9)1,3)24(24.4)1)3.8620.049IDABefore11(9.5)2)10(10.9)0.0240.876After2(1.7)1,3)8(8.2)1)4.8570.024
Notes Before: before intervention; Atfer: after intervention; DRND:detection rate of nutritional disease; ID: iron deficiency; IDA; iron deficient anemia.1) significant difference before and after intervention in group (P<0.05); 2) no significant difference before intervention between groups (P>0.05); 3) significant difference after intervention between groups(P<0.05)
国外已有人群干预研究发现,强化LF对改善人群贫血具有显著作用[8,9〗[5]研究发现,SF水平强化予LF配方奶粉喂养婴儿明显高于未强化LF配方奶粉喂养婴儿;国内[10]研究也表明,生后即予以强化LF配方奶粉喂养的婴儿,其在6月龄时红细胞压积比、红细胞平均体积以及网织红细胞计数等指标均显著高于母乳喂养婴儿和非强化LF配方奶粉婴儿。
本文干预3个月后比较,贫血、ID和 IDA的检出率强化组较对照组均显著下降;并且SF水平明显升高。SF是反映机体肝脏铁储备状态的敏感指标,表明LF的补充可以提高铁剂在肝脏的储备。将SF和sTfR结合起来的TFR-F指数可代表机体总铁营养状况,这与机体总铁含量的意义非常接近[1],两者都可间接反映铁剂在肠道的吸收。本研究数据表明,在人均日摄入铁剂含量基本相同的情况下,LF的补充可以显著提高婴儿TFR-F指数,表明LF的补充可以显著提高铁剂在肠道的吸收和转运过程。但目前仅有本研究就LF对铁剂在肠道的吸收进行了报道,尚无类似研究进行比较,因此还需要扩大样本量或者更多的研究来验证这一结论。
值得注意的是,在对母乳喂养婴儿仅予以强化铁剂的配方奶粉后,这部分婴儿贫血以及ID均出现了明显的改善,表明补充强化铁配方奶粉对纠正婴儿ID的优势;而在相同铁剂补充的基础上进一步强化LF后,这部分婴儿ID以及铁代谢指标的改善更为明显,提示联合强化LF和铁剂配方奶粉的可能更有利于贫血和ID的纠正。当然还需要对贫血婴儿、或者单纯铁剂补充效果欠佳的婴儿联合LF补充的研究来进行验证。
强化LF配方奶粉对婴儿生长发育影响的研究结果不甚一致。King等[4]研究发现,婴儿强化LF后,尽管对身长和头围影响不大,但6月龄内各月强化组婴儿的体重均显著高于对照组;而LF对体重的影响考虑与配方奶粉强化LF后总蛋白以及总热卡含量增加有关。Hernel等[6]研究则表明,使用强化LF配方奶粉,强化组6月龄时的体重和身长水平都显著高于对照组,考虑可能与LF可以直接促进细胞的增殖和分化有关。国内[10]研究也发现,强化组婴儿6月龄时的体重、头围以及身长等都显著高于对照组,考虑与LF减少潜在性贫血以及感染的发生有关。本研究表明,LF配方奶粉3个月的补充至少对母乳喂养婴儿体重具有明显作用,有利于促进婴儿生长发育。本研究中LF配方奶粉对身长和头围无明显影响,考虑可能与干预时间较短有关。
本研究存在以下局限性:①影响Hb和生长发育的营养因素众多,本文仅从铁和LF角度解释;②样本量的计算仅依据Hb而未结合生长发育指标进行确定,可能会掩盖具有临床意义的阳性结果;③干预时间仅为3个月,延长时间可能会观察到LF的长期作用。
[1]Micronutrient deficiencies. Battling iron deficiency anemia. Nutrition Program, World Health Organization. http://www.who.int/nut/ida.htm
[2]Brock JH. Lactoferrin-50 years on. Biochem Cell Biol, 2012,90(3):245-251
[3]Lonnerdal B, Suzuki Y. Lactoferrin, in Advanced Dairy Chemistry. 2013, Springer.295-315
[4]King JC Jr, Cummings GE, Guo N, et al. A double-blind, placebo-controlled, pilot study of bovine lactoferrin supplementation in bottle-fed infants.J Pediatr Gastroenterol Nutr,2007,44(2):245-251
[5]Chierici R, Sawatzki G, Tamisari L, et al. Supplementation of an adapted formula with bovine lactoferrin. 2. Effects on serum iron, ferritin and zinc levels. Acta Paediatr, 1992,81(6-7):475-479
[6]Hernell O, Lonnerdal B. Iron status of infants fed low-iron formula: no effect of added bovine lactoferrin or nucleotides.Am J Clin Nutr, 2002,76(4):858-864
[7]McWilliam S, Riordan A. How to use: C-reactive protein. Archives of Disease in Childhood-Education & Practice Edition, 2010, 95(2): 55-58
[8]Paesano R, Pietropaoli M, Gessani S, et al. The influence of lactoferrin, orally administered, on systemic iron homeostasis in pregnant women suffering of iron deficiency and iron deficiency anaemia. Biochimie, 2009, 91(1): 44-51
[9]Paesano R, Berlutti F, Pietropaoli M, et al. Lactoferrin efficacy versus ferrous sulfate in curing iron disorders in pregnant and non-pregnant women. Int J Immunopathol Pharmacol, 2010,23(2):577-587
[10]Chen GY(陈冠仪), Chen CT, Chen HJ, et al. 含乳铁蛋白配方奶粉喂养对婴儿生长发育和外周血细胞数值的影响. Chinese Journal of Postgraduates of Medicine(中国医师进修杂志), 2011. 34(15):52-55
[11]Al-Saqladi AW, Bin-Gadeem HA, Brabin BJ. Utility of plasma transferrin receptor, ferritin and inflammatory markers in children with sickle cell disease. Paediatr Int Child Health,2012,32(1):27-34
Effect of lactoferrin fortified formula milk for infants with breastfeeding on growth and development and iron metabolic homeostasis: a prospective multicenter nonrandomized controlled trial
CHENKe1,ZHANGLan1,FUGui-ying1,LIHua2,LINZhao-li2,LIHui-lan2,ZHANGYing3,FUYun-rong3,XIEHUMi-na4,CAOYan-mei4,SHANGJia5,JIAMin-zhen5,TIANWei-zheng6,ZHANGChang-rong6,YANGPing7,YANGHai-ning7,CHAILing-ying8,MAOMeng9
( 1DepartmentofChildHealthCare,ChengduWomen'sandChildren'sCentralHospital,Chengdu610031; 2DepartmentofPreventiveHealthCare,WomenandChildren'sHealthCareHospital,QingBaijiangDistrict,Chengdu610300; 3DepartmentofChildHealthCare,WomenandChildren'sHealthCareHospital,JinniuDistrict,Chengdu610081; 4DepartmentofChildHealthCare,WomenandChildren'sHealthCareHospital,DayiCounty,Chengdu611300; 5DepartmentofChildHealthCare,WomenandChildren'sHealthCareHospital,ChenghuaDistrict,Chengdu610051; 6DepartmentofPediatrics,WomenandChildren'sHealthCareHospital,DongpoDistrict,Meishan620010; 7DepartmentofChildHealthCare,WomenandChildren'sHealthCareHospital,XinduDistrict,Chengdu610500; 8ZhejiangBeingmateScientific-Industrial-TradeShareCo.,Ltd,Hangzhou310053; 9KeyLaboratoryofObstetricandGynecologicandPediatricDiseaseandBirthDefectsofMinistryofEducation,WestChinaSecondHospital,SichuanUniversity,Chengdu610041,China)
MAO Meng,E-mail:mmcdfy@163.com
ObjectiveTo explore the effect of lactoferrin fortified formula milk for infants with breastfeeding on growth and development and iron metabolic homeostasis.Methods In this prospective multi-center controlled intervention study , a total of 260 infants aged 4-6 months old were selected from six maternal and children's health care hospitals. All subjects were divided into two groups with the sequence of outpatient: lactoferrin fortified formula milk group (fortified group, FG, containing lactoferrin 38 mg·100 g-1milk and iron element 4 mg·100 g-1milk) and no lactoferrin fortified milk group(control group, CG, containing lactoferrin 0 mg/100g milk and iron element 4.2 ·100 g-1milk) for 3 months. The levels of weight, height and head circumference and the concentration of hemoglobin (Hb), serum ferritin (SF), serum transferring receptor (sTfR) were measured and sTfR-SF index (TFR-F index), total body iron content (TBIC) and HAZ, WAZ and WHZ were computed before and after intervention, respectively.ResultsA total of 213 (including 115 in FG, and 98 in CG) infants were completed the intervention trial and all the measurements of biochemical indicators. There was no significant difference in the average amount of daily intake of formula milk [(94.3±9.8) gvs(88.2±8.7) for FG and CG,P>0.05] and iron element [(3.8±0.4) mgvs(3.7±0.6) mg for FG and CG,P>0.05] between FG and CG. The average amount of daily intake of lactoferrin for infants in FG group was (35.8±3.7) mg. The levels of weight, WAZ, WHZ, Hb, SF, TFR-F index and TBIC of infants after intervention in FG were all significantly higher than those of infants in CG. The changes of index were (2 213±82)vs(2 033±77) g for weight, (0.82±0.22)vs(-0.05±0.01) for WAZ, (0.74±0.32)vs(0.20±0.06) for WHZ, (13.9±4.1)vs(7.2±1.8) g·L-1for Hb, (1.37±0.08)vs(0.55±0.04) μg·L-1for SF, (0.86±0.11)vs(0.39±0.05) for TFR-Findex and (19.4±8.8)vs(9.1±3.4) mg·kg-1for TBIC,P<0.05, but significantly lower (P<0.001) for the prevalence of anemia (4.1%vs7.5%), iron deficiency (13.9%vs24.4%) and the iron deficient anemia (1.7%vs8.2%). ConclusionThe effect of intervention of latoferin fortified formula milk on iron metabolic homeostasis of infant with exclusively breastfeeding was mainly manifested on total body iron content and iron absorption in intestine.
Lactoferrin; Infants; Breastfeeding; Iron metabolic homeostasis; Growth and development
1 四川省成都市妇女儿童中心医院儿童保健指导中心 成都,610031;2 四川省成都市青白江区妇幼保健院预防保健科 成都,610300 ;3 四川省成都市金牛区妇幼保健院儿童保健科 成都,610081;4 四川省成都市大邑县妇幼保健院儿童保健科 成都,611300;5 四川省成都市成华区妇幼保健院儿童保健科 成都,610051;6 四川省眉山市东坡区妇幼保健院儿科 眉山,620010;7 四川省成都市新都区妇幼保健院儿童保健科 成都,610500;8 浙江贝因美科工贸股份有限公司 杭州,310053;9 四川大学华西第二医院教育部妇儿疾病与出生缺陷重点实验室 成都,610041
毛萌,E-mail: mmcdfy@163.com
10.3969/j.issn.1673-5501.2013.06.005
2013-10-27
2013-12-01)
张崇凡)
——忌食

