凋萎病对杨梅树体钙吸收和分配的影响
郑锡良,任海英,徐云焕,李 岗,梁森苗,周慧芬,戚行江
(1.浙江省农业科学院 园艺研究所,浙江 杭州 310021;2.浙江省农业厅 经济作物管理局,浙江 杭州 310020;3.浙江省植物有害生物防控重点实验室—省部共建国家重点实验室培育基地浙江省农业科学院农产品质量标准研究所,浙江杭州 310021)
杨梅 (Myrica rubra)是我国南方特有的珍稀水果,果实甜酸适口,风味独特,在国内外享有盛誉,因其显著的经济与生态效益,目前已成为浙江省主要水果之一,其产值已稳居各类水果之首。杨梅凋萎病为浙江省近年来新发生的病害,具有发病快、病程长、传染性强等特点,目前在浙江省杨梅主产区迅速蔓延,严重影响杨梅产业的可持续发展[1]。
钙信号是植物信号转导途径中重要的信号分子,参与大多数细胞生理代谢的过程[2],又是植物生长发育必需的营养元素,在植物抗逆性中具有重要作用,例如风、冷、盐、干旱、光、氧应激等[3-6]外界刺激均可引起细胞质钙的短暂增加,与黄瓜[7]、网纹甜瓜[8]的低氧耐性有关,能提高根系SOD、POD等保护酶的活性[9-10],减轻渗透胁迫对叶绿体和线粒体的伤害。
钙离子还与植物与病原物的互作有重要关系,能提高植物的水杨酸诱导抗性[11],胞内钙离子增加是叶片细胞在病原体侵染时产生活性氧的必要条件[12],参与抗病反应[13-14],引起病原菌诱导子的磷酸化,从而起到保护植物细胞的作用[15],参与过敏性坏死反应[16]。
本文对杨梅发病植株与健康植株的根、枝(包括木质部和韧皮部)和叶等部位的钙元素含量、根际土壤速效钙进行检测分析,分析凋萎病对杨梅树体钙吸收与分配的影响。
1 材料和方法
1.1 样品采集
采样地点为仙居县西炉村发病严重的杨梅园。选择在杨梅园的阳面和阴面采集样品。杨梅发病植株采集样品分为发病重、中等和轻3个级别,每个级别的杨梅树采集3棵树的样品。分别按阳、阴面3个发病级别采集样品测定钙元素含量,取其平均值作为发病植株钙元素含量。健康植株作为对照分别在阳、阴面采集样品。样品以发病植株有病症、无病症和健康植株的新梢 (包括叶片和枝干)、老龄的枝条 (包括叶片和枝干)和根,取样长度约50~100 cm,将枝、根的木质部与韧皮部分开,分别检测木质部和韧皮部的钙元素含量。土样采集杨梅发病和健康植株根际表层土下10~20 cm处细土壤,测定土壤速效钙。
1.2 测定方法
将外业采集的植物样在85℃下烘干,粉碎、装瓶、贴签待用;测定营养元素含量时,105℃下烘3 h,准确称样,用盐酸浸提原子吸收分光光度法,备用测定。把外业采集的土样自然风干,过1.00 mm土壤筛,装瓶、贴签备用。醋酸铵提取原子吸收分光光度法测定土壤速效钙。
1.3 数据分析
试验数据采用 Excel软件进行整理,并采用SAS统计软件对数据进行分析。
2 结果与分析
2.1 叶片钙元素含量
测得杨梅发病植株有病症和无病症新梢叶片钙元素含量分别是0.47%和0.58%,健康植株(CK)叶片钙元素含量0.49%,前者与对照差异不明显,后者明显高于对照。发病植株老龄叶片的钙元素含量是0.73%,与健康植株叶片钙元素含量0.49%相比有明显差异 (图1)。
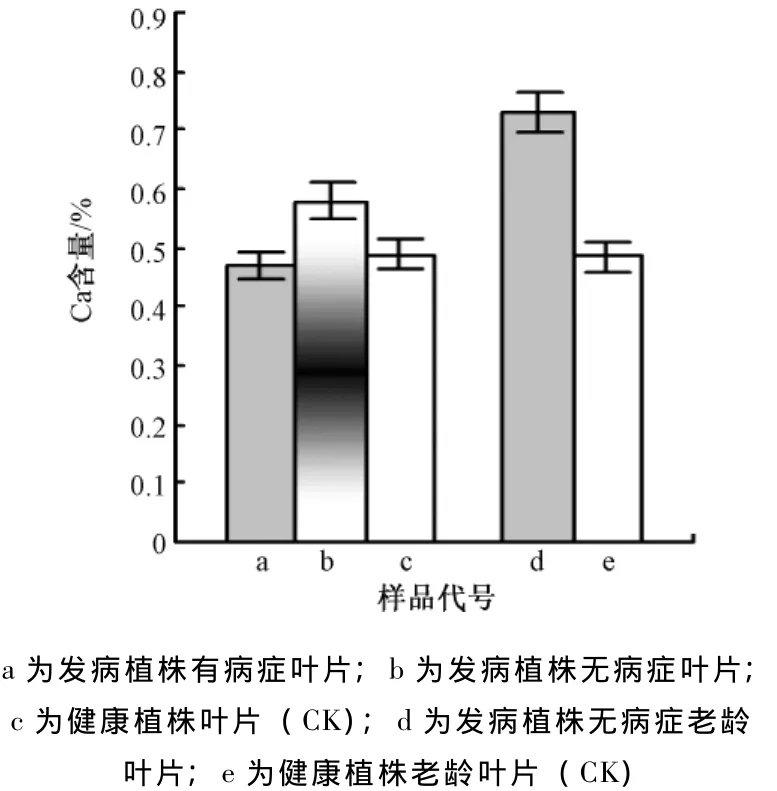
图1 不同叶片的钙含量
2.2 枝、根韧皮部与木质部的钙含量
杨梅发病植株有、无病症的新枝韧皮部钙平均含量分别是0.51%和0.66%,两者均明显低于健康植株新枝的韧皮部钙元素含量 (0.79%),三者间差异明显。老枝的韧皮部总钙含量是0.45%,明显高于健康植株总钙含量0.12%,发病植株根的韧皮部钙元素含量0.25%,与健康植株根的韧皮部钙元素含量0.28%相比,无明显差异 (图2)。

图2 不同枝、根韧皮部的钙元素含量
发病植株有、无病症的新枝木质部的钙含量分别是0.35%和0.41%,前者与健康植株新枝木质部钙含量0.34%相比,无明显差异,但是后者差异明显。发病植株无病症的老龄枝木质部的钙含量0.21%,明显高于健康植株老龄枝木质部的含量0.12%。根的木质部钙含量是0.2%,与健康植株根木质部的0.19%相比,无明显差异 (图3)。
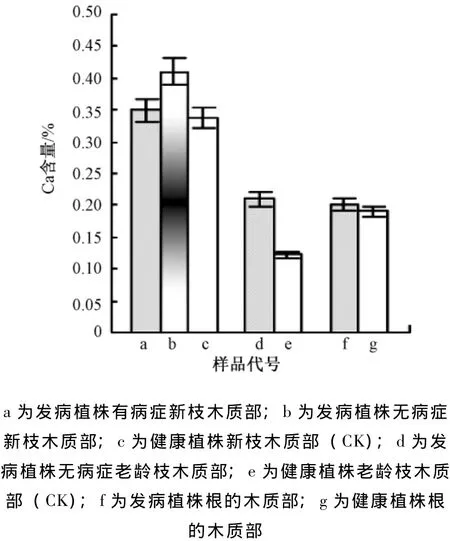
图3 不同枝、根木质部的钙元素含量
2.3 根际土壤速效钙含量
测得发病植株根际土壤的平均速效钙含量为741.83 mg·kg-1,健康植株根际土壤的为164.0 mg·kg-1,两者间差异明显 (图4)。发病植株根际土壤的平均速效钙含量比健康植株高出了4.5倍。由于样品采集于同一个杨梅园,土壤性质相同,从根际土壤速效钙含量差异来分析,发病植株可能吸收土壤中钙功能已衰退。

图4 不同根际土壤的速效钙含量
3 小结与讨论
钙离子的流入是病原菌入侵细胞后植物产生抗病反应的早期信号之一[13],胞内 Ca2+的增加导致活性氧的产生[12],参与过敏性坏死反应[16]。研究结果发现,发病植株有病症叶片、枝的木质部、根的韧皮部和木质部等部位的钙元素含量与健康植株(CK)相比差异不明显,这说明发病植株枯萎或死亡的叶片及其枝干的木质部植物的防卫反应强度很可能没有发生变化。无病症的嫩梢叶片和老龄叶片、枝的木质部、老龄枝的韧皮部和木质部等部位的钙元素含量比健康植株 (CK)有明显升高,这说明发病植株的部分嫩梢部位的死亡引起无病症的嫩梢以及老龄枝、叶等有着强烈的防卫反应以及活性氧产生,这需要大量的钙离子参与,所以这些部位钙元素含量明显升高。发病植株上表现症状和不表现症状的嫩梢的韧皮部的钙元素含量与健康植株相比有明显降低,这说明嫩梢的韧皮部吸收钙离子的量减少。发病植株根际土壤的速效钙含量明显高于健康杨梅树根际土壤的速效钙含量,说明对整株树而言,杨梅发生凋萎病后对钙离子的吸收能力总体衰退了。凋萎病影响杨梅植株吸收及分配钙离子的机理尚待进一步研究。
[1] 求盈盈,任海英,王汉荣,等.杨梅突发性枝叶凋萎病发病调查与病原接种研究 [J].浙江农业科学,2011(1):98-100.
[2] Allen G J,Harrington C L,Schumacher K,et al.A defined range of guard cell calcium oscillation parameters encodes tomatal ovements [J].Nature,2001,411:1053-1057.
[3] Knight H,Trewavas A J,Knight M R.Cold calcium signaling in Arabidopsis involves two cellular pools and a change in calcium signature after acclimation [J].Nature,1996(8):489-503.
[4] Night H,Trewavas A J,Knight M R.Calcium signaling in Arabidopsis thaliana responding to drought and salinity [J].Nature,1997,12(5):1067-1078.
[5] Shacklock P S,Read N D,Trewavas A J.Cytosolic free calcium mediates red light-induced photomorphogenesis[J].Nature,1992,358:753-755.
[6] Evans N H,McAinsh M R,Hetherington A M,et al.ROS perception in Arabidopsis thaliana:the ozone-induced calcium response [J].Nature,2005,41:615-626.
[7] 胡晓辉,郭世荣,李璟,等.低氧胁迫对黄瓜幼苗根系无氧呼吸酶和抗氧化酶活性的影响 [J].武汉植物学研究,2005,23(4):337-341.
[8] 高洪波,郭世荣,刘艳红,等.低氧胁迫下Ca2+、La3+和EGTA对网纹甜瓜活性氧代谢的影响 [J].南京农业大学学报,2005,28(2):17-21.
[9] 王长义,郭世荣,刘超杰.钙对根际低氧胁迫下黄瓜幼苗保护酶同工酶表达的影响 [J].西北植物学报,2009,29(9):1874-1880.
[10] 何淼,杨絮茹,刘晓东.钙对渗透胁迫下大花萱草幼苗生理响应及叶肉组织超微结构的影响 [J].中国草地学报,2012,34(1):84-88.
[11] 李琳琳,李天来,余朝阁,等.钙素对 SA诱导番茄幼苗抗灰霉病的调控作用 [J].园艺学报,2012,39(2):273-280.
[12] Grant M,Adams S,Knight M,et al.The RPM1 plant disease resistance gene facilitates a rapid and sustained increase in cytosolic calcium that is necessary for the oxidative burst and hypersensitive cell death [J].Plant J,2000,23:441-450.
[13] Ma W,Walker R,Verma K,et al.Ca2+,cAMP and transduction of non-self perception during plant immune responses [J].Proc Natl Acad Sci U S A,2009,106(49):995-1000.
[14] Gao G,Jin L P,Xie K Y,et al.The potato StLTPa7 gene displays a complex Ca-associated pattern of expression during the early stage of potato-Ralstonia solanacearum interaction[J].Mol Plant Pathol,2009,10(1):15-27.
[15] Ogasawara Y, HiraokaG, YumotoF, etal. Synergistic activation of the Arabidopsis NADPH oxidase AtrbohD by Ca2+and phosphorylation [J]. J BiolChem, 2008, 283:8885-8892.
[16] Xu H X.Role of calcium in signal transduction during the hypersensitive response caused by basidiospore derived infeclion of the cowpea rust fumgus [J]. Plant Cell,1998,10:585-597.
[17] 余晓丛,娜仁,张少英.钙信号在植物抗病性中的作用研究进展 [J].中国农学通报,2012,28(3):12-16.

