EGFL7在胃癌组织中的表达研究
王启广,曹友德,刘 琼,陈雪初
(湖南师范大学第一附属医院,湖南省人民医院检验科,湖南 长沙410005)
研究表明恶性肿瘤细胞浸润转移的过程大致相同,包括原发肿瘤的生长、新生血管形成、肿瘤细胞脱落及血管内渗或通过淋巴系统进入血液循环,进一步发展成肿瘤转移灶[1]。 本研究探讨胃癌发病机制,寻找关键调控因子,有助于新型高效靶向治疗药物的研发[2]。
Soncin 和Park 等分别发现了一个在血管内皮细胞中特异性表达的基因, 命名为VE-statin 和EGFL7[3,4]。 既往研究认为EGFL7 具有内皮特异性,即只在幼稚的血管内皮中表达[5],但随着研究深入,发现一些肿瘤细胞中也有EGFL7 的表达, 如在肝癌、前列腺癌和恶性胶质瘤,且其表达与肿瘤的临床病理特征相关[6,7]。本实验用免疫组化法检测胃癌组织EGFL7 的表达, 分析其表达与肿瘤分级、FⅧ及微血管密度(MVD)的相关性。为研究其在胃癌发生发展中的作用和机制提供理论依据,从而评价其对胃癌细胞浸润转移能力的影响,为进一步的胃癌靶向治疗提供新的靶点。
1 材料与方法
1.1 标本采集
收集湖南省人民医院2010.1~2011.01 行手术切除的新鲜胃癌组织45 例 (男性32 例, 女性13例)。 经10%福尔马林固定, 常规石蜡包埋, 切成4μm 厚的石蜡切片,进行SP 免疫组化染色。
1.2 实验试剂与方法
1.2.1 实验试剂
鼠抗人EGFL7 单克隆抗体购自上海卡努生物公司(浓度1:400),鼠抗人即用型FⅧ抗体购自福州迈新生物试剂公司,SP-9000 免疫组化染色试剂盒和DAB 染色剂购自北京中杉金桥公司。
1.2.2 实验步骤
按照链霉菌抗生物素一过氧化物霉(streptavidin-peroxidase, S-P) 法检测试剂盒说明书进行实验,分别对胃癌组织中EGFL7 和FⅧ进行免疫组化染色,结果由两位高年资病理科医生进行双盲法阅片。
1.3 结果判定
参考Eroglu 等的[8,9]IRS ( immuno-reactive score )法即在高倍镜(×200) 下随机选5 个视野, 每视野计数200 个细胞, 根据染色强度、 阳性细胞数两者计分的乘积进行判断:IRS = 阳性细胞着色强度×组织细胞中阳性细胞数所占的百分比。 阳性细胞着色强度记分如下: 未着色记0 分; 淡黄色记1分;黄色记2 分;棕黄色记3 分。组织细胞中阳性细胞数所占的百分比判分标准:0%记0 分;1%-10%记1 分;11%-50%记2 分;5l%-80%记3 分;80%-100%记4 分。
EGFL7 表达强度判定: 综合评分0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为中度阳性(++),9~12 分为强阳性(+++)。
微血管密度( microvessel density , MVD ) 测定[10]:FⅧ特异性表达于血管内皮细胞,本文以FⅧ抗体标记血管,进行免疫组化染色。 凡呈现棕黄色单个内皮细胞或内皮细胞群者均作1 个血管计数, 肌层较厚及管腔直径大于8 个红细胞直径的血管不予计数[11]。 在光学显微镜低倍视野下(×100) 扫视整个切片, 于浸润区域选取内皮细胞染色清晰、背景对比良好、微血管数量最密集的视野以200 倍视野计数此区域微血管数,分别计数3 个微血管密集区的微血管数求其均数来表示观察组织的微血管计数, 即MVD 。
1.4 统计学处理
采用SPSS17.0 统计软件包进行统计分析。 计量资料两组间均数比较采用t 检验, 检验水平p=0.05; 计量资料多组间均数比较采用方差检验,检验水平P=0.05。 两变量的相关分析采用Pearson 相关系数,检验水平P=0.05。
2 结果
浸润至浆膜层组EGFL7 阳性率为84.4%,显著高于未浸润至浆膜层组(46.2%),差异有统计学意义(P<0.05);有淋巴结转移组EGFL7 的阳性率为84.6%,显著高于无淋巴结转移组(57.9%),差异有统计学意义(P<0.05);EGFL7 的表达与肿瘤浸润深度及淋巴结转移呈正相关(P<0.05),与分化程度无关(P>0.05)(表1,图1, 2)
低分化胃癌组MVD 均值为37.62±10.42,高于高分化组(27.91±9.93)和中分化组(28.40±9.18),差异有统计学意义(P<0.05);浸润至浆膜层组MVD均值为34.25±10.43, 高于未浸润至浆膜层组(26.69±8.66),差异有统计学意义(P<0.05);有淋巴结转移组MVD 均值为33.00±9.99, 高于无淋巴结转移组(25.94±9.34),差异有统计学意义(P<0.05)。MVD 值与肿瘤分化程度、 浸润深度及有无淋巴结转移呈正相关(P<0.05)。 (表2,图2,3)
EGFL7 表达阳性的胃癌组织中MVD 均值为33.80±10.56,显著高于其阴性表达组(26.01 ±7.21)(P<0.05),经Pearson 分析发现,胃癌组织中MVD值与EGFL7 的表达呈正相关 (r=0.313, P=0.049)。(表3,图4)
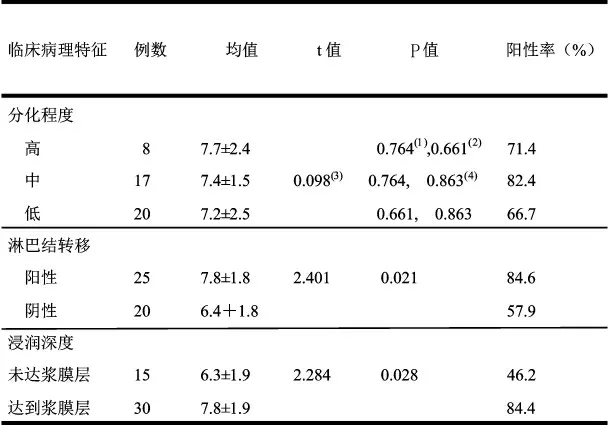
表1 胃腺癌中EGFL7 的表达与临床病理特征相关性
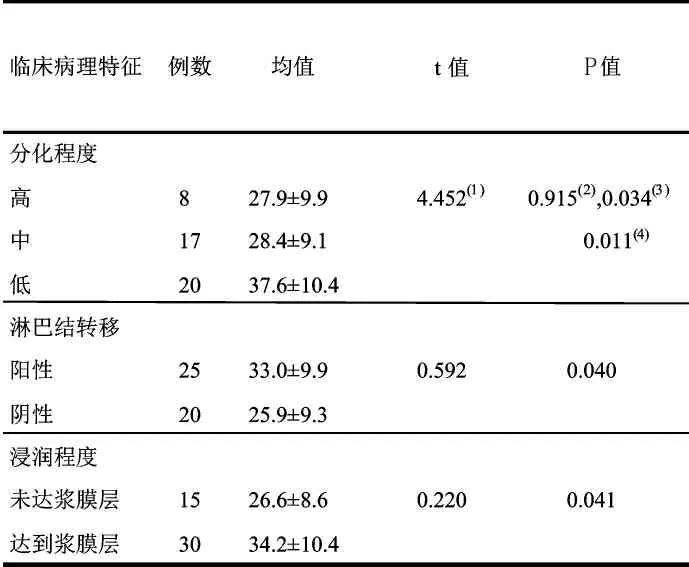
表2 胃癌组织中MVD 与临床病理相关性分析

表3 胃癌组织中EGFL7 的表达与MVD 之间的关系
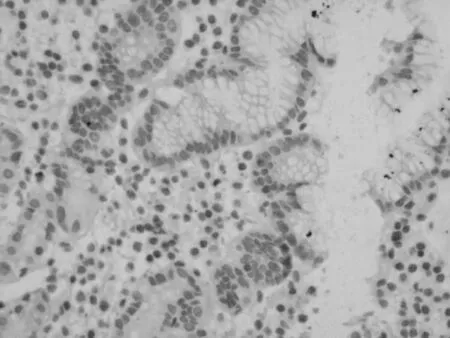
图1 正常胃组织中EGFL7 表达阴性(SP 法,200×)
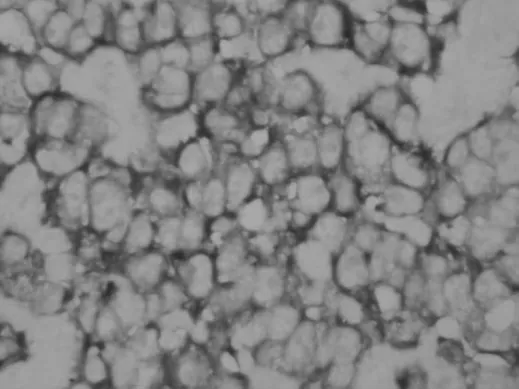
图2 胃癌组织中EGFL7 的表达阳性(SP 法,400×)
图3 FⅧ标记胃癌组织中微血管增生(SP 法,400×)
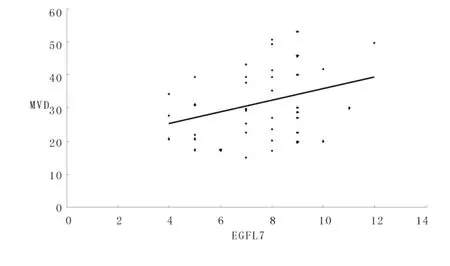
图4 胃癌组织中MVD 与EGFL7 表达相关性散点图
3 讨论
EGFL7 是肿瘤血管生成过程中一个新的必不可少的促血管生成因子。 以前的研究认为EGFL7的表达仅限于内皮系统[5],但目前部分研究发现一些肿瘤细胞中亦有EGFL7 的表达, 如前列腺癌[11]。本实验发现胃癌细胞中EGFL7 的表达阳性与淋巴结转移及浸润深度呈正相关(P<0.05)。 同时,胃癌组织中EGFL7 的表达程度与MVD 值成正相关。
本实验结果显示EGFL7 的表达随着瘤组织浸润层次的加深而增加, 同时MVD 也是随着浸润深度的增加而增大;肿瘤性新生血管的内皮细胞不够完整,肿瘤细胞容易通过其进入血管,通过静脉-淋巴管吻合处进入淋巴循环,导致淋巴结转移,而本实验发现: 有淋巴结转移的病例其EGFL7 的表达和MVD 值均大于无淋巴结转移的病例, 据此推测胃癌组织中EGFL7 的表达促进了肿瘤性血管的新生,促进了肿瘤的浸润、转移,阻断或降低EGFL7的表达,将可能减少肿瘤性血管的新生,从而阻止或延缓肿瘤的进展, 为临床治疗提供一个新的靶点。
[1] Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in mestastatic sites [J]. Nat Rev Cancer, 2002,2(8):562-572.
[2] 吕伟, 陈凛. 胃癌分子靶向治疗的现状与进展[J].世界华人消化杂志2007, 15(25): 2672-2678.
[3] Soncin F,Mattot V,Lionneton F,et al.VE -statin,an endothelial repressor of smooth muscles cell migration [J].EMBO J,2003,22(21):5700-5711.
[4] Park LH,Schmidt M,Jin SW,et al.The endothelial-cellderived secreted factor EGFL7 regulates vescular tube formation [J].Nature,2004,428(6984):754-758.
[5] Campagnolo L,Leahy A,Chitnis S,et al.EGFL7 is a chamoattractant for endothelial cells and is up-regulated in angiogenesis and arterial injury [J].American Journal of Pathology,2005,167(1):275-284.
[6] Morgenbesser SD, Dufault MR, Martin TS, et al.Characterization of EGFL7 expression and function in tumorigenesis and angiogenesis [C]. Proceedings of the American Association for Cancer Research Annual Meeting, 2005,46:1103.
[7] Huang CH, Li XJ, Zhou YZ, et al. Expression and clinical significance of EGFL7 in malignant glioma. [J]. J Cancer Res Clin Oncol. 2010, 136(11):1737-1743.
[8] Ko CD, Kim JS, Ko BG, et al. The meaning of the c-kit proto -oncogene product in malignant transformation in human mammary epithelium.Clin Exp Metastasis, 2003,20:593-597.
[9] Eroglu A, Sari A. Expression of c-kit proto-oncogene product in breast cancer tissues. Med Oncol, 2007, 24:169-174.
[10]Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN,Moore DH, Meli S, Gasparini G (1992) Tumor angiogenesis: a new signiWcant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst 84:1875-1887).
[11]Weidner N,Folkman J,Pozza F,et al. Tumor angiogenesis:a new significant and independent prognostic indicator in early stage breast carcinoma [J]. J Natl Cancer,1992.84(24):1875-1887.

