Ru-Rh/AC催化对苯二酚选择性加氢制备1,4-环己二醇
孙 亮,荣泽明,张文君,吕金昆,杜文强,王 越
(大连理工大学 化工与环境生命学部 精细化工国家重点实验室,辽宁 大连 116024)
环己二醇类化合物是一类重要的化工中间体,广泛应用于医药、农药和化妆品等行业[1-3]。其中,1,4-环己二醇作为医药中间体,可合成HMGCoA还原酶、GnⅡh/Ⅲa拮抗剂、肌醇磷酸酯抑制剂、琥珀酰磺胺噻唑和苯并三唑类药物等。光谱纯的1,4-环己二醇作为新材料单体,可用于合成液晶材料、有机电材料和生物控制器标识物等[4]。
源于石油的苯酚类产品产量大,价格低廉,因此以对苯二酚为原料制备1,4-环己二醇可显著提高其附加值,但国内外相关文献报道较少。Adkins等[5]以乙醇为溶剂,采用W-6 Raney Ni催化对苯二酚加氢制得1,4-环己二醇,但反应时间较长。文献[6]报道了将碱水溶液直接滴加到对苯二酚、Ni-Al合金和水的混合溶液中,对苯二酚被体系内生成的氢气还原的方法,但环己二醇的选择性最高仅为88%。王洪军等[7]采用Ru/C催化剂和乙醇溶剂,在150 ℃、5 MPa下反应2 h,对苯二酚的转化率为98.8%,目的产物1,4-环己二醇的选择性仅为77.7%。综上所述,采用催化加氢法由对苯二酚制备1,4-环己二醇具有反应步骤简单、产物与催化剂易于分离等优势,但目前存在反应条件苛刻、副产物较多等问题。因此,亟需开发活性高和选择性好的催化体系,使对苯二酚能在相对温和的反应条件下高选择性生成目的产物。
本工作以浸渍法制备的负载型纳米Ru-Rh/AC(AC为活性炭)为催化剂,考察了溶剂、反应温度、反应压力和催化剂用量对对苯二酚加氢制备1,4-环己二醇的影响,并进一步评价了催化剂的稳定性,同时对反应路径进行了初步研究。
1 实验部分
1.1 试剂与仪器
对苯二酚:AR,天津市大茂化学试剂厂;甲醇:AR,天津市博迪精细化工有限公司;乙醇、异丙醇和乙酸乙酯:AR,天津市富宇精细化工有限公司;四氢呋喃:AR,成都市西陇化工有限公司;AC粉末:比表面积1 200 m2/g,江苏竹溪活性炭有限公司;RuCl3·3H2O:有效物质RuCl3含量为(37±0.3)%(w),上海贺利氏工业技术材料有限公司;RhCl3·3H2O:有效物质RhCl3含量为38.51%(w),上海贺利氏工业技术材料有限公司。恒温水浴锅:巩义市英峪予华仪器厂;70 mL高压反应釜:大连理工大学化学工程研究所。
1.2 催化剂的制备
参照文献[8]报道的方法制备催化剂。在10 mL去离子水中加入计量的金属前体RuCl3·3H2O和/或RhCl3·3H2O(金属理论负载量均为2%(w),双金属中Ru与Rh的质量比为3∶1),剧烈搅拌下加入2 g AC粉末(比表面积为1 200 m2/g)进行吸附,2 h后在室温下缓慢加入过量一定倍数的NaBH4溶液进行还原。待还原完成后,经过滤、洗涤得到负载型纳米Ru/AC,Rh/AC,Ru-Rh/AC催化剂。
1.3 催化剂的表征
采用Perkin Elmer公司Optima 2000DV型电感耦合等离子体原子发射光谱仪分析催化剂的金属实际负载量,催化剂经微波消解及冷却后,进行稀释和过滤,并定容至50 mL进行分析。采用理学公司D/max-2400型全自动X射线衍射仪表征催化剂试样的微观结构,测试条件:Cu靶(λ=0.154 06 nm)、管电压40 kV、管电流100 mA、扫描速率5 (°)/min。采用JEOL公司JEM-2000EX型透射电子显微镜观测试样的形貌,发射电压120 kV,测试前将试样分散到乙醇溶剂中,超声振荡处理10 min后,用滴管吸取1~2滴悬浮液,滴加在铜网上,烘干后观测。
1.4 加氢实验及产物分析方法
液相加氢反应在75 mL不锈钢高压反应釜中进行,恒温水浴温度控制精度为 ±1 ℃。在高压反应釜中依次加入溶剂、对苯二酚和催化剂,密封反应釜,用氮气和氢气各置换3次,充入一定压力的氢气,将反应釜放入恒温水浴中。当温度升至设定值时,将氢气压力升至设定值,开动搅拌并计时反应。待反应结束后,迅速将反应釜冷却至室温,放空,开釜取样分析。
采用温岭福立分析仪器有限公司9790型气相色谱仪进行定量分析,面积归一化法定量。分析条件:FID检测;PEG毛细管柱(30 m×0.32 mm×0.5 μm);气化室温度280 ℃;检测器温度280 ℃;柱温采用程序升温,100 ℃下保持10 min,以10 ℃/min的速率程序升温至210 ℃,保留20 min。采用惠普公司HP6890/MSD5793型气-质联用仪进行定性分析。
2 结果与讨论
2.1 催化剂的表征结果
由ICP-AES分析结果可知,Ru-Rh/AC催化剂中Ru的质量分数为1.11%,Rh的质量分数为0.38%,两者质量比为2.92∶1,与理论值3∶1非常接近。
Ru-Rh/AC催化剂的TEM照片见图1。

图1 Ru-Rh/AC催化剂的TEM照片Fig.1 TEM image of the Ru-Rh/AC catalyst.
由图1可见,粒径为2~5 nm的金属颗粒均匀分散在AC载体表面,表明该催化剂具有平均粒径小、分布均匀等特点。
AC和Ru-Rh/AC催化剂的XRD谱图见图2。由图2可见,AC载体在2θ=44.5°处的衍射峰为(101)晶面的衍射峰;Ru-Rh/AC催化剂除该衍射峰外,还在2θ=42.0°附近出现一弥散衍射峰,对应于Ru-Rh合金的特征衍射峰[9],该峰并不明显,表明金属粒径较小或以非晶态结构存在[10]。

图2 AC(a)和Ru-Rh/AC催化剂(b)的XRD谱图Fig.2 XRD patterns of the AC(a) and Ru-Rh/AC catalyst(b).
2.2 不同催化剂的性能
催化剂对对苯二酚加氢反应的影响见表1。由表1可见,在温和反应条件下反应30 min,催化剂的活性大小顺序为:Ru-Rh/AC>Rh/AC>Ru/AC,说明Ru-Rh合金协同效应的存在明显提高了催化剂的加氢反应活性,这可归因于双金属催化剂上氢键键能较单金属的弱,更利于氢气的活化[11-12]。因此,综合考虑催化剂的活性和目的产物选择性,采用Ru-Rh/AC催化剂考察其他参数对该反应的影响。
2.3 反应条件的影响
2.3.1 溶剂的影响
考虑到对苯二酚的溶解性及溶剂极性,分别选取四氢呋喃、乙酸乙酯、甲醇、乙醇和异丙醇作为溶剂。溶剂对对苯二酚加氢反应的影响见表2。由表2可知,在相同反应条件下,采用不同溶剂时反应的活性大小顺序为:异丙醇>乙醇>乙酸乙酯>四氢呋喃>甲醇。以异丙醇为溶剂时,对苯二酚转化率最高,推测原因是异丙醇具有较好的溶解和传递氢原子的能力,在反应过程中可作为传递氢的介质。因此,后续实验以异丙醇为溶剂。

表1 催化剂对对苯二酚加氢反应的影响Table 1 Effect of catalysts on the hydrogenation of hydroquinone

表2 溶剂对对苯二酚加氢反应的影响Table 2 Effect of solvents on the hydrogenation of hydroquinone
2.3.2 反应温度的影响
反应温度对对苯二酚加氢反应的影响见图3。由图3可知,随反应温度的升高,对苯二酚的转化率逐渐增加,当反应温度高于80 ℃时,增加的幅度趋缓;此外,随反应温度的升高,目的产物1,4-环己二醇的选择性逐渐增加。因此,综合考虑反应速率和目的产物选择性,选择适宜的反应温度为80 ℃。

图3 反应温度对对苯二酚加氢反应的影响Fig.3 Effect of reaction temperature on the hydrogenation of hydroquinone.
2.3.3 反应压力的影响
反应压力对对苯二酚加氢反应的影响见图4。由图4可见,在相同反应时间内,随反应压力的升高,对苯二酚转化率逐渐增加,当反应压力高于1.0 MPa时,增幅趋缓;此外,随反应压力的升高,1,4-环己二醇选择性逐渐增加。综合考虑反应压力对设备材质的要求,选择反应压力为1.0 MPa较适宜。

图4 反应压力对对苯二酚加氢反应的影响Fig.4 Effect of reaction pressure on the hydrogenation of hydroquinone.
2.3.4 催化剂用量的影响
Ru-Rh/AC催化剂用量对对苯二酚加氢反应的影响见图5。由图5可见,在相同反应时间内,随Ru-Rh/AC催化剂用量的增加,对苯二酚转化率和1,4-环己二醇选择性均逐渐增加。当催化剂中Ru-Rh与对苯二酚的摩尔比小于等于0.005时,对苯二酚转化率与催化剂用量近似呈线性关系;当Ru-Rh与对苯二酚的摩尔比大于0.005时,对苯二酚转化率增幅趋缓,且1,4-环己二醇选择性无明显变化。因此,Ru-Rh与对苯二酚的摩尔比为0.005时催化剂用量较合适。

图5 Ru-Rh/AC催化剂用量对对苯二酚加氢反应的影响Fig.5 Influence of Ru-Rh/AC catalyst dosage on the hydrogenation of hydroquinone.
2.4 催化剂的稳定性
稳定性是衡量催化剂性能的重要指标之一,在优化反应条件下,考察了Ru-Rh/AC催化剂的稳定性,实验结果见图6。

图6 Ru-Rh/AC催化剂的稳定性Fig.6 Stability of the Ru-Rh/AC catalyst.
由图6可见,Ru-Rh/AC催化剂连续使用5次,对苯二酚转化率均为100%,前3次1,4-环己二醇选择性均在95.5%左右。随催化剂使用次数的增加,1,4-环己二醇选择性略有下降,4-羟基环己酮未能全部转化为目的产物,副产物环己醇的选择性维持在4.5%左右。由此可见,Ru-Rh/AC双金属催化剂在对苯二酚加氢制备1,4-环己二醇的反应中表现出良好的活性和稳定性。Ru和Rh均属于稀有贵金属,价格较昂贵。但本实验所制备的Ru-Rh/AC催化剂表现出良好的稳定性,连续使用5次活性保持不变,继续使用可进一步降低催化剂的成本。此外,随着近年来废催化剂中贵金属回收技术的不断改进(采用溶剂萃取法回收Rh的纯度达99.99%,直收率为90%~95%[13]),使贵金属的回收再利用率得到了提升,提高了使用贵金属催化剂的经济性。
2.5 加氢路径分析
在上述优化条件下,采用Ru-Rh/AC催化剂催化对苯二酚加氢制备1,4-环己二醇,反应过程中各组分含量随时间的变化曲线见图7。由图7可见,随反应时间的延长,对苯二酚含量逐渐降低,加氢过程中主要生成目的产物1,4-环己二醇、中间产物4-羟基环己酮和副产环己醇。在反应开始的35 min内,加氢反应速率较快,对苯二酚转化率达85%以上;继续延长反应时间,反应速率减慢,这主要归因于传质因素的影响。随着反应的进行,4-羟基环己酮逐渐转化为1,4-环己二醇;当对苯二酚全部转化后,副产物环己醇的选择性基本保持不变;当4-羟基环已酮全部转化后,1,4-环己二醇选择性为95.5%。
王洪军等[7,14]提出副产物环己醇是由1,4-环己二醇脱去一分子水生成3-环己烯醇,并经进一步加氢得到的。但在该催化体系作用下,当反应达到终点并进一步延长反应时间时,1,4-环己二醇并未转化为副产物环己醇,因此参考Hilton提出的苯酚加氢机理[15],对该反应路径进行了初步研究,结果如图8所示。由图8可见,对苯二酚经加氢后可能生成两种中间体A和B,经进一步深度加氢生成目的产物1,4-环己二醇(路线Ⅰ);中间体B由于烯醇式结构不稳定重排生成4-羟基环己酮,4-羟基环己酮继续加氢生成1,4-环己二醇(路线Ⅱ);中间体A和B经加氢裂解生成环己烯醇中间体和水,环己烯醇加氢后生成副产物环己醇(路线Ⅲ)。A、B和环己烯醇为不稳定中间体,由于生成后在氢气气氛下被快速加氢,在反应产物中检测不到它们的存在[16]。

图7 对苯二酚加氢过程中各组分含量随时间的变化曲线Fig.7 Content-time plots for the hydrogenation of hydroquinone.
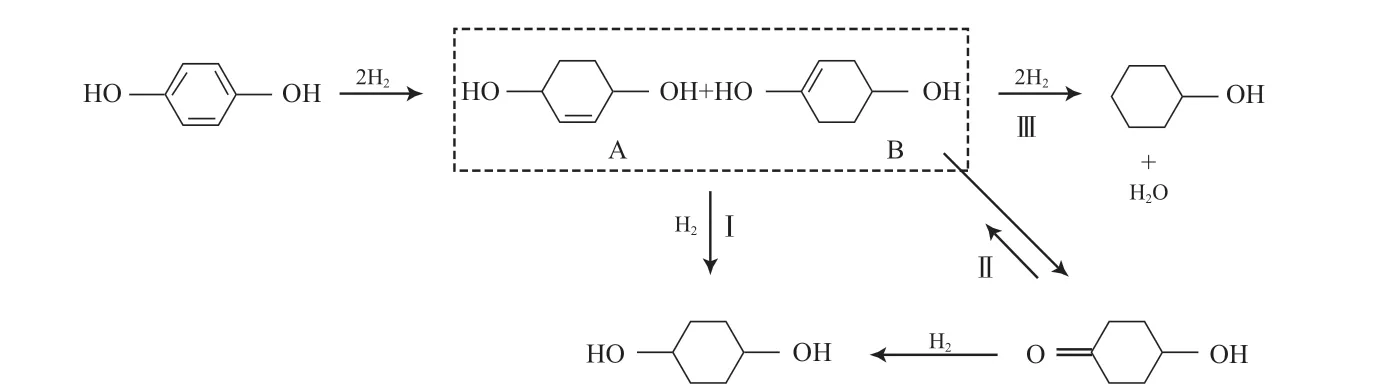
图8 对苯二酚加氢反应路径Fig.8 Proposed reaction pathes for the hydrogenation of hydroquinone.
3 结论
1)Ru-Rh/AC双金属催化剂对对苯二酚加氢反应的催化活性明显优于单组分金属催化剂。
2)在Ru-Rh/AC催化体系下,对苯二酚加氢制备1,4-环己二醇反应的优化条件为:以异丙醇为溶剂、催化剂中Ru-Rh与对苯二酚的摩尔比为0.005、反应温度80 ℃、反应压力1.0 MPa。在此条件下反应1 h,对苯二酚转化率达100%,1,4-环己二醇选择性可达95.5%。Ru-Rh/AC双金属催化剂在对苯二酚加氢制备1,4-环己二醇的反应中有良好的稳定性。
3)根据反应产物随反应时间的变化曲线,推断出对苯二酚加氢反应路径:首先,对苯二酚经不完全加氢制得两种中间体;然后经直接加氢和加氢脱水分别制得目的产物1,4-环己二醇和副产物环己醇,其中烯醇式中间体能重排生成4-羟基环己酮,4-羟基环己酮进一步加氢生成1,4-环己二醇。
[1] 孙利民,周彩荣,蒋登高,等. 1,2-环己二醇及其衍生物的合成与应用[J]. 河南化工,2005,22(3):l - 4.
[2] 王飞军,姜发琴,鞠彩霞,等. 间苯二酚催化加氢制备1,3-环己二醇的研究[J]. 中国矿业大学学报,2003,32(6):722 - 724.
[3] Maegawa T,Akashi A,Yaguchi K,et al. Efficient and Practical Arene Hydrogenation by Heterogeneous Catalysts Under Mild Conditions[J]. Chem Eur,2009,15(28):6953 -6963.
[4] 医药和液晶材料单体——1,4-环己二醇[J]. 试剂与精细化学品,2006(2):13.
[5] Adkins H,Billica H R. The Preparation of Raney Nickel Catalysts and Their Use Under Conditions Comparable with Those for Platinum and Palladium Catalysts[J]. J Am Chem Soc,1948,70(2):695 - 698.
[6] 复旦大学. 环己二醇类化合物的制造方法:中国,1793095 A[P]. 2006-06-28.
[7] 王洪军,汪星全,张丽,等. 对苯二酚催化加氢制备1,4-环己二醇的研究[J]. 分子催化,2010,24(4):315 - 321.
[8] 闫世润,乔明华,范康年. 非晶态合金催化剂的研究进展[J]. 石油化工,2007,36(3):213 - 220.
[9] Wu Mingli,Chen Donghwang,Huang Tingchia. Synthesis of Au/Pd Bimetallic Nanoparticles in Reverse Micelles[J]. Langmuir,2001,17(13):3877 - 3883.
[10] Yamashita H,Yoshikawa M,Funabiki T,et al. Catalysis by Amorphous Metal Alloys[J]. J Chem Soc,Faraday Trans,1986,82(6):1771 - 1780.
[11] Greeley J,Mavrikakis M. Alloy Catalysts Designed from First Principles[J]. Nat Mater,2004,3:810 - 815.
[12] Greeley J,Mavrikakis M. Near-Surface Alloys for Hydrogen Fuel Cell Applications[J]. Catal Today,2006,111(1):52 - 58.
[13] 中国有色金属工业总公司昆明贵金属研究所. 粗铑及含铑量高的合金废料的溶解与提纯:中国,1031567[P]. 1989-03-08.
[14] Li Guixian,Dong Peng,Wang Xiaorui,et al. Study of Catalytic Hydrogenation of 1,4-Benzenediol over Ru/HY Catalyst[J]. J Mol Catal,2012,26(1):26 - 31.
[15] Smith H A,Stump B L. A Study of the Catalytic Hydrogenation of Hydroxybenzenes over Platinum and Rhodium Catalysts[J]. J Am Chem Soc,1961,83(12):2739 - 2743.
[16] Bovkun T T,Sasson Y,Blum J. Conversion of Chlorophenols into Cyclohexane by a Recyclable Pd-Rh Catalyst[J]. J Mol Catal A:Chem,2005,242(1):68 - 73.

