甲醇芳构化的研究Ⅰ. 反应热力学分析
张贵泉,白 婷,屈文婷,张巧燕,陈腾飞,张 昕
(西北大学 化工学院,陕西 西安 710069)
轻质芳烃(苯、甲苯和二甲苯)作为石油化工的高附加值产品,广泛应用于有机、高分子化学工业。全球石油资源日益紧张,汽油需求量不断增加,通过石油加工得到的芳烃产量的增速必然下降,可能无法满足轻质芳烃市场需求的增长,将导致全球轻质芳烃供应不足。因此,必须寻找增产芳烃的新途径。由甲醇生产芳烃是一条有益的工艺路线,可利用煤炭资源弥补石油资源的不足来生产基本化工原料。近年来,甲醇制芳烃催化剂及相关技术逐渐引起研究者和企业的关注。
目前,甲醇催化转化制轻质芳烃的研究多见于专利报道。已经研发出的催化剂主要是金属(Ag,Zn,Mn,Cr,Cu,Ga等)改性的分子筛(HZSM-5、HZSM-11和硅铝磷分子筛等)催化剂[1-4]。在适宜的反应条件下,甲醇转化率可达到99%,芳烃的最高收率约为55%。到目前为止,甲醇芳构化研究工作主要集中在高效催化剂的研制,对该反应的热力学研究鲜有报道。若能认清甲醇芳构化反应的热力学规律,将会对催化剂的研制和反应条件的优化提供重要的理论指导。
本工作采用“平衡常数法”对甲醇芳构化反应的反应热、Gibbs自由能变和热力学平衡常数进行了计算,并借助MATLAB软件计算得到了不同温度和甲醇分压下达到化学平衡时反应产物的平衡组成,讨论了反应的热力学变化规律。
1 热力学计算方法
1.1 反应机理
Dahl等[5]在研究甲醇转化反应时提出了“烃池机理”,认为甲醇在催化剂作用下首先生成一些相对分子质量较大的烃类中间物种,中间物种经甲基化反应生成低碳烃。该反应机理得到了研究者的广泛认同,并通过大量研究得出多甲基苯是甲醇制烃反应的中间物种[6-7]。甲醇芳构化涉及的物种主要有:H2,H2O,CH4,C2H6,C3H8,C4H10,C5H12,C2H4,C3H6,C4H8,C6H6,C7H8,C8H10等,结合“烃池机理”和甲醇芳构化的可能反应途径[8],获得甲醇芳构化体系包含的独立反应方程式:
主反应
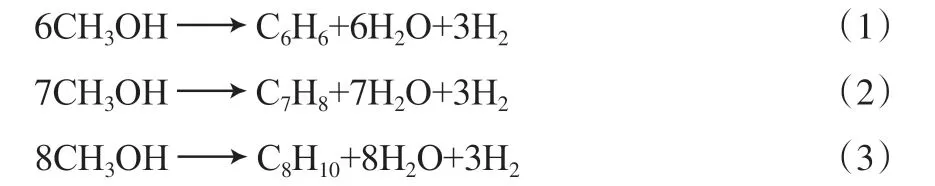
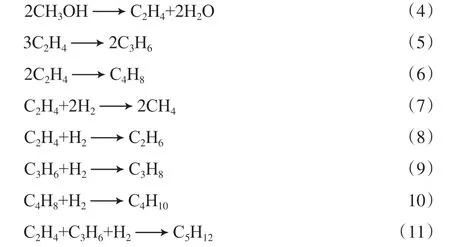
副反应
1.2 反应热力学参数和反应平衡常数的计算方法
反应热的计算可通过产物和反应物的标准生成热的变化求取[9]:

式中,ΔH为反应热,kJ/mol;ΔfH为物质的标准生成热,kJ/mol;μ为反应中各物质的化学计量数。实际反应热效应可看作恒压下的焓变,可使用定压摩尔热容的变化值对温度积分来求得较精确的焓变。采用4参数的摩尔定压热容计算ΔH:

式中,Cp为摩尔定压热容,J/(mol·K);ΔH0为积分常数,kJ/mol,可通过将298 K时的ΔfH代入式(14)求得,进而求得其他适用温度下的热效应数据;a,b,c,d为Cp的参数;T为反应温度,K。
反应Gibbs自由能变的计算可通过产物和反应物的标准Gibbs自由能变求取:

式中,ΔG为反应Gibbs自由能变,kJ/mol;ΔfG为物质的标准Gibbs自由能变,kJ/mol。实际反应的Gibbs自由能变和热力学平衡常数可通过式(16)~(18)计算:
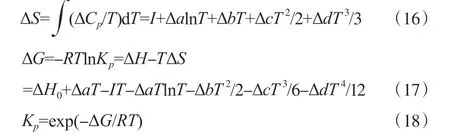
式中,ΔS为反应的熵变,J/(mol·K);Kp为热力学平衡常数;I为积分常数,J/mol,可通过将298 K时的ΔfG代入式(17)求得,进而求得其他适用温度下的标准反应自由焓数据;R为气体常数,J/(mol·K)。相关物质的热化学性质[10]见表1。各反应的积分常数值及Cp参数变化值见表2。
2 热力学计算结果及讨论
2.1 反应热、Gibbs自由能变和热力学平衡常数
不同温度下各反应的反应热、Gibbs自由能变和热力学平衡常数见表3~5。甲醇制轻质芳烃反应(反应1~3)在低温下均为放热反应,随反应温度的升高反应热急剧下降,可能是由于苯、甲苯和二甲苯等产物的反应热容受温度影响较大。在考察的温度范围内,3个主反应均可自发进行,同时具有非常大的反应平衡常数,因此可认为甲醇完全转化。就甲醇制轻质芳烃反应而言,反应1在反应温度小于等于723 K时为放热反应,反应温度高于723 K时为吸热反应;反应2在反应温度小于等于823 K时为放热反应,反应温度高于823 K时为吸热反应;反应3在考察温度范围内均为吸热反应。另一方面,随反应温度的升高,反应1和反应2的热力学平衡常数先减小后增大,反应3的热力学平衡常数逐渐减小。因此,甲醇制轻质芳烃反应受反应温度的影响较为复杂。总体来说,较低的反应温度有利于甲醇制轻质芳烃(苯、甲苯和二甲苯)。
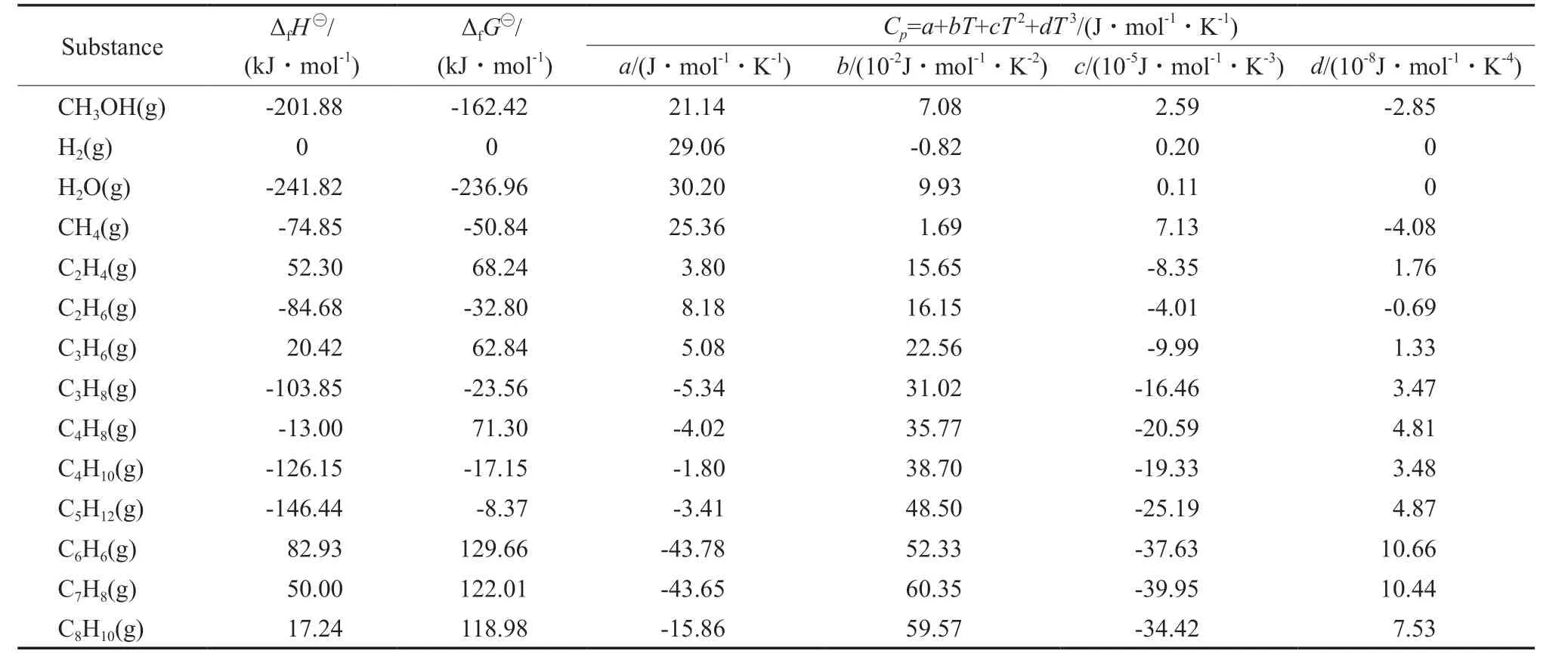
表1 相关物质的热化学性质[10]Table 1 Thermochemical properties of some concerned substances[10]

表2 各反应的积分常数值及Cp参数变化值Table 2 Integral constants(ΔH0,I) and change of heat capacity parameters of the above reactions

表3 不同温度下各反应的反应热Table 3 Reaction heats(ΔH) of the reactions at different temperatures
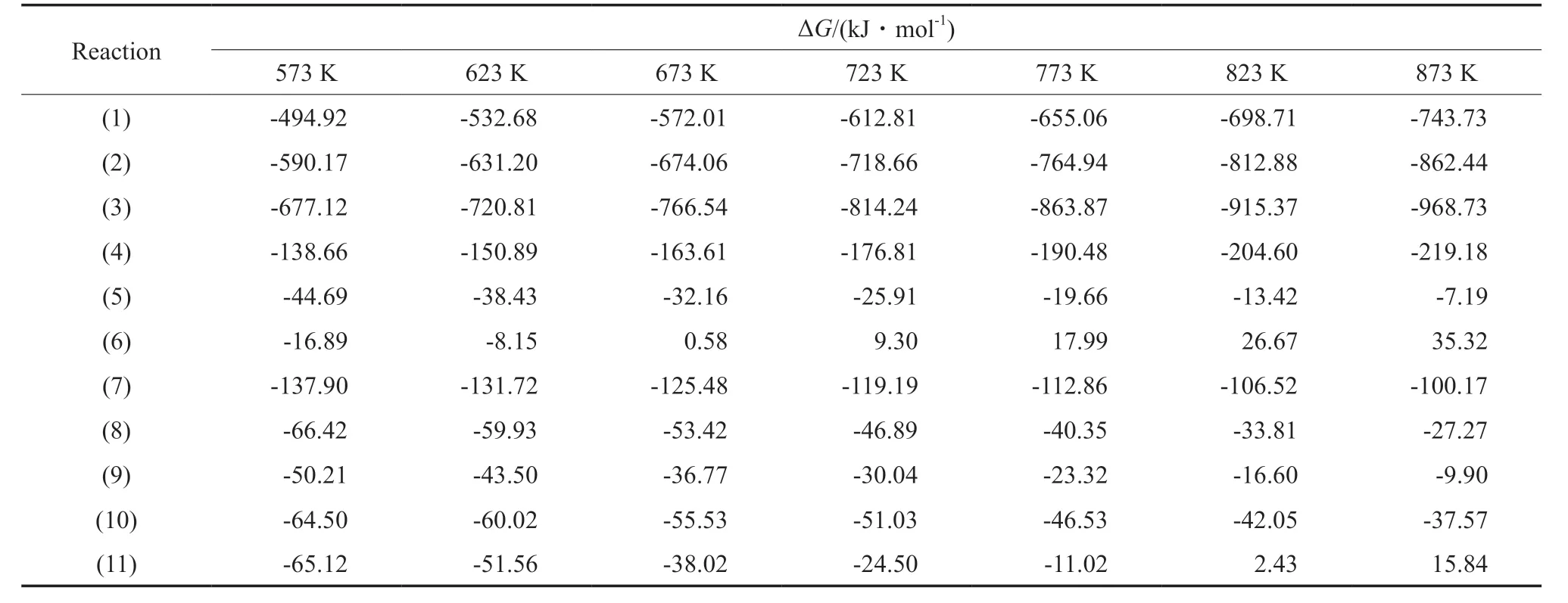
表4 不同温度下各反应的Gibbs自由能变Table 4 Gibbs free energy changes(ΔG) of the reactions at different temperatures
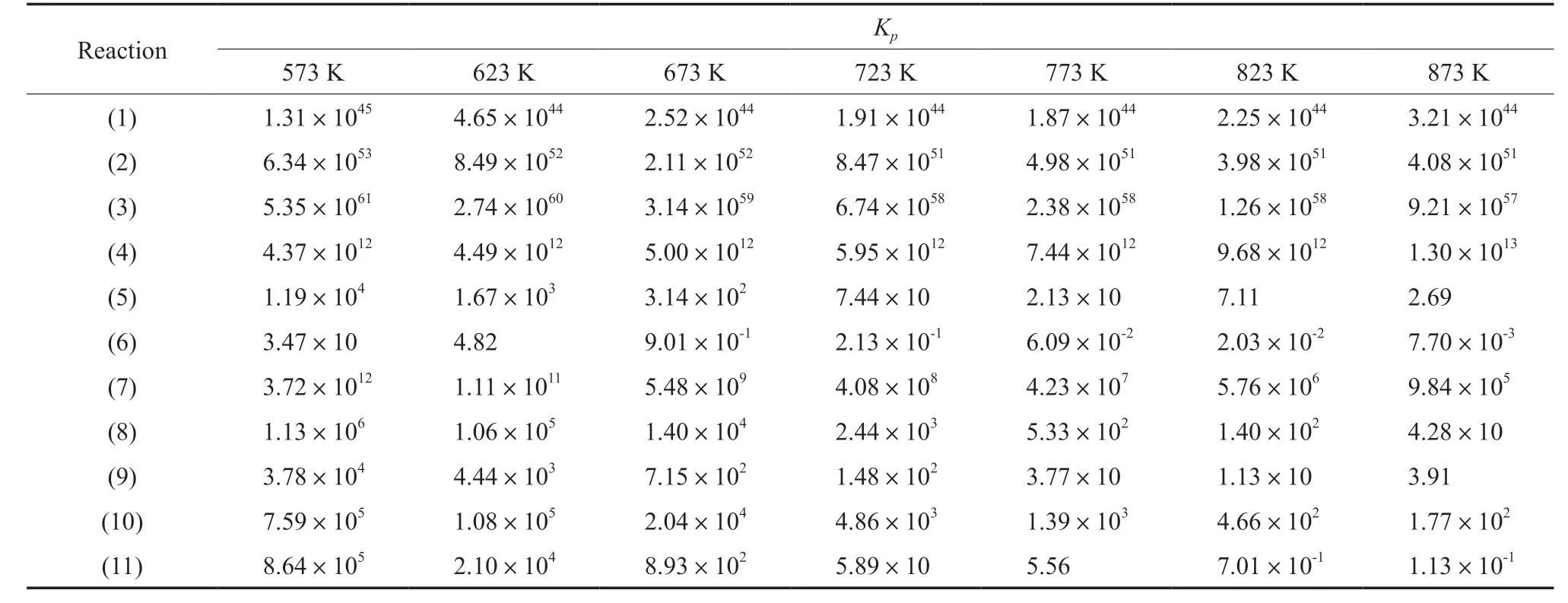
表5 不同温度下各反应的热力学平衡常数Table 5 Equilibrium constants(Kp) of the reactions at different temperatures
在考察温度范围内,除反应4外,其余副反应均为放热反应,且具有较大的放热量;反应6和反应11分别在反应温度大于等于623 K和823 K时为非自发反应,其余副反应均可自发进行。随反应温度的升高,反应4的热力学平衡常数增大,其他副反应的热力学平衡常数逐渐减小。在相同反应温度下,各副反应反应热多高于主反应,因此其较高的放热量可能抑制主反应的发生。因此,需使用高效催化剂并选择适宜的反应温度来优化反应动力学行为,从而促进主反应并抑制副反应的进行。
2.2 反应温度对反应热力学平衡组成的影响
不同温度下反应物和产物的热力学平衡组成见表6。由表6可见,在考察的温度范围内,甲醇的平衡组成为0,即甲醇转化率达到100%,这与主反应具有较高反应平衡常数相一致。随反应温度的升高,二甲苯的平衡组成不断增加,甲苯的平衡组成不断减小,苯的平衡组成略有减小。由此可见,通过改变反应温度可调变各反应产物的平衡组成,较高反应温度有利于二甲苯的生成,较低反应温度则有利于甲苯的生成。

表6 不同温度下反应物和产物的热力学平衡组成Table 6 Equilibrium compositions of the reactant and products at different temperatures
2.3 甲醇分压对反应热力学平衡组成的影响
不同甲醇分压对反应物和产物热力学平衡组成的影响见表7。由表7可见,在考察的甲醇分压范围内,甲醇均100%转化,因此甲醇分压对甲醇的转化率无明显影响。随甲醇分压的增大,二甲苯的平衡组成增加,甲苯的平衡组成逐渐减小,苯的平衡组成略有减小。由此可见,甲醇分压同样对各反应产物的热力学平衡组成有一定的影响。

表7 不同甲醇分压下反应物和产物的热力学平衡组成Table 7 Equilibrium compositions of the reactant and products at different methanol partial pressures
3 结论
1)热力学计算结果表明,反应温度是影响甲醇芳构化反应的重要因素,甲醇制芳烃大多数反应为强放热反应,较高的放热量可能抑制主反应的发生,因此降低反应温度有利于主反应的进行。
2)反应温度和甲醇分压影响甲醇芳构化反应的热力学平衡组成。升高反应温度及提高甲醇分压均有利于二甲苯平衡组成的增加,而甲苯的平衡组成减小。
[1] 天脊煤化工集团有限公司,青岛大学. 一种提高甲醇芳构化制取芳烃选择性的工艺及其催化剂的制备方法:中国,200910135643[P]. 2009-10-07.
[2] 清华大学. 一种甲醇或二甲醚转化制取芳烃的系统与工艺:中国,201010146915[P]. 2010-04-14.
[3] 中国海洋石油总公司,中海油新能源投资有限责任公司,中国科学院大连化学物理研究所. 一种甲醇转化制备对二甲苯和低碳烯烃的催化剂及其制备方法与应用:中国,201010110868[P]. 2010-02-10.
[4] Ni Youming,Sun Aiming,Wu Xiaoling,et al. Aromatization of Methanol over La/Zn/HZSM-5 Catalysts[J]. Chin J Chem Eng,2011,19(3):439 - 445.
[5] Dahl I M,Kolboe S. On the Reaction-Mechanism for Propene Formation in the MTO Reaction over SAPO-34[J]. Catal Lett,1993,20(3):329 - 336.
[6] Song Weiguo,Haw J F,Nicholas J B,et al. Methylbenzenes are the Organic Reaction Centers for Methanol-to-Olefin Catalysis on HSAPO-34[J]. J Am Chem Soc,2000,122(43):10726 - 10727.
[7] Alain Sassi,Wildman M A,Hee Jung Ahn,et al. Methylbenzene Chemistry on Zeolite H-Beta:Multiple Insights into Methanol-to-Olefin Catalysis[J]. J Phys Chem B,2002,106(9):2294 - 2303.
[8] Nagabhatla V,Sandeep K S,Jitendra K,et al. Catalytic Performance of Nano Crystalline H-ZSM-5 in Ethanol to Gasoline(ETG) Reaction[J]. Fuel,2012,95:298 - 304.
[9] 陈钟秀,顾飞燕. 化工热力学[M]. 北京:化学工业出版社,1993:417 - 424.
[10] 时钧,汪家鼎,余国琮,等. 化学工程手册[M]. 北京:化学工业出版社,1996:31 - 41.

