晚钠电流在兔心力衰竭模型室性心律失常中的作用*
苟志平, 孙玉真, 张存泰, 全小庆, 吕家高,白 融, 王金丽, 赵俊燕, 王照华, 肖建明
华中科技大学同济医学院附属同济医院1综合科3心内科4急诊科,武汉 430030
2新疆石河子大学医学院,石河子 832000
5广东省东莞市太平人民医院心内科,东莞 523000
心力衰竭时心肌细胞的电机械活动不稳定易导致室性心律失常和猝死的发生。最近研究发现晚钠电流(INa-L)在长QT 综合征(long QT syndrome,LQTS)心律失常的发生中起着重要作用[1],由于心衰时也存在QT 间期的延长[2],因此本研究拟探讨INa-L在心力衰竭室性心律失常发生中的作用。通过缩窄兔腹主动脉建立心力衰竭模型,观察增强或阻滞INa-L后心力衰竭兔室性心律失常的变化情况,并深入探讨其作用机制,以期为寻找心衰时心律失常新的治疗靶点提供实验依据。
1 材料与方法
1.1 试剂及溶液组成
海葵毒素(ATX-Ⅱ)、雷诺嗪购自Sigma公司,其他试剂为分析纯。正常蒂罗德液(mmol/L):NaCl 129.0,KCl 4.0,NaH2PO40.9,NaHCO320.0,CaCl21.8,MgSO40.5,葡萄糖5.5。高钾停跳液(mmol/L):NaCl 109.0,KCl 24.0,NaH2PO40.9,NaHCO320.0,CaCl21.8,MgSO40.5,葡萄糖5.5。上述两种液体均用95%O2和5%CO2气体饱和,调pH 值至7.4。
1.2 动物模型制备及分组
实验用新西兰大耳白兔40只,雌雄不拘,体重2.0~2.5kg,由华中科技大学同济医学院实验动物学部提供。随机分为假手术组、心衰组、ATX-Ⅱ组及雷诺嗪组等,每组10只。心衰组、ATX-Ⅱ组及雷诺嗪组以20%乌拉坦+3%戊巴比妥钠(1mL/kg)耳缘静脉注射全身麻醉,侧腹部切口,暴露腹主动脉,在左肾动脉开口以上,以4号丝线缩窄腹主动脉60%~70%,假手术组除不行腹主动脉缩窄外其他操作同以上3组。术中严格无菌操作,术后肌注青霉素80万U 抗感染3d,普通饲料喂养4个月。
1.3 心脏超声检查
术后4个月做心脏超声检查。以3%戊巴比妥钠3mL耳缘静脉注射麻醉,胸部脱毛备皮,右侧卧位固定,采集心电信号于胸骨右缘行左室长轴超声心动图检查(GE Vivid 7超声诊断仪),测量舒张期左室后壁及室间隔厚度、左室舒张末期前后径,计算左心室射血分数(LVEF)。依据心脏射血分数评价心功能。
1.4 制备左室楔形心肌块
心力衰竭模型制备成功后,依据本实验室既往方法[3]制备兔左室楔形心肌组织块的灌注模型:肝素抗凝后,3%戊巴比妥钠耳缘静脉注射麻醉,迅速开胸取出心脏放入4℃高钾停跳液中,选取左冠状动脉左旋支为灌注动脉,插管灌注高钾停跳液,在充分灌注区域内,沿灌注动脉截取楔形心肌块组织。随后将修剪好的心肌块固定在装满正常蒂罗德液的浴槽中,温度为(35.7±0.2)℃,通过蠕动泵用正常的蒂罗德液持续灌注楔形心肌组织块,调节蠕动泵流速使灌注压保持35~45mmHg。基础步长1 000 ms起搏直到电生理稳定(通常1h),此后假手术组和心衰组继续灌注正常蒂罗德液,ATX-Ⅱ组灌注含10nmol/L ATX-Ⅱ的蒂罗德液,雷诺嗪组灌注含20μmol/L雷诺嗪的蒂罗德液,以双极电极程序刺激起搏心肌块心内膜并同时记录心内膜、心外膜心肌细胞跨膜动作电位、跨室壁心电图,电生理参数采用RM6240B型多道生理信号采集处理系统(成都仪器厂)记录。
实验前称兔体重(BW),实验结束后吸净心肌块表面液体,利用精密电子称称量左心室重量(LVW),全心室重量(HW)并计算LVW 与BW 比值,利用游离标尺测量左室游离壁厚度(LVFW)。记录实验结果。
QT 间期:为起搏信号到跨室壁心电图T 波与基线交叉点间的距离;动作电位复极90%时程(APD90):动作电位0期到复极至90%振幅的水平距离;EAD:早期后除极。
1.5 统计学处理
2 结果
2.1 实验动物超声心动图检查
左室长轴切面超声心动图检查结果显示(图1),与假手术兔相比,心衰模型兔左室后壁舒张期厚度和室间隔舒张期厚度均显著增加,左室舒张末期前后径明显增宽,LVEF[(0.76±0.07)vs.(0.41±0.12),P<0.01)]显著降低,差异均具有统计学意义。超声检查结果提示兔心力衰竭模型制备成功。
2.2 各组心脏解剖学参数比较
与假手术组相比,心衰组、ATX-Ⅱ组、雷诺嗪组兔的心脏外形明显增大,且左心室重量及其与体重的比率、左心室游离壁厚度均明显增加,提示兔心室肌肥厚。见表1。
2.3 各组外膜APD90、内膜APD90及QT间期的比较
兔左室楔形心肌块灌注模型在2 000 ms刺激下各组外膜APD90、内膜APD90及QT 间期见图2。与假手术组相比,心衰组、雷诺嗪组、ATX-Ⅱ组外膜APD90、内膜APD90及QT 间期均明显延长(均P<0.05);心衰兔加入ATX-Ⅱ后心外膜APD90、内膜APD90及QT 间期进一步延长(均P<0.05);然而心衰兔加入雷诺嗪后其心外膜APD90、内膜APD90及QT 间期均有明显缩短(均P<0.05)。说明心衰时兔心室肌的外膜APD90、内膜APD90、QT 间期均延长,且INa-L增强剂ATX-Ⅱ进一步增加心室肌的外膜APD90、内膜APD90及QT 间期,而阻滞剂雷诺嗪却可以减少心衰模型心室肌的外膜APD90、内膜APD90及QT 间期。

图1 假手术与心力衰竭模型兔左室长轴切面超声心动图Fig.1 Left ventricular long axis echocardiogram in sham-operated and HF groups
表1 各组兔心脏解剖学参数的结果(±s,n=10)Table 1 The rabbit cardiac anatomy parameters in each group(±s,n=10)
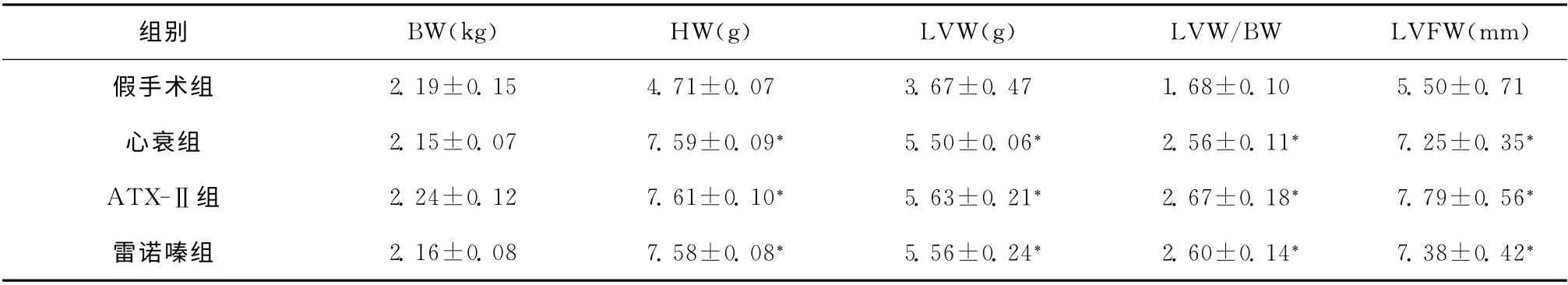
表1 各组兔心脏解剖学参数的结果(±s,n=10)Table 1 The rabbit cardiac anatomy parameters in each group(±s,n=10)
与假手术组比较,*P<0.05
组别BW(kg)HW(g)LVW(g)LVW/BW LVFW(mm)0±0.71心衰组2.15±0.07 7.59±0.09*5.50±0.06*2.56±0.11*7.25±0.35*ATX-Ⅱ组2.24±0.12 7.61±0.10*5.63±0.21*2.67±0.18*7.79±0.56*雷诺嗪组2.16±0.08 7.58±0.08*5.56±0.24*2.60±0.14*7.38±0.42假手术组2.19±0.15 4.71±0.07 3.67±0.47 1.68±0.10 5.5*
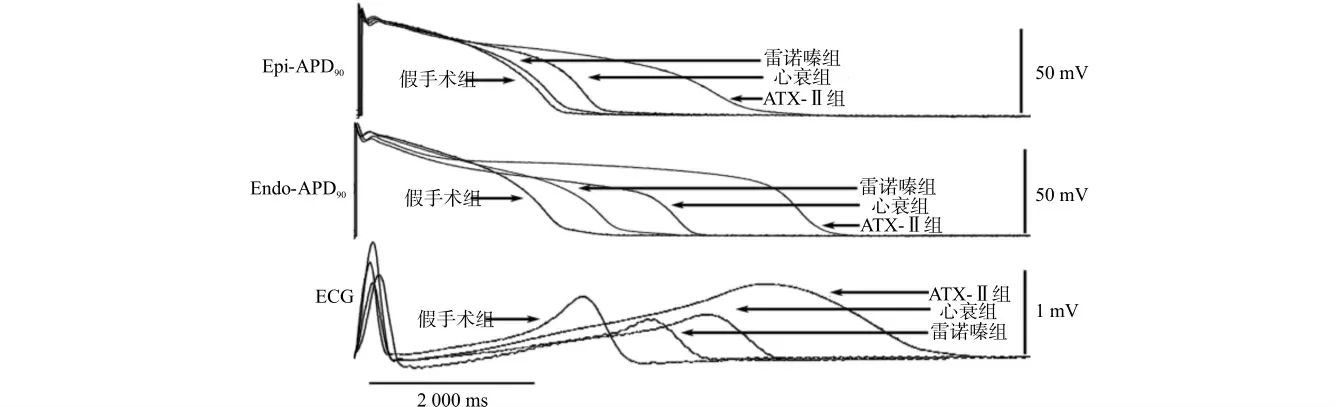
图2 左室楔形心肌块外膜APD90、内膜APD90及QT 间期的比较Fig.2 Comparison of Epi-APD90,Endo-APD90and QT interval of isolated left ventricular wedge preparations among different groups
2.4 各组EAD及室性心律失常发生率的比较
假手术组、心衰组、ATX-Ⅱ组及雷诺嗪组EAD的发生率分别为0、90%、100%、20%,室性心律失常的发生率为0、60%、100%、10%。假手术组EAD 及室性心律失常的发生率低于心衰组(均P<0.05)。与心衰组相比,给予ATX-Ⅱ后心力衰竭模型EAD 的发生率增加,但差异无统计学意义(P>0.05),室性心律失常的发生率增加明显(P <0.05);加入雷诺嗪后其EAD 及心律失常的发生率均明显下降(均P<0.05)。图3为心力衰竭模型心肌块在S1S2刺激下诱发的室性心律失常。
3 讨论
INa-L是持续存在于动作电位平台期的一种内向钠离子流,属于钠电流的慢失活成分,正常情况下占快钠电流的1%,但某些病理情况下如缺血、缺氧时可明显增加[4]。近年来研究表明INa-L在多种病理状态下心律失常的发生中起着重要的作用。有研究表明INa-L的增大造成跨室壁复极离散度(TDR)的增加,在早期后除极和心律失常的发生中起着重要作用[5-6]。
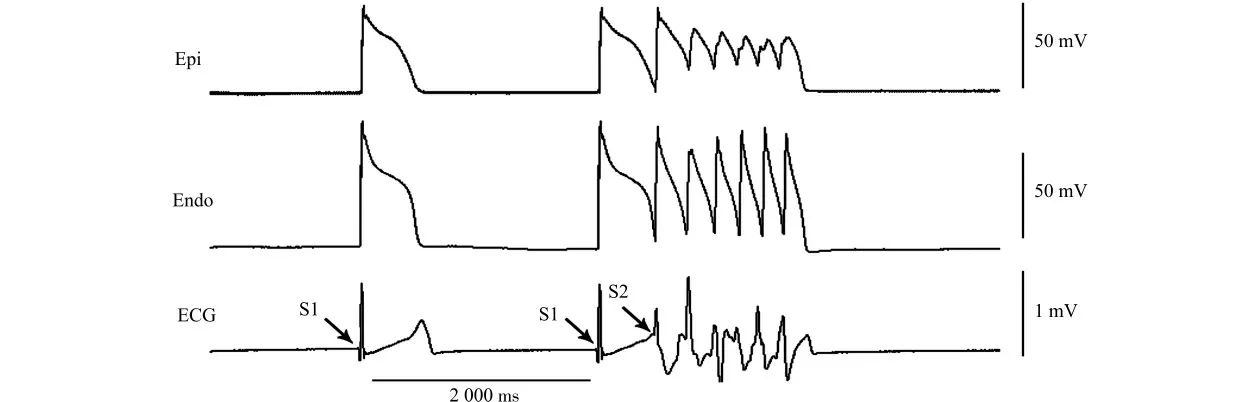
图3 心力衰竭模型在程序刺激下诱发的室性心律失常Fig.3 VA induced by programmed stimulation in HF models
心力衰竭时心肌细胞缺血、缺氧引起电压依赖性Na+通道失活延缓或不完全,导致INa-L增大和细胞内Na+浓度增加,通过Na+/Ca2+反向交换导致细胞内钙超载[7],延长动作电位时程(APD),从而诱发EAD 和室性心律失常的发生。ATX-Ⅱ与电压依赖性Na+通道结合具有特异性,能显著增加INa-L,本实验研究表明给予INa-L增强剂ATX-Ⅱ后显著增加心肌细胞室性心律失常的发生率。心力衰竭兔的楔形心肌块给予INa-L增强剂ATX-Ⅱ后心肌块外膜APD90、内膜APD90均显著延长,特别是内膜APD90延长较为明显,跨室壁复极离散度(TDR)增加,进而导致心律失常的发生,这与ATX-Ⅱ对内膜心肌细胞INa-L的作用强于外膜有关[8]。给予INa-L阻滞剂雷诺嗪后可减少心力衰竭模型心律失常的发生。近年来有研究表明雷诺嗪能够缩短心力衰竭犬心室肌动作电位,减少动作电位离散度,抑制或减少导致心律失常的早期后除极和心室复极的不均一性[9-10]。本实验在兔心力衰竭模型中同样证明了雷诺嗪能够减少或抑制衰竭心肌室性心律失常的发生。
本实验结果表明,心力衰竭时心肌细胞电机械活动不稳定,极易导致EAD 和室性心律失常的发生。其原因可能为心衰时心肌细胞内Na+通道失活延缓或不完全导致INa-L的增加,通过Na+/Ca2+反向交换导致细胞内钙超载,延长动作电位时程,诱发EAD 及恶性心律失常的发生。随着对INa-L在心力衰竭室性心律失常中所起作用认识的不断深入,可能为将来心衰患者室性心律失常的治疗提供新的思路。
[1] 全小庆,张存泰,吕家高,等.抗心律失常肽对兔长QT 综合征模型室性心律失常的影响[J].临床心血管病杂志,2008,24(1):51-54.
[2] 谭团团,于胜波,包明威,等.慢性心力衰竭患者QT 间期频率依赖性与室性心律失常的关系[J].中华心律失常学杂志,2011,15(2):128-131.
[3] 李火平,全小庆,张存泰,等.普伐他汀对兔急性心肌缺血室性心律失常的影响[J].华中科技大学学报:医学版,2007,36(4):456-458.
[4] Undrovinas A,Maltsev V A.Late sodium current is a new therapeutic target to improve contractility and rhythm in failing heart[J].Cardiovasc Hematol Agents Med Chem,2008,6(4):348-359.
[5] Quan X Q,Bai R,Lv J G,et al.Pharmacological enhancement of cardiac gap junction coupling prevents arrhythmias in canine LQT2model[J].Cell Commun Adhes,2009,16(1-3):29-38.
[6] Quan X Q,Bai R,Liu N,et al.Increasing gap junction coupling reduces transmural dispersion of repolarization and prevents torsade de pointes in rabbit LQT3model[J].J Cardiovasc Electrophysiol,2007,18(11):1184-1189.
[7] Shryock J C.Role of late sodium channel current in arrhythmogenesis[J].Card Electrophysiol Clin,2011,3(1):125-140.
[8] Antzelevitch C,Belardinelli L.The role of sodium channel current in modulating transmural dispersion of repolarization and arrhythmogenesis[J].J Cardiovasc Electrophysiol,2006,17(Suppl 1):S79-S85.
[9] 方雁,张存泰,刘念,等.CaMK Ⅱ途径在慢性心衰模型触发性心律失常产生中的作用[J].华中科技大学学报:医学版,2011,40(6):706-709.
[10]Wu L,Shryoek J C,Song Y,et al.Antiarrhythmic effects of ranolazine in a guinea pig in vitro model of long-QT syndrome[J].J Pharmacol Exp Ther,2004,310(2):599-605.

