红辣椒中类胡萝卜素的研究进展
黄延春 ,李云霞
内蒙古师范大学化学与环境科学学院,呼和浩特010022
红辣椒属一年生草本植物,品种繁多,世界各地广泛种植。红辣椒中的主要成分有提供香辣味的辣椒素、二氢辣椒素、降二氢辣椒素[1-3]、脂肪酸[4,5]、多酚[6,7]、糖[8]、维生素[9]、类胡萝卜素等[10]。其中类胡萝卜素在植物的生命中起着重要的作用,其合成由光控制。随着辣椒的成熟,叶绿体转化成有色体,叶绿素逐渐减少,类胡萝卜素增加。日光对加强类胡萝卜素的合成是有效的,绿光和蓝光抑制类胡萝卜素的生成[11,12]。红辣椒中的类胡萝卜素在收获后的干燥过程中,在光的照射下仍会进行生物合成,一直到水分全部脱去才结束。在这一过程中,类胡萝卜素的含量会增加20%~40%[13]。类胡萝卜素可以作为食品、化妆品的着色剂被广泛应用,而且具有丰富的营养价值。但是类胡萝卜素的稳定性较差,使它的应用受到较大的限制。因此,对红辣椒中类胡萝卜素稳定性的研究成为一个重要课题。本文综述了红辣椒中类胡萝卜素在不同条件下稳定性的研究进展,为类胡萝卜素的开发应用提供参考。
1 红辣椒中类胡萝卜素的种类及结构
红辣椒呈现鲜艳的颜色,主要是由于其含有丰富的类胡萝卜素。红辣椒中类胡萝卜素的成分及含量随着产地的不同而不同[14],但基本都包括两个系列,红色系列和黄色系列[15,16]。其中,含量较多的是辣椒红素、南瓜黄质、玉米黄质、β-胡萝卜素、β-玉米黄质[17]。红辣椒中各种类胡萝卜素的结构如表1 所示。
2 红辣椒中类胡萝卜素的分离及检测
红辣椒中类胡萝卜素的生物合成非常复杂,种类较多。红辣椒中的各种类胡萝卜素是科研工作者花费大量时间,采用各种先进的分离检测手段鉴定出来的。
A.Aczél 利用高压薄层色谱分离了辣椒红素和辣椒玉红素。这是一种具有选择性的分离,能准确地确定红色素的色价[18]。M. Isabel Mínguez-Mosquera 等利用反相高压液相色谱(HPLC),通过丙酮和水的梯度洗脱,在450 nm 的紫外光下检测,分离和鉴定了红辣椒果实、辣椒粉、辣椒油中的十四种类胡萝卜素[19]。D. Hornero-Méndez 等采用UVVisible、IR、MS、TLC 和HPLC 分离鉴定出了红辣椒中南瓜黄素[20]。Dámaso Hornero-Méndez 等采用快速分光光度法确定了辣椒粉和辣椒油中类胡萝卜素中的部分红色成分和黄色成分。这一方法可直接用于丙酮提取液,避免了皂化,最小化了色素降解造成的误差,减少了样品的处理,缩短了分析时间[21]。Péter A.Biacs 等提取得到了红辣椒中脂肪酸类胡萝卜酯和未酯化的低相性和表相性的类胡萝卜素。采用高压液相色谱将其分离,发现辣椒红素单酯中主要含有不饱和脂肪酸,辣椒红素二酯和辣椒玉红素中主要含有饱和脂肪酸[22]。M.H.Gnayfeed 等的研究发现,利用次临界丙烷萃取辣椒粉,比较容易得到类胡萝卜素和维生素,不易得到辣椒素[23]。
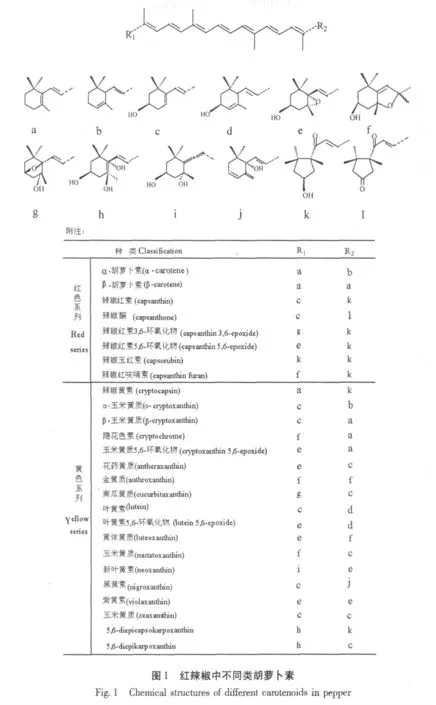
3 红辣椒中类胡萝卜素稳定性的研究
红辣椒中类胡萝卜素的稳定性是制约类胡萝卜素在食品及化妆品等领域应用的一个重要因素。因此,对红辣椒中类胡萝卜素的稳定性的研究成为一个重要课题。
3.1 干燥的影响
Maria Isabel Mínguez-Mosquera 等研究了不同品种红辣椒在缓慢干燥和研磨过程中类胡萝卜素含量的变化。结果表明,湿度为85%~88%的红辣椒在温和的条件下干燥,类胡萝卜素的含量等于或高于最初的产品。这个事实说明,果实在干燥期间仍在进行新陈代谢,存在着各种类胡萝卜素的合成,从而增加了黄色成分和红色成分;另外,干果实在研磨阶段,研磨机产生的热导致了黄色成分的降解,红色成分未发生变化[24]。这一实验结果与Antonio Pérez-Gález 等的研究结果相似,其研究发现,在果实干燥(温度在60 ℃左右)研磨的过程中,类胡萝卜素的含量在不同的时间段有时高有时低[25]。
3.2 贮藏的影响
Antonio Raffo 等研究了使用聚乙烯包装和热水处理后包装低温贮藏的红辣椒中辣椒红素、南瓜黄素A、玉米黄素、β-胡萝卜素、β-玉米黄素含量的变化。结果表明,未包装、包装及使用53 ℃热水处理后包装低温贮藏21 d 的红辣椒中,五种类胡萝卜素的含量变化不一样。未包装的红辣椒中辣椒红素的含量减少,南瓜黄素A 的含量减少,玉米黄素、β-胡萝卜素、β-玉米黄素的含量增多;包装的红辣椒中辣椒红素的含量稍有减少,南瓜黄素A 的含量未变,玉米黄素、β-胡萝卜素、β-玉米黄素的含量稍有增多;使用53 ℃热水处理后包装低温贮藏21 d 后五种类胡萝卜素的含量基本未变。从以上结果我们可以看出,短时间的贮藏对类胡萝卜素的影响较小[16]。
Ayhan Topuz 等研究了γ 射线及贮藏对辣椒粉中的辣椒红素、辣椒玉红素、南瓜黄素、隐黄素、紫黄素的影响。在较大强度的辐射下或较长时间的贮藏,除了辣椒玉红素外,其它色素均有明显减少。但是辐射的影响弱于贮藏时间的影响,例如,在强度为10 kGy 的γ 射线照射下,辣椒红素减少11.1%,而10 个月的贮藏辣椒红素会减少42.1%[26]。
3.3 温度的影响
Manuel Jarén-Galán 等研究了温度对红辣椒油树脂中类胡萝卜素含量的影响。在60 ℃以下,升高温度红辣椒中的黄色色素被破坏的速率快一些;60℃以上,升高温度红辣椒中的红色色素被破坏的速率快一些。总之,升高温度,红辣椒油树脂中类胡萝卜素总含量减少[27]。
Ute Schweiggert 等研究了干辣椒和辣椒粉中游离的类胡萝卜素和酯化类胡萝卜素在不同温度下的稳定性。将干辣椒和辣椒粉分别加热到80、90、100℃,保持5 min 和10 min,然后冻干。检测发现,干辣椒中的类胡萝卜素减少25%~34%,辣椒粉中的类胡萝卜素减少20%~53%。研究还发现,在室温下贮存4 个月后,干辣椒中游离的类胡萝卜素和酯化类胡萝卜素含量分别下降16.7%~9.6%,辣椒粉中二者分别下降39.7%~38.8%。可见,类胡萝卜素在干辣椒中更稳定,干辣椒中酯化类胡萝卜素比游离的类胡萝卜素更稳定[28]。这一研究结果与Péter A.Biacs 等[22]的结果一致。
3.4 填加物的影响
Antonio Raffom 等研究了在70 ℃的烤箱中干燥、研磨辣椒时,未加入和加入不同比例辣椒种子的情况下,类胡萝卜素的降解情况。结果表明,在最初阶段,热降解速率与混合种子的比例成反比。随着干燥时间的增长,混合种子的比例越少,热降解速率越慢,类胡萝卜素损失越少。从整个反应过程来看,加入的种子越多,降解速率越快,主要是由于种子中富含不饱和脂肪酸(主要是亚油酸),它具有氧化作用。因此,在辣椒粉产品中,为了减少类胡萝卜素的损失,不要填加辣椒种子[29]。
Peter A. Biacs 等的研究发现,在室温下贮存不同辣椒粉150 d,未加入任何抗氧化剂的辣椒粉中,类胡萝卜素有27%的降解,加入δ-生育酚的有20%的降解,加入抗坏血酸的有15%的降解;在冷冻的条件下贮存以上三种辣椒粉,其中类胡萝卜素的降解率分别为15%,13%和5%。可见,在辣椒粉加入一定量的抗氧化剂可以增加类胡萝卜素的稳定性[30]。
4 结语
到目前为止,各国科研工作者利用各种测试手段已确定的红辣椒中类胡萝卜素的种类及结构达26 种之多,其应用前景非常广阔。但是由于类胡萝卜素的稳定性较差,红辣椒主要以辣椒粉、辣椒酱、辣椒油等出现在市场上。为了提高红辣椒的应用价值,扩大红辣椒中类胡萝卜素的应用范围,必须对提高类胡萝卜素的稳定性做更深入地研究。
1 Reusch M,et al. Determination of capsaicinoids in low pungency paprika. Z Lebensm Unters Forsch,1996,202:334-336.
2 Seong SH,et al.Suppression of phorbol ester-induced NF-kB activation by capsaicin in cultured human promyelocytic leukemia cells.Arch Pham Res,2002,25:475-479.
3 Han SL,et al.Oviposition-stimulating activity of (E)-capsaicin identified in capsicum annuum fruit and related compounds towards Helicoverpa assulta. Chemoecology,2006,16:153-157.
4 Gálvez AP,et al. Fatty acid composition of two new pepper varieties(Capsicum annuum L. Cv. Jaranda and Jariza).Effect of drying process and nutritional aspects. JAOCES,1999,76:205-208.
5 Malchev E,et al. Indentification and changes in the higher fatty acids of dried red pepper and redpepper powder.Z Lebensm Unters Forsch,1989,189:229-231.
6 Oboh G,Joao Batista T,Rocha. Polyphenols in red pepper[Capsicum annuum Var.aviculare (Tepim)]and their protective effect on some pro-oxidants induced lipid peroxidation in brain and liver. Eur Food Res Techno,2007,225:239-247.
7 Gorinstein S,et al. A comparative study of phenolic compounds and antioxidant and antiproliferative activities in frequently consumed raw vegetables. Eur Food Res Technol,2009,228:903-911.
8 Rácz MP,et al.Enzymatic determination of the sugars in red pepper.Z Lebensm Unters Forsch,1981,172:115-117.
9 Guerrero JLG,Guirado CM.Fuentes MMR Nutrient composition and antioxidant activity of 10 pepper (Capsicum annuum)varieties.Eur Food Res Technol,2006,224:1-9.
10 Fekete M,et al. Spectrophototric method for determining the pigment content of ground paprika.Z Lebensm Unters Forsch,1976,161:31-33.
11 Lopez M,et al.Carotenoids from capsicum annuum Fruits:Influence of spectral quality of radiation. Biologia Plantarum(praha),1986,28:100-104.
12 Pilarski J,Kocurek M.The content of photosynthetic pigments and the light conditions in the fruits and leaves of sweet pepper.Acta Physiol Plant,2005,27:173-182.
13 Mosquera MIM,et al. Competition between the processes of biosynthesis and degradation of carotenoids during the drying of peppers.J Agric Food Chem,1994,42:645-648.
14 Ayuso MC,et al.Quality characteristics of different red pepper cultivars (Capsicum annuum L.)for hot paprika production.Eur Food Res Technol,2008,227:557-563.
15 Deli J,et al.Separation and identification of carotenoids from different coloured paprika (Capsicum annuum )by reversedphase high-performance liquid chromatography.Eur Food Res Technol,2001,213:301-305.
16 Scalia S,Francis GW. Preparative scale reversed-phase HPLC method for simultaneous separation of carotenoids and carotenoid esters.Chromatographia,1989,28:129-132.
17 Raffo A,et al. Internal quality and antioxidants content of cold-stored red sweet peppers as affected by polyethylene bag packaging and hot water treatment. Eur Food Res Technol,2007,225:395-405.
18 Aczél A.The over-pressured thin-layer chromatographic separation of capsanthin-capsorubin. Fresenius Z Anal Chem,1988,330:462.
19 Mosquera MIM,Méndez DH.Separation and quantification of the carotenoid pigments in red peppers (Capsicum annuum L.),paprika and oleoresin by reversed-phase HPLC.J Agric Food Chem,1993,41:1616-1620.
20 Méndez DH,Mosquera MIM. Isolation and identification of the carotenoid capsolutein from Capsicum annuum as cucurbitaxanthin A.J Agric Food Chem,1998,46:4087-4090.
21 Méndez DH,Mosquera MIM.Rapid spectrophotometric determination of red and yellow isochromic carotenoid fractions in paprika and red pepper oleoresins.J Agric Food Chem,2001,49:3584-3588.
22 Biacs PA,et al.Studies on the carotenoid pigments of paprika(Capsicum annuum L. var Sz-20). J Agric Food Chem,1989,37:350-353.
23 Gnayfeed MH,et al.Supercritical CO2and subcritical propane extraction of pungent paprika and quantification of carotenoids,tocopherols,and capsaicinoids. J Agric Food Chem,2001,49:2761-2766.
24 Mosquera MIM,et al. Carotenoid content of the varieties jaranda and jariza(Capsicum annuum L.)and response during the industrial slow drying and grinding steps in paprika processing.J Agric Food Chem,2000,48:2972-2976.
25 Gález AP,et al. Dependence of carotenoid content and temperature-time regimes during the traditional slow drying of red pepper for paprika production at La Vera county. Eur Food Res Technol,2005,221:645-652.
26 Topuz A,Ozdemir F.Influence of r-irradiation and storage on the carotenoids of sun-dried and dehydrated paprika.J Agric Food Chem,2003,5:4972-4977.
27 Galán MJ,Mosquera IM.Quantitative and qualitative changes associated with heat treatments in the carotenoid content of paprika oleoresins.J Agric Food Chem,1999,47:4379-4383.
28 Schweiggert U,et al.Effects of processing and storage on the stability of free and esterified carobenoids of red peppers(Capsicum annuum L.)and hot chilli peppers (Capsicum frutescents L.).Eur Food Res Technol,2007,225:261-270.
29 Gálvez AP,et al.Participation of pepper seed in the stability of paprika carotenoids.JAOCS,1999,76:1449-1454.
30 Biacs PA,et al. Factors affecting stability of colored substances in paprika powders. J Agric Food Chem,1992,40:363-367.

