γ-聚谷氨酸/壳聚糖多孔复合支架材料的制备、表征及性能的研究
疏秀林,施庆珊 ,林小平,欧阳友生,陈仪本
广东省微生物研究所广东省菌种保藏与应用重点实验室广东省微生物应用新技术公共实验室和广东省华南应用微生物重点实验室 省部共建国家重点实验室培育基地,广州510070
壳聚糖是近年极具发展潜力的生物医学材料,具有生物可降解性、生物相容性及抗菌性,且其在酸性环境下会形成带正电的聚电解质,可以很容易的和其他带负电的聚电解质或药物(如生长因子等)形成聚合物,继而增进材料的性质,因此应用极为广泛,常被用在骨组织再造、药物释放、创伤敷料等应用。但是,该材料目前尚存的缺陷在于:制成品的强度不够,膜的力学性能差,脆性较大,吸收渗液能力不强、抗水性较差、降解时间过长。而且对于某些细胞而言,它的细胞相容性表現不是很好。常将壳聚糖与一种或几种其它高分子材料复合以改善其性能[1]。
γ-聚谷氨酸[Poly(γ-glutamic acid,γ-PGA)]是一种典型的聚电解质,由D-谷氨酸和L-谷氨酸通过γ-谷氨酰键聚合而成的氨基聚合物(见图1)[2,3],相对分子量一般在10 万~100 万。与其他聚合高分子化合物相比,γ-PGA 在体内能降解为谷氨酸单体,为人体所必需,生物相容性优良,低免疫原性,无毒副作用,这是其它材料所不可比拟的。γ-PGA 钠盐在极性溶剂中溶解时,-COONa 基团电离形成聚合物离子-COO-和Na+,聚离子链上大量的净电荷及链段间的静电作用使γ-PGA 水溶液在粘度等诸方面表现出特殊的性质。
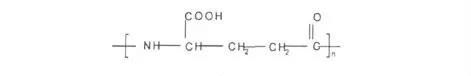
图1 γ-聚谷氨酸结构图Fig.1 Chemical structures of poly (γ-glutamic acid)
在组织工程领域中很重要的一点就是人工三维材料与细胞的黏附性,γ-PGA 具有相当好的黏着性,其最大特点是:氨基酸基团能增加材料与细胞的亲和性,能够介导种子细胞与支架材料黏附,具有良好的生物适应性,且因其广泛的分子量范围,可以通过改变其聚合度以及分子键交联的程度来调节组织支架的降解速率。研究发现,在外科手术的脏器、止血剂及密封剂,γ-PGA 的机械轻度及止血功能远超过传统的纤维原止血凝胶。此外γ-聚谷氨酸经由化学修饰可形成特殊的纤维,其用途可应用手术后的缝合线或将酵素固定于纤维上作为一特材质。γ-PGA 价格远低于目前进行研究生产和应用的生物可降解材料聚天冬氨酸、聚乳酸等的原料L-乳酸、L-天冬氨酸。γ-PGA 作为组织工程支架材料在组织工程应用方面有非常大的应用潜力,但是目前国内外这方面的研究报道非常少[4]。
本研究将壳聚糖与γ-聚谷氨酸这两种生物材料,通过合适的结构连接和剂型改造,力求解决支架材料中壳聚糖脆性大、降解速率较慢和壳聚糖机械强度较低的缺点,研究一种具有良好的生物相容性、一定机械强度、可控降解性能的理想生物医学材料。
1 材料与方法
1.1 实验材料
羧甲基壳聚糖(CMCS,阿拉丁公司);二甲基亚砜(DMSO,无水级别,阿拉丁公司);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,阿拉丁公司);4-二甲氨基吡啶(DMAP,阿拉丁公司);高糖DMEM(美国Gibco 公司),胎牛血清(FBS,美国Hyclone 公司),MTT 试剂盒(美国Am-resco 公司);1,6-hexanediamine(1,6-乙二胺,阿拉丁公司)。
1.2 实验方法
1.2.1 γ-PGA-H+的制备
将市售γ-PGA-Na+加入单颈圆底瓶中,以4 倍(V/W)的蒸馏水搅拌溶解,然后加入0.8 倍(V/W)的37%盐酸,配成浓度为2mol/L 的盐酸水溶液,持续室温搅拌直至有产物沉淀时再继续搅拌6 h 反应完全,最后利用真空抽滤方式收集沉淀产物,并用3~4 倍(V/V)的蒸馏水冲洗数次,冷冻干燥后保存备用。
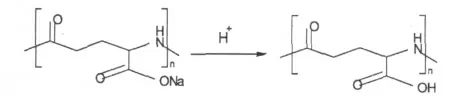
图2 γ-PGA-H +反应式Fig.2 The γ-PGA-H +preparation scheme
1.2.2 壳聚糖/ γ-PGA 复合材料的制备
称取0.5 g γ-PGA 和0.05 g DMAP 超声溶解于18 mL DMSO 中,将羧基壳聚糖溶液缓慢滴加到γ-PGA 溶液中,并伴随磁力搅拌,滴加完毕添加一定量的EDC·HCl,室温下搅拌3 h 后终止实验。将混合溶液中添加三倍体积的丙酮,以形成沉淀,真空抽滤收集沉淀,将沉淀物进行冷冻干燥,去除多余的丙酮,再将沉淀物用PBS 溶剂(pH 值7.2)溶解,运用超滤透析法去掉多余的CS(透析袋截留分子量100,000)和多余的1,6-乙二胺(透析袋截留分子量3500)。梯度冷冻:以4 ℃、-20 ℃各2 h,-40 ℃4 h,-70 ℃24 h,之后进行真空冷冻干燥48 h,真空度达0.01 Pa。
1.3 结构鉴定
1.3.1 氢原子核磁共振光谱(1H NMR)
聚合物产物溶解于D20 溶剂,送至广州分析测试中心检测。
1.3.2 傅里叶红外线光谱仪( FT-IR)
称取产物5 mg 加入200 mg 的KBr,利用压力机压成薄片后测量,单一样品重复扫描16 次,测定吸收波长范围为400~4000 cm-1,解析度为2 cm-1,吸收强度以穿透度(%T,transmittance)表示。
1.4 物性分析
1.4.1 支架材料孔隙率
将冷冻干燥后的支架材料粘附于样品基台上,二氧化碳(CO2)临界点干燥,真空下喷金镀膜,用扫描电子显微镜(Hitachi S-3000N,日本)观察支架材料的形貌。用Image J 1.46R 软件随机选取支架材料扫描电镜图片中的30 个孔隙,测量每一孔隙最大直径,以其平均值为支架材料的平均孔径。
1.4.2 支架材料的吸水性和保水性
称取一定量的复合材料(W0),置于盛有足量待洗蒸馏水的烧杯中,放置24 h 至吸液饱和后用160目筛网滤去剩余蒸馏水和可溶物质,准确测定吸水后复合材料的质量(W1);将吸水后的的复合材料置于底层铺有滤纸的离心管中,500 rpm 常温离心3 min,取出滤纸上层材料,准确称重(W2)。复合材料的吸水性(U)和保水性(R)按下列公司计算得到:
U=(W1-W0)/W0×100%
R=(W2-W0)/W0×100%
1.4.3 支架材料的离体降解性
配置0.1 mol/L PBS(pH 7.2)缓冲液,称取一定量(W0)的复合材料置于密封管中,加入适量的PBS 缓冲液,称取适量材料分别加入10 mL 的PBS缓冲液(pH 7.4),置于电热恒温水浴箱中37 ℃温度下降解,每星期更换一次缓冲液,倾出的缓冲液测量pH 值变化,样品经真空抽滤并用蒸馏水多次洗涤,再经真空干燥箱冷冻干燥,测量其重量变化。
WL=(W0-W1)/W0×100%
2 实验结果
2.1 γ-聚谷氨酸/壳聚糖复合材料的红外图谱分析
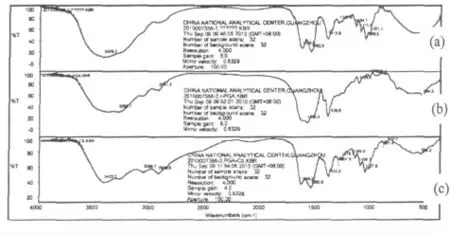
图3 羟甲基壳聚糖(a)、γ-聚谷氨酸(b)和γ-聚谷氨酸/羟甲基壳聚糖(c)的红外光谱图Fig.3 The infrared spectra of CS (a),γ-PGA (b)and γ-PGA/CMCS copolymer (c)
由图3-a(CS 的红外图谱)可见:3429.2 cm-1处为O-H 和N-H 的伸缩振动,2923 cm-1处为-CH、-CH2的伸缩振动,1648.8 cm-1处为酰胺键C =O 的伸缩振动,1312.3 cm-1处为N-H 的剪式振动,1068.5 cm-1为C-O 的伸缩振动,这些特征吸收峰符合壳聚糖的主要官能团;由图3-b(聚谷氨酸的红外图谱)可见:3295 cm-1处为O-H 和N-H 的伸缩振动,2941.2 cm-1处为-CH,-CH2的伸缩振动,1707.2 cm-1羧基中C=O 的伸缩振动,1596.5 cm-1亦为羧酸上C =O 的伸缩振动,由于结构中的大π 键的共轭效应使其吸收峰向低波数处移动,1406.6 cm-1处为N-H 的剪式振动,这些特征吸收峰符合γ-PGA 的主要官能团;
由图3-c(合成的γ-PGA/CS 的图谱)可见:3423.2 cm-1处为O-H 和N-H 的伸缩振动,3068.7 cm-1和2935. 6cm-1处 为-CH、-CH2的 伸 缩 振 动,1648.2cm-1处系酰胺基中-C =O 的伸缩振动带(酰胺吸收带I),1560.6 cm-1 吸收带来源于NH 弯曲和C-N 伸缩振动的偶合(酰胺吸收带Ⅱ),两者结合证明了酰胺基的存在。1400.2 cm-1和1307.8 cm-1 处的吸收峰表明了分子结构中存在脂肪烃类-CH2或-CH3(弯曲振动)。通过与γ-PGA 红外图谱对比(图3-b)及图谱解析可知壳聚糖和聚谷氨酸之间通过壳聚糖的氨基和聚谷氨酸的羧基生成的酰胺键而连接在一起。
2.2 支架材料形貌学特点
大体观察,制备的支架材料质地均匀一致,并富有弹性,呈海绵状。扫描电镜观察,空隙分布均匀,各空隙的孔壁厚度一致。平均孔径100.29 ±40.46 μm,孔隙率83.45%。众多实验证明成骨细胞生长要求材料的最佳孔径为5~15 μm,骨再生为100~350 μm,而骨质的生长为40~100 μm,考虑到各种因素认为能引导骨生长的支架最佳孔径应为200~350 μm[5]。在本实验中,制备的材料的孔径范围达到了使得细胞顺利进入并良好生长以及诱导骨矿化成骨的孔径范围的要求。但是除了孔径大小,孔隙率和孔的连通性,也是实验中考虑的因素之一,本材料有待进一步精度加工,使其带到骨组织生长的最佳要求。

图4 γ-聚谷氨酸/壳聚糖复合材料的表面扫描电镜图Fig.4 The surface morphology of the composite materials γ-PGA/CMCS
2.3 支架材料吸水性和保水性
通过24 h 的吸水测试,该复合材料的平均吸水性为465% ±38%,500 rpm 离心3 min 后保水性能达到329% ±33%。羟基壳聚糖和聚谷氨酸均溶解于水。因此无法比较吸水性和保水性。
人工骨的亲水和疏水性与生物相容性有关。一般疏水性表面比亲水性表面吸附蛋白量少,容易引起白蛋白变性;亲水性表面不但容易吸附蛋白质,而且粘附血小板的能力也小。该复合材料有很高的吸水性。由于用EDC/NHS 交联的支架材料表面具有较多的极性基团,因此,也提高了支架材料的亲水性,使支架材料的吸水量增加。
2.4 支架材料的体外降解性
降解介质pH 值的变化:图5 为不同材料体外降解实验pH 值的变化。从图5 可知,我们将羧甲基壳聚糖的初始pH 值较高(7.23),随着时间的推移,CMCS 逐渐缓慢降解,pH 也逐渐缓慢下降,潜到12 周时,pH 为6.8,整个过程pH 为同一趋势变化。而γ-PGA/CMCS 复合材料在前4 周pH 值下降较快速,到5 周,下降减缓,并且后期维持较缓慢的降解,12 周缓慢下降至6.67。
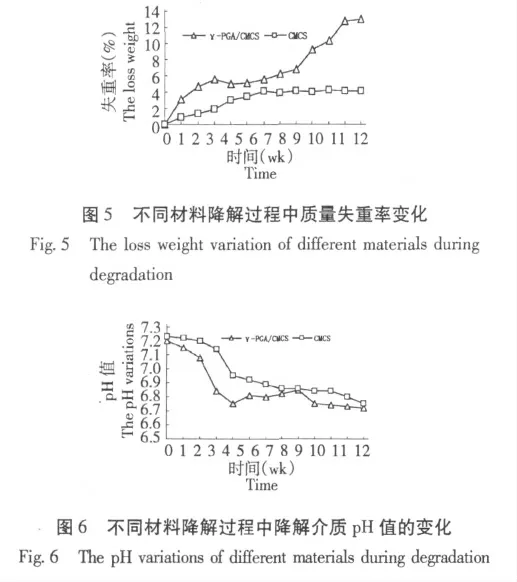
材料失重率变化:图6 为2 种材料降解过程中失重率变化图。与pH 值变化相似,CMCS 的失重率在前7 周一直缓慢上升,7 周变化缓慢;γ-PGA/CMCS 复合材料在前4 周,失重率快速上升,降解较快,5~7 周降解趋于平缓,8 周后又降解加快,12 周是失重率达到12.96%。
跟其他聚合材料相似,复合材料降解的早期主要是许多小分子量的聚谷氨酸迅速降解,引导大分子量的聚谷氨酸分子迅速水解,而且分子链上每个酰键都可能被水解断裂,分子链越长,被水解的部位也就越多,所以在开始阶段降解快,pH 值下降明显;随着降解的进行,小分子量的γ-聚谷氨酸已经完全降解,只剩下分子量分布较窄的中等分子量的分子降解,于是降解速度减慢。对于共聚物,降解结果可能是γ-聚谷氨酸、羟甲基壳聚糖的综合作用,壳聚糖在酸的催化作用下,降解加快。故在降解初期,共聚物的pH 值下降明显(0~4 周),降解失重率也在显著增加(0~4 周);随着降解的进行,共聚物中的CS 中的胺基在酸的作用下,都会从共聚物中脱离而进入PBS 中,使溶液的pH 值有所上升(4~8 周),这样就相对抑制了γ-PGA 及CS 的降解,使降解减慢,失重率变缓(4~8 周);随着降解的深入,CS 中的胺基逐渐与γ-PGA 中的COO-结合成盐,但γ-PGA 还在继续降解,COO-的不断增加,使溶液pH值又缓慢下降(8~12 周),但此时的γ-PGA 均为大分子量的,故其降解较慢,所以失重变得更缓(8~12 周)。精确的速度调解尚需要进一步研究。
3 结论与讨论
本研究通过接枝共聚法成功合成了γ-聚谷氨酸/壳聚糖的共聚高分子并初步研究其结构、性能。通过扫描电子显微镜SEM 观察,可明显观察到空隙相连蜂窝状结构,具有很高的孔隙率,可达到83.45%,平均孔径为100.29 ±40.46 um,气孔比较均匀,孔径可达到骨组织长入人工材料最小长入值的要求,但是孔隙率和孔的连通性需要进一步精度加工,使其带到骨组织生长的最佳要求。该复合材料具有很好的吸水性和保水性,吸水性能达到465% ±38%,500 rpm 离心3 min 后保水性能达到329% ±33%。将材料浸泡于PBS 缓冲液(pH 值7.2)中静置于37 ℃恒温箱,经过12 周的观察,γ-聚谷氨酸/羟甲基壳聚糖复合材料的降解速率快于羟甲基壳聚糖,但是复合材料的降解是两种材料综合作用的结果,这方面有待于进一步深入的研究。
1 Di Martino A,Sittinger M,Risbud MV. Chitosan:a versatile biopolymer for orthopaedic tissue-engineering.Biomat,2005,26:5983-5990.
2 Shu XL(疏秀林),Shi QS(施庆珊),Feng J(冯静),et al.Optimization of poly γ-glutamic acid fermentation medium using plackett-burman experimental design. Biotech bull (生物技术通报),2007,4:173-177.
3 Shu XL(疏秀林),Shi QS(施庆珊),Feng J(冯静),et al.Identification and simulation mutation of a high-productive strain of poly(γ-glutamic acid)independent of glutamic acid.Microbiol(微生物学通报),2009,36:705-710.
4 Shu XL(疏秀林),Shi QS(施庆珊),Huang XM(黄小茉),et al.Application of gamma-poly glutamic acid and its derivatives in biomedical field.Chin J Tiss Engin Res (中国组织工程研究),2012,16:3009-3012.
5 Kong LJ,Gao Y,Cao WL,et al.Preparation and characterization of nano-hydroxyapatite/chitosan composite scaffolds. J Biomed Mater Res,Part A,2005,75:275-282.
6 Li JB(李晶博),Li D(李丁),Deng MC(邓毛程),et al.Properties,production and application of γ-polyglutamic acid.Chem Ind Eng Prog (化工进展),2008,7:1789-1799.
7 Hsieh CY,Hsieh HJ,Liu HC,et al. Fabrication and release behavior of a novel freeze-gelled chitosan/γ-PGA scaffold as a carrier for rhBMP-2.Dent Mater,2006,22:622-629.
8 Réthoré G,Mathew A,Naik H,et al.Preparation of chitosan/polyglutamic acid spheres based on the use of polystyrene template as a nonviral gene carrier. Tiss Eng Part C Met,2009,15:605-613.
9 Kim MM,Seo M,Chung JW,et al. Polymeric calcium phosphate cements incorporated with poly--glutamic acid:comparative study of poly--glutamic acid and citric acid.J App Poly Sci,2009,113:1223-1231.
10 Chang KY,Cheng LW,Ho GH,et al.Fabrication and characterization of poly(gamma-glutamic acid)-graft-chondroitin sulfate/polycaprolactone porous scaffolds for cartilage tissue engineering.Acta Biomater,2009,5:1937-1947.

