伊马替尼一线治疗晚期胃肠道间质瘤的临床观察
孙小峰 陈 嘉
江苏省肿瘤医院内科,江苏南京 210009
胃肠道间质瘤(GIST)是指在消化道发生的间叶源性肿瘤, 其发病机制80%~90%为c-kit 基因突变,血小板衍生生长因子(PDGFRa)基因突变为5%~10%。这些突变导致受体酪氨激酶活化,细胞增殖失控,肿瘤形成和发展[1]。 GIST 是对传统化疗高度耐药的肿瘤,也不适合放射治疗,因此针对酪氨激酶的靶向治疗无疑成为治疗的关键。一种小分子多靶点的酪氨酸激酶抑制剂——伊马替尼自2002 年被美国FDA 批准用于治疗GIST 以来, 已被很多大规模的临床试验证实了疗效。 本研究观察江苏省肿瘤医院(以下简称“我院”)2007 年1 月~2011 年8 月对84 例晚期GIST 患者一线采用伊马替尼治疗的疗效和不良反应,现报道如下:
1 资料与方法
1.1 一般资料
全组84 例, 均为经病理证实的晚期无法手术或术后复发转移无法再次手术的GIST 患者,CD117 表达阳性;治疗前无主要脏器功能障碍,血象正常,一般状况按Karnofsky 评分≥60 分;均为一线治疗;至少有一个可测量病灶可供疗效评价;预计生存>3 个月。本研究经我院伦理委员会通过, 患者签署知情同意书。 其中男53 例,女31 例,男女之比为1.68∶1,中位年龄56 岁(21~80 岁)。肿瘤原发部位胃32 例(38.1%),小肠30 例(35.7%),腹盆腔12 例(14.3%),结直肠8例(9.5%)和食管2 例(2.4%)。 有转移病灶者共63 例(75.0%),转移病例中:肝脏转移27 例(32.1%),腹腔转移33 例(39.3%),纵隔转移2 例(2.4%),肛周会阴转移1 例(1.2%)。 共有70.2%(59/84)的患者既往曾行手术治疗。
1.2 方法
所有患者口服伊马替尼(商品名:格列卫,瑞士诺华制药有限公司,进口药品注册标准JX20010473,进口药品注册证号H20050023)400 mg/d,进餐时服药,并饮一大杯水,持续服用至肿瘤进展或因不良反应不能耐受。
1.3 疗效与不良反应评价
详细记录病史、症状、体格检查,实验室检查包括血常规、肝肾功能,器械检查包括心电图、胸部X线或CT、腹部CT。 初次给药后12 周及此后每3 个月进行疗效和不良反应的评价。 服药12 周以上者评价疗效和不良反应, 不足12 周者不进行疗效评价,仅统计不良反应。 肿瘤客观疗效采用RECIST 标准进行评价,完全缓解(CR)为证实所有病灶完全消失并持续4 周以上,部分缓解(PR)为证实基线病灶长径总和缩小≥30%并持续4 周以上, 疾病进展(PD) 观察到基线病灶长径总和增加≥20%或出现新病灶,疾病稳定(SD)为基线病灶长径总和有缩小但未达PR 或有增加但未达PD。 不良反应依照美国国立癌症研究所的常规毒性判定标准第二版(NCICTC 2.0 版)进行评价[2]。 统计无进展生存期(PFS)即从初次用药至疾病进展或因任何原因死亡的时间间隔。
1.4 统计学方法
采用SPSS 13.0 对所得数据进行统计学分析,计数资料采用χ2检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
全组84 例中位随访时间24 个月 (6~58 个月),均可评价疗效,总有效率(CR+PR)为47.6%,其中CR占1.2%(1/84),PR 占46.4% (39/84),SD 占40.5%(34/84),PD 占12.0%(10/84),疾病控制率(CR+PR+SD) 为88.1%(74/84)。 有效病例常在几天内症状改善,体能状况好转。其中27 例肝脏转移患者有效率为59.3%, 疾病控制率为88.9%,33 例腹腔转移患者有效率为62.5%,疾病控制率为97.0%,腹腔转移与肝脏转移有效率、疾病控制率比较差异均无统计学意义(P >0.05),见表1。 全组中位无进展生存期为19 个月,中位生存期未达到,1 年生存率为97.6%(82/84),2 年生存率为86.9%(73/84)。

表1 伊马替尼治疗晚期胃肠道间质瘤不同转移部位患者的疗效(例)
2.2 不良反应
全组71.4%(60/84) 出现的颜面部和下肢水肿,48.8%(41/84)有轻度恶心、呕吐等消化道反应,44.0%(37/84)有间断腹泻,33.3%(28/84)感觉乏力,51.2%(43/84)出现贫血,白细胞减少占38.1%(32/84),血小板减少有15.5%(13/84),13.1%(11/84)出现肝功能异常。 大部分不良反应均为Ⅰ~Ⅱ级, Ⅲ级不良反应为4.8%(4/84)贫血、6.0%(5/84)白细胞减少,经对症处理后多可恢复,无需停药。 见表2。
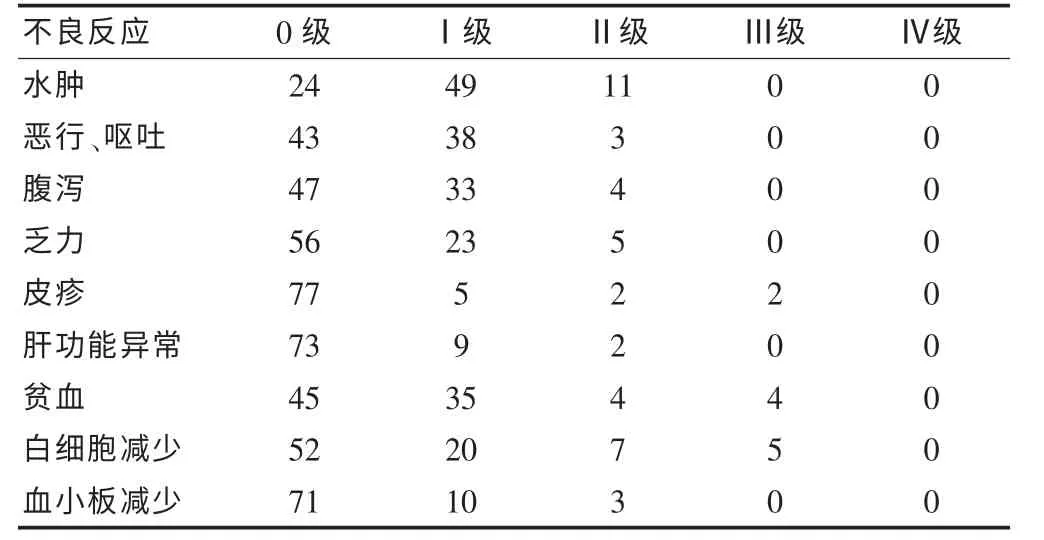
表2 伊马替尼治疗晚期胃肠道间质瘤的不良反应情况(例,n = 84)
3 讨论
GIST 是胃肠道最常见的间叶源性肿瘤, 占胃肠道恶性肿瘤的1%~3%, 发病率约为2/10 万,1983 年Mazur 等[3]首先提出这一概念。 本文报道患者男性多于女性,好发于中老年,发病年龄多在50 岁以上,中位年龄为62.9 岁。 本组男女之比为1.68∶1,中位年龄为56 岁,与文献报道基本相符[4-5]。GIST 发病胃最多,其次为小肠, 结直肠少见,3%~4%原发于胃肠道外,临床表现包括腹胀、腹痛、胃肠道出血、肠梗阻、呕吐、体重下降等, 缺乏特异性, 没有症状的患者有10%~30%[6]。
c-kit 基因包括外显子9、11、13 的点突变和血小板衍化生长因子受体(PDGFRA)的突变在GIST 中频发性存在,引起酪氨酸激酶活化,从而引发细胞凋亡抑制和增殖失控,c-kit 基因的蛋白产物CD117 是Ⅲ型酪氨酸激酶基因生长因子受体,可作为胃肠间质瘤的特征性标志物[7]。 GIST 对于常规放射治疗和化学治疗均不敏感,外科手术切除几乎是伊马替尼问世之前惟一有效的治疗手段。 但文献报道即使完全切除肿瘤,GIST 术后的复发转移率仍有50%[8-9], 还有11%~47%患者就诊时已无法切除或发生转移, 本组有70.2%为术后复发转移者。
伊马替尼是能选择性地抑制KIT、BCR-ABL 和PDGFR 的小分子酪氨酸激酶抑制剂, 与胞质内酪氨酸激酶功能区的ATP 结合位点结合, 阻断由ATP 向蛋白质底物酪氨酸残基转移的磷酸基团,使底物酪氨酸残基不能磷酸化,信号传导中断,从而恢复正常的细胞凋亡,细胞增殖被抑制[10]。 伊马替尼治疗反应的中位时间为12~15 周, 作为FDA 批准的用于治疗转移或复发GIST 的一线药物, 对于晚期患者应连续服用,直至肿瘤进展或不能耐受。有文献报道,伊马替尼一线治疗晚期GIST,对于控制病情发展、延长生存期有一定的效果[11],总获益率可高达84%,部分缓解为65%~70%,稳定为15%~20%,完全缓解在5%以下。本组患者服药12 周疗效评价:完全缓解1 例(1.2%),部分缓解39 例(46.4%),稳定34 例(40.5%),进展10例(12.0%),临床获益率88.1%。 转移性GIST 或GIST术后复发者在伊马替尼出现前行单纯手术切除,预后很差,生存期为6~18 个月。 而本组84 例的中位无进展生存期就已经达到19 个月。
伊马替尼耐受性良好,不良反应相对较轻,常见的非血液学不良反应为水肿(74.1%)、恶心(52.4%)、腹泻(44.9%)、乏力(34.7%)、皮疹(30.6%)[12],多为轻到中度, 可能与KIT 受体和PDGFR 受体阻断有关。本组71.4%出现颜面部和下肢不同程度的水肿,48.8%有恶心呕吐等消化道反应,44.0%出现间断腹泻,33.3%感觉乏力,与文献报道相似[13]。 3~4 级贫血、中性粒细胞减少和血小板减少等血液学不良反应在EROTC-60005 研究中位随访760 d 时的发生率分别为7%、7%和1%[14]。 本组3 级贫血、中性粒细胞减少和血小板减少的发生率分别为4.8%、6.0%和0.0%,无4 级不良反应。 其他不良反应如肝脏毒性(谷丙转氨酶、谷草转氨酶、胆红素升高)程度较轻微,患者一般都能耐受。 本组无因不良反应中断治疗者。
综上所述, 本研究认为伊马替尼一线治疗晚期GIST 疗效好,疾病控制率高,不良反应较轻可耐受,是一线治疗晚期GIST 安全有效的药物。 目前对于伊马替尼一线治疗后疾病进展的患者可予以伊马替尼加量至600~800 mg/d 或舒尼替尼二线治疗。
[1] Agaimy A,Wunsch PH,Hostaedter F,et al.Minute gastric sclerosing stromal tumors(GIST tumorlets)are common in adults and frequently show c-KIT mutations[J].Am J Surg Pathol,2007,31(1):113-120.
[2] Cancer Therapy Evaluation Program. Common toxicity criteria manual:common toxicity criteria[M].version 2.0.Bethesda,Md.:National Cancer Institute,1999.
[3] Mazur MT,Clark HB. Gastrointestinal stromal tumors:reappraisal of histogenesis[J].Am J Surg Pathol,1983,7:507-519.
[4] Blanke CD,Demetri GD,von Mehren M,et al.Long-term results from a randomized phase II trial of standard-versus higherdose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT [J].J Clin Oncol,2008,26(4):620-625.
[5] Heath EI,Infante J,Lewis LD,et al. A randomized,doubleblind,placebo-controlled study to evaluate the effect of repeated oral doses of pazopanib on cardiac conduction in patients with solid tumors [J]. Cancer Chemother Pharmacol,2013,71(3):565-573.
[6] Cichoz Lach H,Kasztelan Szczerbinska B,Slomkam. Gastrointestinal stromal tumors:epidemiology,clinical picture,diagnosis,prognosis and treatment[J].Pol Arch MedWewn,2008,118(4):216-221.
[7] Miettinen M,Yblay J,Sobin LH. Mesenchymal tumors of the stomach.WHO classification of tumors.Pathology and genetics of tumors of digestive system[M].Lyon:IARC Press,2000:62-65.
[8] 钱红纲,郝纯毅.胃肠间质瘤复发和转移的治疗[J].中国实用外科杂志,2010,30(4):281-285.
[9] Joensuu H,Vehtari A,Riihim a∶ki J,et al.Risk of recurrence of gastrointestinal stromal tumour after surgery:an analysis of pooled population-based cohorts[J].Lancet Oncol,2012,13(3):265-274.
[10] Heinrich MC,Corless CI,Demetri GD,et al.Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor[J].J Clin Oncol,2003,21(23):4342-4349.
[11] Rankin C,Von Mehren M,Blanke C,et al.Dose effect of imatinib in patients with metastatic GIST-Phase ⅢSarcoma Group Study S0033 [J]. Proc Am Soc CIin Oncol,2004,23:815.
[12] Demetri GD,Von Mehren M,Blanke CD,et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors [J]. N Engl J Med,2002,347:472-480.
[13] Joensuu H,Trent JC,Reichardt P. Practical management of tyrosine kinase inhibitor-associated side effects in GIST [J].Cancer Treat Rev,2011,37(1):75-88.
[14] Verweij J,Casali PG,Zalcberg J,et al.Progression free survival in gastrointestinal stromal tumors with high dose imatinib:randomized trial [J]. Lancet,2004,364:1127-1134.

