卵巢癌组织中TLR4表达及其临床意义
马 玲
卵巢癌(ovarian cancer,OC)是1种以广泛转移为特征的发生在卵巢上皮细胞、基质及生殖细胞的恶性肿瘤,女性发病率约为1/70,且预后差。大部分卵巢癌患者发病早期无明显的临床表现,现在也无有效的筛查方法,所以大多数患者在诊断时已经为肿瘤Ⅲ期或者Ⅳ期。在疾病晚期,远处转移不可避免,预后更差,长期存活率约为20%[1]。为了提高卵巢癌患者的生存率,寻找能够独立或者辅助传统手术及化学药物治疗的新的途径和治疗方法势在必行。
Toll样受体(toll-like receptors,TLRs)是1种跨膜蛋白,可感应入侵的病原微生物,主要存在于免疫细胞内,如树突状细胞及巨噬细胞[2]。近年来,研究发现TLRs与肿瘤的进展关系密切。已有证据证明肿瘤细胞可以利用TLR信号转导过程来利于自身的生长。TLR配体可通过刺激炎症因子,尤其是NF-kB的活性来促进肿瘤的生长[3]。尤其是对于卵巢肿瘤,Zhou等发现TLR2、TLR3、TLR4及TLR5均在正常卵巢上皮及新生卵巢上皮细胞肿瘤中呈高表达[4]。也有学者发现,TLR4在卵巢颗粒细胞肿瘤细胞中表达增强[5]。本研究通过检测卵巢癌组织中TLR4表达,同时分析TLR4表达与卵巢癌临床特征的关系,以探讨TLR4表达的临床意义。
1 材料与方法
1.1 组织标本的收集
2010年3月至2012年3月,我院妇科收治卵巢癌患者40例,平均年龄(43.8±7.7)岁。均经术后病理检查证实,其中浆液性囊腺癌16例,黏液性囊腺癌12例,子宫内膜样腺癌9例,透明细胞癌1例,未分化癌2例。采用国际妇产科联盟(FIGO)2000年临床分期标准,Ⅰ期5例,Ⅱ期10例,Ⅲ期19例,Ⅳ期6例。组织分化程度:高分化10例,中分化13例,低分化17例。淋巴结转移18例,无淋巴结转移22例。术前均未接受放、化疗或者激素治疗。
手术切除后,立即采集卵巢癌组织及相应的癌旁组织(距肿瘤边缘2~3 cm),立即放入液氮中,-80℃保存。以30例正常卵巢组织标本作为对照,取自同期因子宫或者卵巢良性病变而行手术者,并经术后病理检查证实为正常卵巢组织,患者年龄为(45.6±6.7)岁。
1.2 主要试剂
兔抗人多克隆抗体TLR4购自Sigma公司,Western blot试剂盒购自Pierce公司,蛋白质定量试剂盒、组织蛋白抽提试剂盒购自上海康成公司,Trizol试剂购自Invitrogen life technology,RNA引物由上海英俊公司合成。
1.3 主要仪器
2720型PCR扩增仪为AB公司产品,J2-MC离心机为Beckman公司产品,721分光度计由上海分析仪器厂生产,Western blot实验设备均为Bio-Rad公司产品。
1.4 RT-PCR检测TLR4 mRNA的表达
采用Trizol试剂提取总RNA,经逆转录获取cDNA。取2 μl逆转录产物行PCR反应。TLR4基因引物序列:上游引物为5’GGTCAGACGGTGATAGCGAG-3’,下游引物为5’GGTCCAGGTTCTTGGTTGAG3’,扩增产物长度为255 bp。反应体系总体积为50 μl。反应条件:95℃ 30 s,58℃ 45 s,70℃ 1 min,28个循环。取10 μl反应产物,2%琼脂糖凝胶电泳分离照相,以TLR4灰度积分与相应β-actin灰度积分的比值作为TLR4相对表达强度,重复实验3次。
1.5 Western blot方法检测TLR4蛋白表达
取组织标本,在缓冲液中匀浆,冰浴10 min,4℃、14 000 r/min,离心15 min。提取总蛋白进行蛋白定量。取上清,水煮变性后,按照蛋白定量结果进行加样,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转移至硝酸纤维素膜,5%脱脂奶粉37℃封闭。PBS洗涤后,加入兔抗人TLR4抗体(1∶100)工作液,4℃过夜。充分洗涤后,加羊抗鼠二抗(1∶5 000),室温孵育2 h。PBS漂洗后成像,分析检测结果,以β-actin作为内参照,计算吸光度(A)比值,重复实验3次。
1.6 统计学方法
应用SPSS13.0软件进行统计学分析。计数资料采用卡方检验,计量资料采用方差分析,检验水准α=0.05。
2 结果
2.1 Western blot检测结果
卵巢癌组织中TLR4表达量明显高于相应的癌旁组织及正常卵巢组织;灰度分析结果显示,卵巢癌组织、癌旁组织和正常卵巢组织中其相对表达量分别为0.801±0.073、0.399±0.078和0.134±0.059,卵巢癌组织中TLR4表达量明显高于相应的癌旁组织及正常卵巢组织(P<0.05)。
2.2 RT-PCR检测结果
实时定量PCR检测TLR4 mRNA水平,结果与免疫组化及Western blot结果相一致,TLR4 mRNA表达量卵巢癌组织明显高于癌旁组织和正常卵巢组织(0.0647±0.0253、0.0350±0.0220、0.0167±0.0136,P<0.05)。
2.3 TLR4表达与卵巢癌临床病理特征的关系
40例卵巢癌组织中,TLR4蛋白表达与肿瘤分化程度、FIGO分期、淋巴结转移有关(P<0.05),而与肿瘤大小、病理类型无关(P>0.05),见表1。
3 讨论
TLR4是TLRs中的1个亚型,它是在哺乳动物中最早被发现的与果蝇Toll受体高度同源的TLR。TLR通过激活免疫细胞使机体产生内源性或外源性免疫应答。已有多种研究表明TLR4与肿瘤的发生、发展密切相关。Adam等[6]研究表明TLR4在胃癌、肝细胞癌、前列腺癌、淋巴瘤等多种恶性肿瘤细胞中表达,特别是TLR4的Asp299Gly基因多态性与肿瘤的发生发展高度相关。此外,TLR4在肿瘤细胞的凋亡过程中起重要作用。Cianchi等[7]发现TLR4通过抑制凋亡增强了肿瘤细胞的免疫逃逸。已有文献报道在卵巢上皮癌组织及细胞系中,TLR4为阳性表达,为卵巢癌的治疗提供新的治疗靶点。
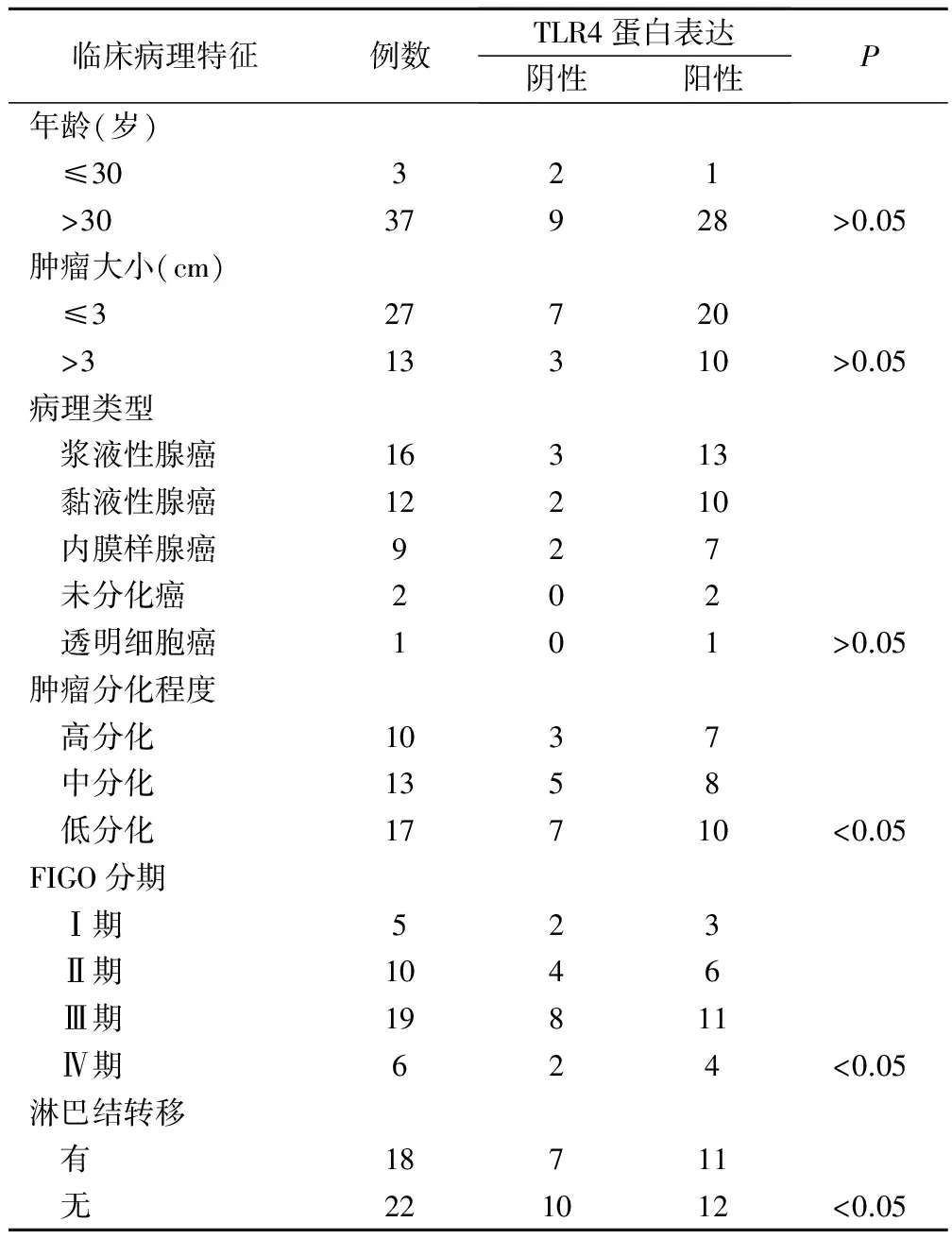
表1 TLR4表达与卵巢癌临床病理特征的关系(例)
近年来发现卵巢癌组织中有多种因子表达,与肿瘤分期或者预后有关[8,9],本研究通过检测卵巢癌组织中TLR4蛋白表达及mRNA水平,并且与癌旁组织及正常卵巢组织进行了比较,结果显示,在卵巢癌组织、癌旁组织及正常卵巢组织中均有TLR4蛋白表达,且以卵巢癌组织中表达水平最高,这与Adam对胃癌、肝细胞癌的研究结果一致。卵巢癌组织中TLR4蛋白表达与患者年龄、肿瘤大小及病理类型无关,但与肿瘤分化程度、淋巴结转移情况及FIGO分期有关,提示TLR4参与卵巢癌组织的恶性远处转移过程。
有研究发现,TLR4拮抗性配体白术内酯Ⅰ可以拮抗TLR4/MyD88信号通路介导的卵巢癌细胞IL-6的分泌,且可以选择性增强紫杉醇对MyD88+卵巢癌细胞的生长抑制作用,为改善紫衫醇治疗MyD88+卵巢癌提供1种新的思路和方法[10]。综上所述,TLR4与卵巢癌细胞的恶性程度关系密切,激活的TLR4通路促进了卵巢癌细胞的增殖、侵袭和转移。
[1] Cannistra.Cancer of the ovary〔J〕.New England Journal of Medicine,2004,351(24):2519.
[2] Takeda,Akirae.TLR signaling pathways〔J〕.Seminars in Immunology,2004,16(1):3.
[3] Huang,Zhao,Unkeless.TLR signaling by tumor and immune cells,a double-edged Sword〔J〕.Oncogene,2008,27(2):218.
[4] Zhou,McFarland-Mancini,Funk.Toll-like receptor expression in normal ovary and ovarian tumors〔J〕.Cancer Immunol Immunother,2009,58(9):1375.
[5] Woods,White,Dau.TLR4 activates NF-κB in human ovarian granulosa tumor cells〔J〕.Biochemical and Biophysical Research Communications,2011,409(4):675.
[6] Adam P,Schmausser B,Miiller-Hermelink HK,et al.Gastric extranodal marginal zone B-cell lymphomas of MALT type exclusively express Toll 1ike receptor 4 in contrast to other lymphomas infiltrating the stomach〔J〕.Ann Oncol,2008,19:566.
[7] Cianchi F,Cortesini C,Fantappie O,et al.Cycloox-enase-2 activation mediates the proangiogenic effect of nitric oxide in colorectal cancer〔J〕.Clin Cancer Res,2004,10:2694.
[8] 陈晓燕,袁 瑞.卵巢癌组织中HMGB和E-cadherin的表达及其意义〔J〕.重庆医科大学学报,2012,7(1):614.
[9] 陈爱平,彭芝兰.bcl-xl、p53蛋白在上皮性卵巢肿瘤中的表达及其临床意义〔J〕.实用癌症杂志,2000,15(6):607.
[10] 王苗苗,黄建鸣,张国楠.白术内酯I拮抗TLR4/MyD88信号通路介导的卵巢癌细胞IL-6的分泌及增强紫杉醇诱导的卵巢癌细胞生长的抑制作用〔J〕.中华妇产科杂志,2011,46(4):288.

