FoxM1在前列腺癌中的表达及其临床意义
王 建
前列腺癌(prostate cancer,PCa)多发于欧美国家,居男性癌症死因的第二位[1]。在我国,随着人均寿命的延长、膳食结构的改变及诊断技术的进步,PCa发病率在逐年提高,已跃居为男性泌尿生殖系统恶性肿瘤的第三位[2]。前列腺癌患者早期无明显症状,死亡的主要原因是癌细胞的浸润与转移。探寻新的有价值的前列腺癌特异分子对于PCa诊断、治疗及预后都有重要意义。大量研究表明,1个Fox基因家族的成员FoxM1,在细胞增殖、凋亡、DNA损伤和肿瘤形成等许多生理过程中均发挥作用[3]。利用芯片技术检测前列腺癌组织的基因表达谱显示,FoxM1在转移性前列腺癌的表达显著增高[4]。本研究采用免疫组化方法检测前列腺癌组织中FoxM1蛋白的表达情况,并分析其与前列腺癌不同临床病理特征之间的相关性。
1 材料与方法
1.1 一般资料
118例前列腺癌患者,中位年龄是69岁(平均年龄71岁,年龄范围42~82岁)。其中<70岁45例,≥70岁73例。按照Gleason评分标准:4~6分42例,7~10分76例。按照TNM分期:T1~T2期56例,T3~T4期62例;N0期104例,N1期14例;M0期102例,M1期16例。另取22例前列腺良性增生组织(BPH)作为对照。
试剂:兔抗人FoxM1多克隆抗体购自美国santa公司;生物素标记二抗、DAB显色试剂盒、柠檬酸盐、PBS等均购自北京中杉金桥生物技术有限公司。
1.2 方法
免疫组化采用SP法:切片脱蜡、水化;PBS洗2~3次各5 min;3% H2O2滴加在切片组织上,室温静置10 min;PBS洗2~3次各5 min;抗原修复;PBS洗2~3次各5 min;滴加封闭液(1%BSA),37℃恒温孵育20 min;甩去多余液体;滴加兔抗人FoxM1多克隆抗体50 μl(1∶50),37℃恒温孵育1 h;PBS洗3次各5 min;滴加生物素标记二抗50 μl(1∶200),37℃恒温孵育1 h;PBS洗3次各5 min;DAB显色5~10 min,在显微镜下掌握染色程度;PBS或自来水冲洗10 min;苏木精复染2 min,盐酸酒精分化;自来水冲洗10~15 min;脱水、透明、封片、镜检。
1.3 结果判断
参照Carcangiu的双记分法,根据细胞阳性染色强度记分为3分(深棕色)、2分(棕色)、1分(淡棕色)和0分(阴性);根据阳性细胞数量多少记分为3分(60%以上)、2分(20%~60%)、1分(20%以下)和0分(阴性)。2种记分的乘积为各检测指标的表达状况,总分≥4分为高表达,≤3分为低表达或阴性。
1.4 统计学分析
采用SPSS13.0统计软件进行统计处理,两因素间差异的比较采用χ2检验或Fisher检验法,以P<0.05为差异有统计学意义。
2 结果
前列腺癌组织FoxM1蛋白的高表达率(63.6%)显著高于良性增生组织(27.3%)(P<0.05);FoxM1蛋白表达水平与前列腺癌患者的年龄无显著相关性(P>0.05),与Gleason评分和TNM分期显著相关(P<0.05)。前列腺癌患者Gleason评分和TNM分期越高,FoxM1蛋白表达水平也越高,见表1。
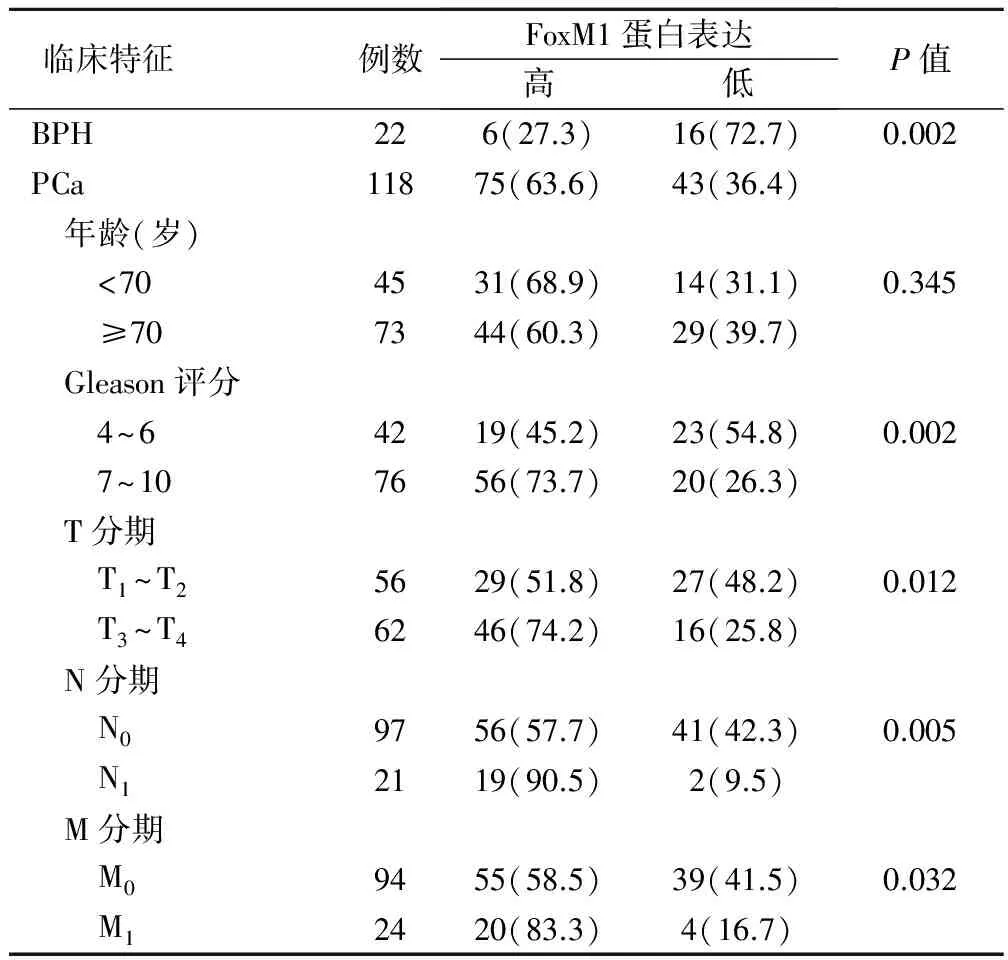
表1 FoxM1蛋白表达与前列腺癌临床特征的关系(例,%)
3 讨论
肿瘤形成是多基因突变、多步骤的过程,受到促癌及抑癌相互拮抗信号通路的调控,导致细胞增殖失控、分化受阻。FoxM1过度表达对于肿瘤细胞的无限增殖或长期生存以及其侵袭、转移等有重要意义。FoxM1可以使细胞周期依赖性的Cdk/cyclins/Ckis异常时相性激活而致肿瘤细胞过度增殖[5]。异常表达的FoxM1还能协同致癌物如乌拉坦、甲基胆蒽或丁羟甲苯促进癌症的发生,是细胞发生恶性转变的重要分子基础[6]。凋亡抑制是肿瘤维持恶性特征的重要因素,FoxM1的存在可以保护具有高水平凋亡诱导因子ROS的增殖细胞免于发生衰老及细胞凋亡[7]。研究显示,FoxM1还参与EMT、肿瘤细胞运动、侵袭及转移前靶器官小环境的形成等,并通过活化Akt-Snail信号途径,激活Stathmin、LOX、LOXL2及其他参与转移的靶基因,进一步促进肿瘤细胞的转移[8]。此外,在胰腺癌细胞系AsPC-1中过表达FoxM1,可通过miR-200b的调节使其表面的间质细胞标志物ZEB1、ZEB2及E-cadherin等活化,获得EMT细胞表型,同时也提高了胰腺癌细胞微球体形成能力,获得CSC的表型。说明FoxM1促使细胞经历EMT,诱导具有CSC表型的产生,在肿瘤的发生、复发、转移等过程中起作用[9,10]。
本研究结果表明,前列腺癌FoxM1蛋白的表达水平显著高于前列腺良性增生组织。在前列腺癌中,随着TNM分期、Gleason评分的增高,FoxM1蛋白表达强度也明显增加。可提示FoxM1可能与前列腺癌的发生和发展有关,即FoxM1的表达增高通过抑制凋亡、促进增殖,增强细胞侵袭和迁移能力,进而促进前列腺癌变和恶性演进。因此,FoxM1蛋白有可能成为前列腺癌的早期诊断的实验室参考指标,同时,通过检测FoxM1蛋白的表达情况还可以了解前列腺癌患者肿瘤的恶性程度及初步判断预后,并且还有望成为前列腺癌治疗的新的分子靶点。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012〔J〕.CA Cancer J Clin,2012,62(1):10.
[2] 王 尉,胡卫列,吕 军,等.Me1-18在前列腺癌中的临床意义〔J〕.实用癌症杂志,2011,26(2):115.
[3] 余琪琪,孟 蕾,谭拥军.转录因子FoxM1--癌症治疗新靶点〔J〕.分子诊断与治疗杂志,2011,3(5):339.
[4] Chandran UR,Ma C,Dhir R,et al.Gene expression profiles of prostate cancer reveal involvement of multiple molecular pathways in the metastatic process〔J〕.BMC Cancer,2007,12(7):64.
[5] Tan Y,Raychaudhuri P,Costa RH.Chk2 mediates stabilization of the FoxM1 transcription factor to stimulate expression of DNA repair genes〔J〕.Mol Cell Biol,2007,27(3):1007.
[6] Wang IC,Meliton L,Ren X,et al.Deletion of Forkhead Box M1 transcription factor from respiratory epithelial cells inhibits pulmonary tumorigenesis〔J〕.PLoS One,2009 4(8):e6609.
[7] Park HJ,Carr JR,Wang Z,et al.FoxM1,a critical regulator of oxidative stress during oncogenesis〔J〕.EMBO J,2009,28(19):2908.
[8] Park HJ,Gusarova G,Wang Z,et al.Deregulation of FoxM1b leads to tumour metastasis〔J〕.EMBO Mol Med,2011,3(1):21.
[9] Bao B,Wang Z,Ali S,et al.Over-expression of FoxM1 leads to epithelial- mesenchymal transition and cancer stem cell phenotype in pancreatic cancer cells〔J〕.J Cell Biochem,2011,112(9):2296.
[10] 公小迪,姜 斌.FoxM1转录因子在肿瘤研究中的新进展〔J〕.现代肿瘤学,2012,20(1):165.

