医学超声关键技术研究和进展(一)超声换能器与超声编码技术
,,, ,,
1.医学超声关键技术国家地方联合工程实验室 (深圳市,518060) 2.广东省生物医学信息检测与超声成像重点实验室(深圳市,518060) 3.深圳大学医学院生物医学工程系(深圳市,518060)
医学超声技术的发展使得超声成像在临床诊断领域发挥着巨大的作用。由于超声成像具有安全、无创、便携、易用、价格便宜等优势,20世纪末超声检查已占据各类医学影像检查方式的四分之一。然而,许多新的医学超声技术仍然在不断涌现,并且从诊断领域跨入了治疗领域。本文在《生物医学工程学进展》分成三期连载,重点从超声关键技术,包括超声换能器、超声编码技术、超声弹性成像技术、超声图像处理与分析技术、超声微泡分子成像与治疗技术和声孔效应等几个方面进行简述和探讨。
1 超声换能器关键技术
医学超声换能器是医疗超声系统中最为核心的声学部件,其研制理论及技术涉及到声学、信息、电子、材料、物理等多个领域。随着临床医学超声影像需求的发展,宽频带、多维高密度、高频、微型化腔内集成探头和环境友好是未来超声换能器发展的主要方向。下面从材料发展、结构创新、应用延伸三个方面做简要综述。
1.1 压电材料的进展迅速
压电陶瓷是目前应用最广泛的压电材料[1]。20世纪90年代取得突破性进展的是弛豫型铁电压电单晶[2]。2004年,飞利浦将压电单晶(PMN-PT)应用到X7-2面阵换能器上[3],图像质量有了突破性提高。但由于单晶生长工艺复杂,成本较高,质硬而脆,成品率低于压电陶瓷,未得到广泛应用。压电高分子聚合物如聚偏氟乙烯(PVDF)[4]以及PVDF与聚三氟乙烯(TrFE)[5]和聚四氟乙烯(TeFE)形成的共聚物[6],柔性易成型、接收灵敏度高,可用来制作宽频带水听器。基于PZT陶瓷的压电复合材料,机电耦合系数高、声阻抗较低且易加工成型,在医用超声换能器中应用较多的是1-3型和2-2型[7],Odile Clade等人用1-3复合材料研制了中心频率为3.5 MHz凸阵和7 MHz线阵[8],相比陶瓷换能器带宽增加了15%~25%。T.R.Shrout等人使用细颗粒压电陶瓷制作2-2型压电复合材料[9],在高频超声换能器中有着很好的应用前景。
压电材料未来的发展趋势是复合化、功能特殊化、性能极限化和结构微型化,近阶段的发展方向集中在:高居里温度压电材料、细晶粒压电陶瓷、无铅压电材料三个方面[10-13]。
1.2 结构的创新发展
基于厚度振动模态的传统压电超声换能器,均是基于压电振子、匹配层、背衬等核心结构[14],然而传统换能器的设计及工艺,已经难以满足探头微型化、集成精密化的发展趋势。近年来国际上有学者利用由集成半导体工艺衍生而来的MEMS微加工工艺,开发了一类新型的医用超声换能器:微加工超声换能器(Micromachined Ultrasonic Transducers, MUTs)。MUTs利用微薄膜的弯曲振动发射和接收超声波,省却了传统换能器中的匹配层和背衬。根据机电转换机制的不同,MUTs可以进一步划分为电容式cMUT(capacitive MUT)和压电式pMUT(piezoelectric MUT)两种。
1.2.1cMUT技术
cMUT最早是由美国斯坦福大学Haller和Khuri-Yakub研究小组提出[15]。cMUT单元具有典型的微型膜片-气隙结构,由薄膜、支撑梁柱、重掺杂硅底座和金属电极组成的,其结构如图1所示[16]。cMUT最大的优势在于超宽的频带宽度,如:2005年,Chris Daft等人研制了3.5 MHz、128阵元的cMUT凸阵探头[17],如图2所示,-6 dB脉冲宽度为0.185 μs, -6 dB带宽达125%。该凸阵探头的脉冲响应波形与凸阵探头的频谱曲线见参考文献[17]。

图1 cMUT 单元结构Fig.1 The unit structure of capacitive micromachined ultrasonic transducers[16]
目前,cMUT的研制还面临些挑战,例如,为提升其灵敏度,需将前置放大电路与换能器集成在一起,此外,cMUT微电容单元必须施加一个适当的直流偏压才能工作。总之,其对加工环境要求很高,需要昂贵的设备和较复杂的制程。现阶段cMUT的制作工艺还不够成熟,目前仍处于实验室阶段。
1.2.2pMUT技术
pMUT是集压电薄/厚膜技术和硅微加工技术于一体,利用振膜的弯曲振动模式发射和接收超声波的器件。目前,传统的pMUT基本单元,如图2所示。

图2 传统压电式微加工超声换能器(pMUT)结构Fig.2 The traditional structure of piezoelectric micromachined ultrasonic transducers
然而,pMUT[18-21]也还存在一些不足:一是结构方面,大约一半的能量被非压电层完全消耗掉,最近有学者设计研制了单压电层的穹顶结构pMUT,机电转换性能得到大幅提高[22-23];二是工艺方面,对压电层、非压电层的厚度精确控制还存在一定的困难。这些不利因素在一定程度上影响了换能器的性能。
1.3 应用向专业化延伸
1.3.1光学及超声集成应用
超声内窥镜(EUS)弥补了电子内窥镜仅能观察腔内粘膜表面病变的不足,以电子内窥镜为基础,将超声换能器经由内窥镜活检通道深入体腔。日本的Olympus和Fujinon公司已经研制出各种类型的超声内窥镜产品,对消化道肿瘤、粘膜下肿瘤、胰腺病变等疾病的诊断具有重要的意义。超声内窥镜的发展对超声换能器制作提出了新的要求,主要表现在细径、高频以及变频技术。
1.3.2心脑血管科的应用
血管内超声(IVUS)是结合了无创的超声诊断与微创的导管介入技术的新型诊断方法。将工作频率一般在(20~50) MHz的微型高频超声换能器安装在长约140 cm,细约1 mm柔韧的导管顶端,经导丝将导管送到靶病变部位或要观察的血管段的远端。血管内超声探头大致划分为机械旋转型单探头[24]和电子扫描阵列式探头[25]两种,前者通过导管近端的电机驱动轴旋转单探头来获取组织图像,如图3所示。后者则由多个阵元(目前为止最多64个)呈环形排列在导管顶端,通过电子开关的逐次连续激励,而获得360°横断面图像,但图像分辨率较机械扇扫探头差。

图3 (a)机械旋转型导管探头[24] (b)电子扫描阵列式导管探头[25]Fig.3 (a) Mechanical rotary catheter probe. (b) Electronically scanned array catheter probe
1.3.3心脏实时三维超声成像
目前,心脏三维成像仪操作复杂,非实时显示,不能有效诊断疾病,实时三维超声心动图成像法引起了人们的广泛关注[26]。为了实时显示心脏的动态结构,面阵换能器即多维高密度超声换能器的研制引起了人们的极大兴趣。国内外的研究非常活跃,以美国和欧洲地区为代表。最早由美国Duke大学的Olaf T. Von Ramm和Stephen W. Smith教授提出并研制成功[27]。目前用于临床的商业化面阵探头,主要采用单晶材料,频率为(1~7) MHz,代表性产品型号如下:Philips的 X7-2 、X6-1 、X3-1 、X5-1 、X7-2t;GE的 4V-D、3V;Toshiba的 PST-25SX;Siemens的4Z1c。然而研制面阵换能器存在着很多技术难题[28],如灵敏度低、阵元引线复杂、系统发射/接收通道数等问题。
1.3.4高频探头
医学成像对更高分辨率的追求,使得高频超声(≥20 MHz)成像成为一个研究热点。在皮肤科、口腔科、眼科、肌肉骨骼系统疾病的诊断,以及小动物活体成像等领域得到广泛应用。此外,超高频(≥50 MHz)超声可以有效地诊断青光眼和眼部肿瘤。美国南加州大学NIH医学超声换能器技术中心在该领域处于领先地位,Shung K.K教授领导的团队研制了多种高频超声换能器,例如中心频率为67 MHz和100 MHz的32阵元超声换能器阵列[29]。加拿大Sunnybrook研究中心S.Foster教授领导的团队,研制了(30~80) MHz高频超声换能器。美国Volcano生产的Revolution心血管内导管系统,使用了中心频率为45 MHz的相控阵。美国Boston Scientific研制了含有40 MHz机械旋转超声换能器的iCross心血管内导管超声系统。国内学者也研制了中心频率为(10~20) MHz的用于眼科超声成像的压电单晶环型电子相控阵,经测试-6 dB的带宽达到77%左右[30],相对灵敏度~27dB。
2 超声编码技术发展和展望
信噪比和帧频是医学超声系统中最为重要的两个指标。目前,在大多数的医学超声成像系统中,成像机制是对不同的采样点发射相同的单载波、短脉冲。这种机制限制了成像质量和帧频的进一步提高。主要表现在峰值功率与平均功率之比很大,平均功率小、不同采样点间的干扰较大、信噪比差[31],同时无法解决分辨力与穿透力的矛盾[32]。这就迫切需要新的技术来解决这些问题。
而在医学超声成像系统中,发射信号的带宽和信号持续时间是系统的重要资源,如果能充分利用,那么传统超声系统的诸多矛盾和限制就有可能被解决和突破,这就是医学超声系统中采用编码信号的初衷。
2.1 超声编码检测原理
超声编码检测系统是基于脉冲压缩机制,与传统的脉冲回波成像系统的区别在于:发射宽带、长持续时间的编码调制信号,接收端对回波信号需要进行解码(脉冲压缩),来恢复成像脉冲。通常发射编码信号需要具有良好的相关性,解码采用匹配滤波器。基本工作原理如图4所示。

图4 超声编码检测原理图Fig.4 Principle of ultrasound detection with coded excitation
相对传统单脉冲方式,发射信号的带宽和持续时间都有可能增加,这种增加可以为信噪比的提高做贡献[33]。当前研究和应用的超声编码方式主要有巴克码(Barker)、m序列、格雷码(Golay)和调频编码(Chirp)。
2.2 超声编码检测研究现状
编码信号用于医学超声成像的研究可以追溯到1974年,白噪编码的超声成像和多普勒测量系统的提出[34]。1979年,Takeuchi研究了在医学超声成像中使用扩频技术,并指出了编码信号的时间带宽限制[35]。此后,由于超声系统的复杂度(包括传播媒质和采用的动态聚焦等技术),这个方向的研究相对沉寂了近十年。
GE公司的研发人员为编码超声的工程化贡献突出,O'Donnell论述了预期提高的信噪比,得出采用编码方法信噪比可以提高(15~20) dB的结论,这为编码超声的工程化奠定了基础。Chiao和 Thomas 领导的小组在90年代末实现了编码超声的产业化,他们采用的是Golay序列或正交Golay序列。国内,陈思平教授在西安交通大学较早地进行了这个领域的理论研究,并提出了超声多普勒扩谱技术[36]。
目前的超声编码检测研究大多在探讨编码信号的选择、脉冲压缩机制和抑制距离旁瓣等问题,最重要的就是编码信号的选择,其中最为广泛研究的编码波形是线性调频(LFM)信号[37-40]。Behar 与 Adam 研究了脉冲压缩过程的参数优化[41];对于超声的频率相关衰减问题,Rao指出超声衰减将导致 TBP 减少,从而降低信噪比[42];Eck 等人基于一个简单的超声衰减模型,为LFM信号设计了随深度变化的非匹配滤波器[43]。中国科技大学彭虎教授对基于线性调频信号的高帧率超声成像进行了仿真研究[44]。清华大学高上凯教授研究小组对基于Barker码的编码检测在提高信噪比及穿透深度方面进行了探讨[45-46]。深圳大学覃正笛教授提出了一种新的可以作为动态信号检测的超声编码方法,该方法将编码长度由单个脉冲时限扩展到整个实时参量估计的时间窗内来进行考虑,提出了分段式长码的概念[47-48]。图5,6中的纵坐标代表检测的信号功率。

图5 (a)为用普通的短码调制发射所得到的模糊函数,(b)为用分段式长码调制发射所得到的模糊函数Fig.5 (a) Aambiguity function with common short code excitation(b) ambiguity function with truncated long code excitation
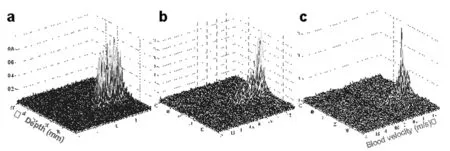
图6 编码超声测量血流的水槽试验结果(a)传统的脉冲式发射,其中发射的脉冲宽度为8个波长,(b)用13位的Baker码,(c)用16X256的分段式长码Fig.6 (a) Aambiguity function with common short code excitation (b) Ambiguity function with truncated long code excitation(c)With the 16X256 segment length code
可以看出,编码系统的信号检测灵敏度和穿透能力要远远优于未编码系统,而采用分段式长码后,空间分辨率有了显著的提高[49]。
在新应用方面,Misaridis研究了使用编码信号实现快速超声成像[33];同样,用于快速成像Gran采用了频分的方法[50]。帧频的提高,类似于通信中码分多址的思想。通常要采用正交编码,通过同时向不同的方向发射不同的超声编码信号,然后通过不同的匹配滤波器的解码,同时得到多个方向的回波数据[51]。目前在国外,丹麦技术大学的快速成像实验室、波兰科学院超声部等研究机构仍然在进行这方面的研究,并时有新的成果[50,52]。文献最早研究将编码检测技术应用到弹性成像中[53], 彭辉等人将 Chirp 编码激励应用到一个实时的超声弹性成像系统上,结果表明使用 Chirp 信号作为弹性成像系统的激励信号,使应变图像质量有了大幅提高[54]。
2.3 超声编码检测技术难点
编码信号很早就被成功地应用于其他测量领域,如雷达和移动通信系统,而被研究与应用到医学超声成像中却比较晚,只是在最近20年才有了长足的发展。目前的医用超声设备中,只有GE公司和西门子公司的高档进口设备中采用了编码检测技术。国产超声设备还没有采用编码检测技术的报道。这主要由以下原因造成。
(1) 医学超声的特殊性
由于人体结构的复杂性,增加了编码超声实现的复杂性。在雷达系统中是对独立目标的检测,而超声成像系统是对整个人体组织的成像,要求更高的显示动态范围,这对编码的相关性提出了更高的要求;又由于在人体组织内超声随频率变化的高度衰减、非线性传播、组织的运动等,这些都会使接收波形失真,并可能降低编码性能;同时斑点(随机高斯信号)的存在,使问题更为复杂。
在脉冲-回波式的超声成像技术中,脉冲发射过程中可以用来进行编码调制的时间长度是非常有限的。一般来说,对单一脉冲只能做到数个乃至十来个码元的编码调制。对于如此短的码序列来说很难得到好的相关特性,因此会严重影响到成像质量,主要是由于模糊函数的旁瓣产生的伪像。这就对编码系统的结构和码序列的选择提出更高的要求。
从另一方面来说,编码发射与接收是一个比较严格的相关过程,人体软组织中超声传播的非线性会直接影响到编码信号的相关特性。所以在无有效补偿的前提下,任何好的编码序列在非线性声场中都会失去其好的相关特性。这就是为什么目前大多数的研究工作都止步于计算机模拟和水槽实验阶段,真正成功地应用于人体的编码超声技术者还为数不多。将编码探测技术应用到医疗超声领域,急需解决超声在人体软组织中传播的非线性衰减问题。
(2) 电子技术的约束
传统的超声电路,电路非常简单,极易实现。而采用编码信号,就其要求严格控制发射脉冲的幅度和相位,造成了系统的复杂,而且提高了系统的总功耗。不过随着半导体工艺的提高,集成高压快速开关电路和低功耗高压宽带功率电路的出现,以及超声成像系统的数字化,编码信号已经开始用于超声成像系统了。
(3) 传统成像方式的技术对编码检测的影响
传统超声系统中采用的时间增益补偿、动态聚焦等技术,对短脉冲很适合,但对持续时间相对长的编码信号就有一定影响。如果动态聚焦和时间增益控制在脉冲压缩之前,将导致接收到的编码波形失真。但如果将脉冲压缩放在动态聚焦之前,这需要每个阵元配置一个相关器,代价昂贵。
(4) 系统资源的约束
采用编码信号,需要系统提供相对充分的带宽和发射持续时间。但在一些超声应用中,这两个资源是很有限的,这就限制了编码检测技术的使用。
2.4 发展趋势和展望
超声编码探测技术依然是国内外研究的热点之一,在医学超声中新的应用领域,尤为突出,如合成孔径成像、弹性成像。目前合成孔径成像(国内也称为高帧频成像)在国外已经广泛研究,是通过多次发射穿透整个成像区的球面波,合成图像。合成孔径成像的帧频不是由扫描线的数量决定,而是由发射阵元的数量决定。但是稀疏合成孔径成像与传统相控阵成像相比,信噪比低。利用编码技术(空间编码)可以实现增加帧频而不牺牲信噪比。所以编码信号在合成孔径成像的研究仍将是今后研究的热点。利用编码检测可以提高回波信噪比的特性,超声编码探测技术在超声弹性成像领域也将被广泛应用。随着研究的深入,研究将更具实用性,研究对象更接近真实的医学超声环境,甚至出现更多的临床实验与评估。
[1] 裴先茹, 高海荣. 压电材料的研究和应用现状[J]. 安徽化工, 2010, 36(003): 4-6.
[2] Park S E, Shrout T R. Ultrahigh strain and piezoelectric behavior in relaxor based ferroelectric single crystals[J]. J Appl Phys, 1997, 82(4): 1804-1811.
[3] www.healthcare.philips.com/in_en/products/ultrasound/technologies/purewave.wpd.[EB/OL]
[4] Kawai H. The piezoelectricity of poly (vinylidene fluoride)[J]. Jpn J Appl Phys, 1969, 8(7): 975-976.
[5] Legrand J. Structure and ferroelectric properties of P (VDF-TrFE) copolymers[J]. Ferroelectrics, 1989, 91(1): 303-317.
[6] Brown L F. Design considerations for piezoelectric polymer ultrasound transducers[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2000, 47(6): 1377-1396.
[7] 伍于添. 医学超声设备原理·设计·应用[M]. 科学技术文献出版社. 2012.
[8] Clade O, Felix N, Lacaze E. Linear and curved array with advanced electroacoustic and acoustic properties[A]. IEEE Ultrasonics Symposium: IEEE[C]. 2002.
[9] Shrout T R, Park S E, Lopath P D, et al. Innovations in piezoelectric materials for ultrasound transducers[A]. Society of Photo-Optical Instrumentation Engineers (SPIE) Conference Series[C]. 1998.
[10] Birol H, Damjanovic D, Setter N. Preparation and characterization of (K0. 5Na0. 5) NbO3 ceramics[J]. J Eur Ceram Soc, 2006, 26(6): 861-866.
[11] Kakimoto K, Masuda I, Ohsato H. Lead-free KNbO3 piezoceramics synthesized by pressure-less sintering[J]. J Eur Ceram Soc, 2005, 25(12): 2719-2722.
[12] 杨庆庆, 李全禄, 吴晶等. 压电材料的研究和应用现状[J]. 西安邮电学院学报, 2011, 16(S2): 4-6.
[13] 赵亚, 李全禄, 王胜利等. 无铅压电陶瓷的研究与应用进展[J]. 硅酸盐通报, 2010, 29(3).
[14] Vos H J, Frijlink M, Droog E, et al. Transducer for harmonic intravascular ultrasound imaging[J]. IEEE Trans. Ultrason Ferroelectr Freq Control, 2005, 52(12): 2418-2422.
[15] Jin X, Ladabaum I, Khuri-Yakub B T. The microfabrication of capacitive ultrasonic transducers[J]. J Microelectromech Syst, 1998, 7(3): 295-302.
[16] Oralkan O, Ergun A S, Johnson J A, et al. Capacitive micromachined ultrasonic transducers: Next-generation arrays for acoustic imaging[J]. IEEE Trans. Ultrason. Ferroelectr Freq Control, 2002, 49(11): 1596-1610.
[17] Daft C, Wagner P, Bymaster B, et al. cMUTs and electronics for 2D and 3D imaging: monolithic integration, in-handle chip sets and system implications[C]. IEEE Ultrasonics Symposium: IEEE, 2005.
[18] Akasheh F, Myers T, Fraser J D, et al. Development of piezoelectric micromachined ultrasonic transducers[J]. Sens Actuators A Phys, 2004, 111(2): 275-287.
[19] Bernstein J J, Finberg S L, Houston K, et al. Micromachined high frequency ferroelectric sonar transducers[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1997, 44(5): 960-969.
[20] Chang S H, Tung Y C. Electro-elastic characteristics of asymmetric rectangular piezoelectric laminae[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1999, 46(4): 950-960.
[21] Perçin G, Khuri-Yakub B T. Piezoelectrically actuated flextensional micromachined ultrasound transducers. II. Fabrication and experiments[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2002, 49(5): 585-595.
[22] Peng J, Chao C, Tang H. Piezoelectric micromachined ultrasonic transducer based on dome-shaped piezoelectric single layer[J]. Microsyst Technol, 2010, 16(10): 1771-1775.
[23] Peng J, Chao C, Tang H. Piezoelectric micromachined ultrasonic transducer with a dome-shaped single layer structure[C]. Materials Science Forum: Trans Tech Publ, 2011.
[24] www.bostonscientific.com/home.bsci.
[25] Schulze-Clewing J, Eberle M J, Stephens D N. Miniaturized circular array for intravascular ultrasound[C]. IEEE Ultrasonics Symposium: IEEE, 2000.
[26] Wang X F, Deng Y B, Nanda N C, et al. Live three‐dimensional echocardiography: imaging principles and clinical application[J]. Echocardiography, 2003, 20(7): 593-604.
[27] Von Ramm O T, Smith S W. Real time volumetric ultrasound imaging system[J]. J. Digital Imaging, 1990, 3(4): 261-266.
[28] Smith S W, Lee W, Light E D, et al. Two dimensional arrays for 3-D ultrasound imaging[A]. IEEE Ultrasonics Symposium: IEEE[C], 2002.
[29] Cannata J M, Williams J A, Zhou Q, et al. Development of a 35-MHz piezo-composite ultrasound array for medical imaging[J]. IEEE Trans. Ultrason. Ferroelectr. Freq. Control, 2006, 53(1): 224-236.
[30] Frinking P J, Tardy I, Theraulaz M, et al. Effects of acoustic radiation force on the binding efficiency of BR55, a VEGFR2-specific ultrasound contrast agent[J]. Ultrasound Med Biol, 2012, 38(8): 1460-1469.
[31] O'Donnell M. Coded excitation system for improving the penetration of real-time phased-array imaging systems[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1992, 39(3): 341-351.
[32] Chiao R Y, Hao X. Coded excitation for diagnostic ultrasound: a system developer's perspective[J]. IEEE Trans. Ultrason. Ferroelectr. Freq. Control, 2005, 52(2): 160-70.
[33] Misaridis T, Jensen J A. Use of modulated excitation signals in medical ultrasound, Part III: High frame rate imaging[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2005, 52(2): 207-218.
[34] P. J. Bendick, Newhouse V L. Ultrasonic random-signal flow measurement system[J]. J Acoust Soc of America, 1974, 56: 860-870.
[35] Takeuchi Y. An investigation of a spread energy method for medical ultrasound systems. Part one: theory and investigation[J]. Ultrasonics, 1979, 17(4): 175-82.
[36] 陈思平,程敬之. 超声多普勒扩谱技术及伪随机码彩色超声多普勒血流成像研究[J]. 中国生物医学工程学报, 1991, 10(1):56-65.
[37] Misaridis T, Jensen J A. Use of modulated excitation signals in ultrasound. Part II: Design and performance for medical imaging applications.[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2005, 52(2): 191-206.
[38] Pollakowski M, Ermert. H. Chirp signal matching and signal power optimization in pulse-echo mode ultrasonic nondestructive testing [J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1994, 41(5): 655-659.
[39] Wilhjelm J E, Pedersen P C. Target velocity estimation with FM and PW echo ranging Doppler systems. II. Systems analysis[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1993, 40(4): 373-380.
[40] Wilhjelm J E, Pedersen P C. Target velocity estimation with FM and PW echo ranging Doppler systems I. Signal analysis[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1993, 40(4): 366-372.
[41] Behar V, Adam D. Parameter optimization of pulse compression in ultrasound imaging systems with coded excitation[J]. Ultrasonics, 2004, 42(10): 1101-1109.
[42] Rao N A. Investigation of a pulse compression technique for medical ultrasound: a simulation study[J]. Med Biol Eng Comput, 1994, 32(2): 181-188.
[43] Eck K, Schwann R, Brenner A R, et al. Depth-dependent mismatched filtering using ultrasonic attenuation as a filter design parameter[J]. IEEE Ultrasonics Symposium, 1998,1639-1644.
[44] 韩雪梅, 彭虎, 杜宏伟等. 基于线性调频信号的高帧率超声成像系统[J]. 中国生物医学工程学报, 2006, 6: 700-704.
[45] 项 雷, 高上凯. 编码激励在脉冲Doppler超声血流测量中的应用[J]. 清华大学学报, 2008, 48(6): 1032-1035.
[46] 赵珩, 高上凯. 超声二进制编码激励血流测量的实验研究[J]. 中国生物医学工程学报, 2007, 26(1): 12-18.
[47] Qin Z D, Chen S P, Chen X, Coded transmission for ultrasound Doppler detection using truncated long code[A]. in 2010 3rd International Conference on Biomedical Engineering and Informatics (BMEI)[C]. 2010,159-161.
[48] 覃正笛, 陈思平, 金程. 实现脉冲超声检测的方法、系统、装置、发射机和接收机[P]. 2012.01.18.
[49] Qin Z D, Liu D Q, Chen S P. Experimental study on the truncated long code sequence for ultrasound Doppler detection[A]. in 5th International Conference on Biomedical Engineering and Informatics[C]. Chongqing, China, 2012.
[50] Gran F, Udesen J, Nielsen M, et al. Coded ultrasound for blood flow estimation using subband processing[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2007, 55(10): 2211 - 2220.
[51] Shen J, Ebbini E S. A new coded-excitation ultrasound imaging, Part I: Basic principles[J]. IEEE Trans. Ultrason Ferroelectr Freq Control, 1996, 43(1): 141-148.
[52] Nowicki A, Klimonda Z, Lewandowski M, et al. Direct and post-compressed sound fields for different coded excitations[J]. Acoust Imaging, 2007, 28: 399-407.
[53] Liu J, Insana M F. Coded pulse excitation for ultrasonic strain imaging[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2005, 52(2): 231-40.
[54] 彭辉, 刘东权. Chirp编码激励在超声弹性成像系统中的应用研究[J]. 中国生物医学工程学报, 2011, 30(4): 514-519.

