MnOx中锰离子的价态和含量的研究
胡 华,方 德,石再莹,马 娟,梅 笛,何 峰
(武汉理工大学硅酸盐建筑材料国家重点实验室,湖北 武汉 430070)
0 前言
常见的锰氧化物有 MnO、MnO2、Mn2O3和Mn3O4等形式,锰离子的价态与分布对锰基电池材料和催化材料的性能有着重要影响,因此测定MnOx中锰的价态具有重要的意义。吕正中等[1]研究了将低价锰氧化成高锰酸根离子的条件,并确定了差示光度法测定高锰酸根离子,借此测定高含量锰的分析方法。Furman[2]提出测定总锰量和有效氧后通过计算求 MnO、MnO2含量,但无 Mn3+的测定。吴辛友[3]利用选择溶解法对二氧化锰中 Mn2+、Mn3+、Mn4+进行了测定,须严格控制溶解温度和时间。熊奇等[4]对尖晶石中四氧化三锰的离子分布进行了研究,计算出3种不同价态锰离子在尖晶石中的离子分布,从而最终确定其结构。目前,研究工作主要集中在1种或者2种锰氧化物,但是没有考察测试方法对其他锰氧化物的适应性。本文将MnO、MnO2、Mn2O3和 Mn3O4作为研究对象,以硫酸—硫酸铵作为Mn2+的选择性溶剂,使之与Mn3+、Mn4+分离,测定Mn2+的含量,然后以草酸钠还原返滴定法测定其中的Mn3+、Mn4+的总含量,以EDTA滴定法测量Mn2+、Mn3+、Mn4+的总含量,最后分别计算出Mn2+、Mn3+、Mn4+的含量和平均价态,方便快捷。
1 试验部分
1.1 主要试剂
硫酸铵溶液3 mol/L;EDTA C1=0.02 mol/L,由钙标准溶液标定;草酸钠溶液C2=0.20 mol/L;草酸钠标准溶液C3=0.025 mol/L,由高锰酸钾标准溶液标定;高锰酸钾标准溶液C4=0.010 0 mol/L;硫酸溶液浓度5 mol/L;氨—氯化铵缓冲溶液的pH=10;铬蓝黑R指示剂5 g/L;碳酸钙;抗坏血酸;氨水。
1.2 试验方法
1.2.1 硫酸—硫酸铵选择性溶解Mn2+及其测定
原理:以硫酸—硫酸铵作为Mn2+的选择性溶剂,使Mn2+与固态样品中的Mn3+和Mn4+分离。利用EDTA滴定法测量溶液中Mn2+,从而得到样品中Mn2+的含量。化学反应方程式为:
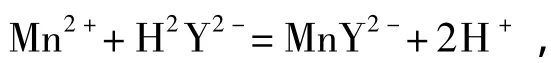
式中 H2Y2-——EDTA。
方法:称取样品0.050 0 g于250 mL锥形瓶中,加入20 mL硫酸铵溶液、5 mL硫酸溶液,置于94℃水浴锅中加热15 min。待试样溶解后(确实不能溶的,需过滤),加入0.1 g抗坏血酸,用氨水调节pH值至中性,加入20 mL氨—氯化铵缓冲溶液,再滴加5~10滴铬蓝黑R指示剂,用EDTA标准溶液滴定,终点时溶液由紫红色经由蓝紫色转为蓝色,消耗的EDTA体积为V1,同样方法做空白试验,所测的结果记为V1'。设 Mn2+的含量为 X mol,则X=C1(V1-V1')。
1.2.2 Mn3+和 Mn4+总含量的测定
原理:以草酸钠还原返滴定法测定其中的Mn3+、Mn4+的总含量,以高锰酸钾滴定过剩的草酸钠,建立 Mn3+、Mn4+含量的关系式。在酸性条件下,样品中的 Mn3+和 Mn4+被草酸根还原,形成Mn2+进入溶液。化学反应方程式为:
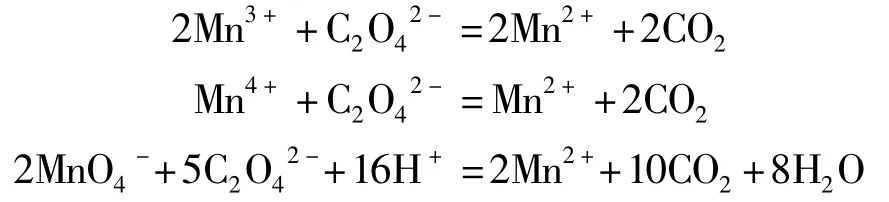
方法:称取相同质量的试样于锥形瓶中,准确加入25.00 mL(记为V2)草酸钠标准溶液和5 mL硫酸溶液,于78℃水浴锅中加热50 min左右,用高锰酸钾溶液滴定滤液中过剩的草酸钠,溶液由无色变为浅紫色并保持30 s不褪色,即为终点,消耗的高锰酸钾体积记为V3。同样方法做空白试验,所测的结果为V3'。设Mn3+和Mn4+离子的含量分别为Y,Z mol,则Y+2Z+5C4(V3-V3'+C3V5/5C4)=2C3V2。
1.2.3 总锰量(Mn2+、Mn3+、Mn4+)的测定
原理:以草酸钠、硫酸混合溶液作为溶剂,将样品溶解,锰离子以二价的形式存在。利用EDTA滴定法测量溶液中总锰的含量,化学反应方程式为:
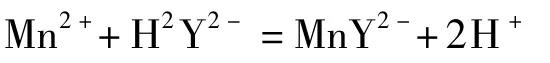
方法:称取相同质量的试样于锥形瓶中,准确加入25.00 mL草酸钠溶液、5 mL硫酸溶液,于78℃水浴锅中加热15 min左右,加入0.1 g抗坏血酸,用氨水调节值至pH中性,加入20 mL氨—氯化铵缓冲溶液,再滴加5~10滴铬蓝黑R指示剂,用EDTA标准溶液滴定,溶液由紫红经由蓝紫色转为蓝色,即为终点,消耗EDTA的体积为V4。同样方法做空白试验,所测的结果记为V4',则X+Y+Z=C1(V4-V4')。
2 测试条件的研究
为了探究不同的溶解条件对测试结果的影响,对溶解温度、时间以及硫酸铵、缓冲溶液的用量等主要因素进行了研究。
2.1 溶解时间与温度
对 MnO、Mn2O3、Mn3O4和 MnO2样品进行1.2.1或1.2.3 测试时,在水浴加热 15 min 左右即可溶解,但是进行 1.2.2 测试时,Mn2O3、Mn3O4和MnO2样品都溶解较慢。选用MnO2来研究溶解时间的影响,其测试结果见表1。
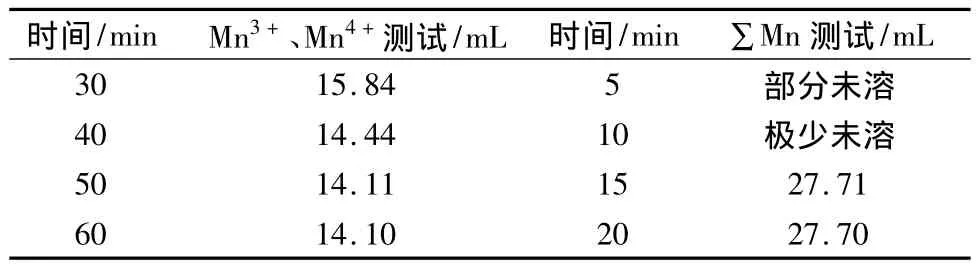
表1 加热时间对MnO2的影响
从表1可以看出,在测试MnO2样品中总锰含量时,15 min后MnO2溶解完全,延长溶解时间后,测定值基本保持稳定,因此选择溶解时间为15 min。在测试MnO2样品中Mn3+和Mn4+总含量时,50 min以后,测量值基本稳定,故选择溶解时间为50 min。在测试Mn2O3和Mn3O4样品中Mn3+和Mn4+总含量时,得到了类似的试验条件,这可能是因为加入的草酸钠溶液的浓度较低,导致溶解时间比较长。
进行1.2.2 和1.2.3 测试时,当温度高于 90℃,溶液中少量的草酸发生分解,导致测试结果误差大和数据稳定性差;若温度低于70℃,则反应速率太慢。经过测试,选择78℃作为加热溶解试样的温度。
2.2 硫酸铵的用量
在测试Mn2+时,硫酸铵溶液主要起到选择性溶解的作用,用量过少,Mn2+不能完全被选择性溶解出来。选用MnO、Mn3O4来研究硫酸铵用量的影响,其测试结果见表2。
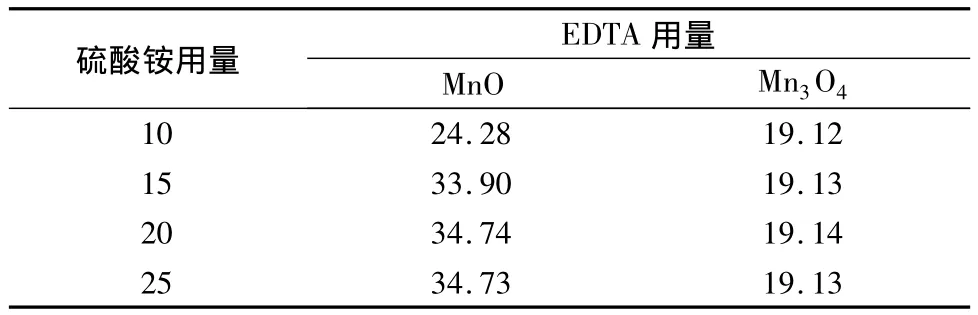
表2 硫酸铵用量的溶解效果测试 mL
表2结果表明:我们选择MnO和Mn3O4来研究硫酸铵用量对试验结果的影响,研究表明:硫酸铵溶液的用量在15 mL以上对试验基本没有影响,测定结果基本稳定,选用20 mL。
2.3 缓冲溶液的用量
在1.2.1 和 1.2.3 测试中,锰离子的滴定需要控制滴定条件为pH=10左右。试验表明:氨—氯化铵缓冲溶液的用量在15~25 mL内对数据均无影响,测定结果基本稳定,故选用20 mL。
3 准确度及误差分析
根据得到的锰的价态测定的最佳试验条件,对4种高纯度的氧化物进行了测试,检测该试验方法的适应性与稳定性,测试结果如表3~6所示。表3结果表明:样品中没有Mn3+和Mn4+,说明样品中的锰以二价的形式存在。同时,根据Mn2+测试的结果计算的样品总锰量和∑Mn测试的总锰结果基本一致,相对误差为1.57%,这进一步表明样品中只有二价的锰离子。
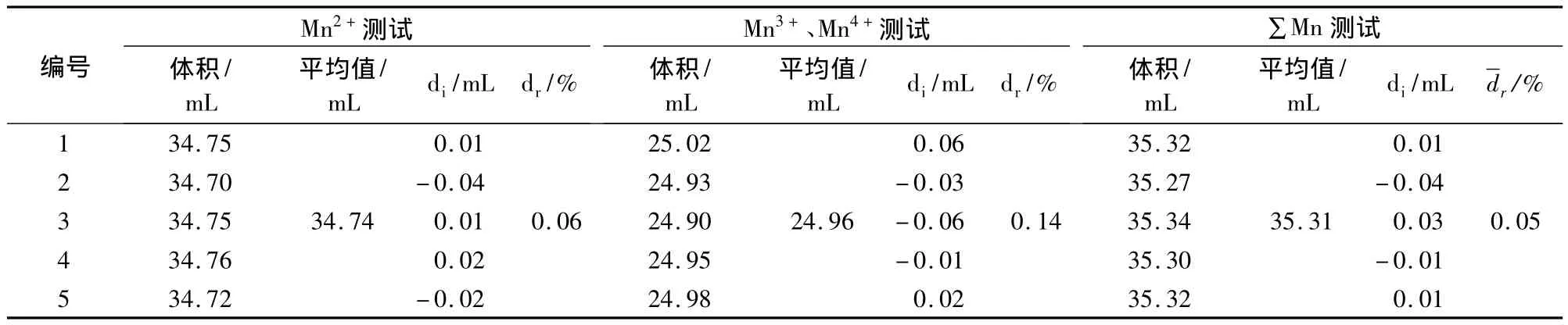
表3 MnO的测试结果
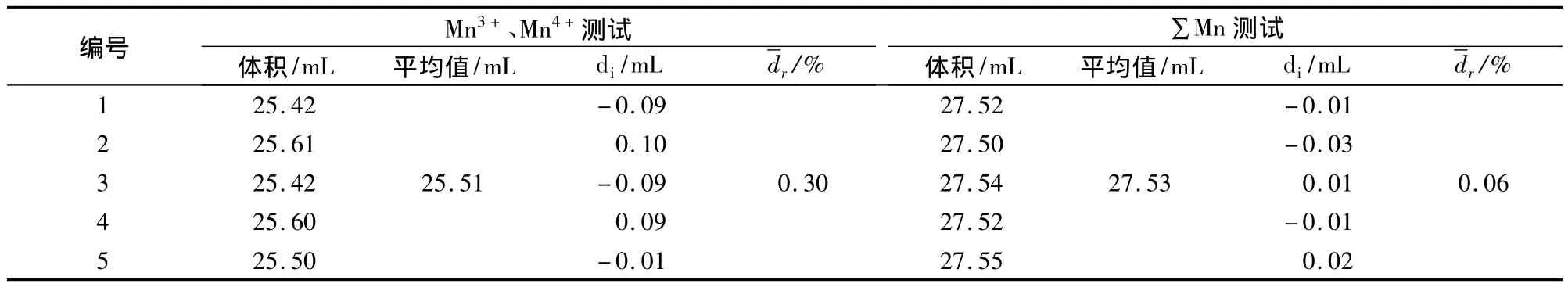
表4 MnO2的测试结果
表4结果表明:样品中没有Mn2+。通过三元一次方程组计算发现,样品中只含有Mn4+。同时,研究发现,∑Mn测试得到的总锰含量与Mn3+和Mn4+测试得到的总锰含量在误差范围内一致,误差为0.42%。由于样品中不含 Mn3+,则∑Mn测试与Mn4+测试的结果一致,充分说明此试验方法具有良好的准确性与稳定性。
表5结果表明:通过三元一次方程组计算得到,样品中的锰离子以三价的形式存在。同时,研究发现,∑Mn测试得到的总锰含量与Mn3+测试(没有Mn4+)得到的总锰含量相近,误差为1.08%,说明此测试方法对Mn2O3的价态测试具有良好的适应性。
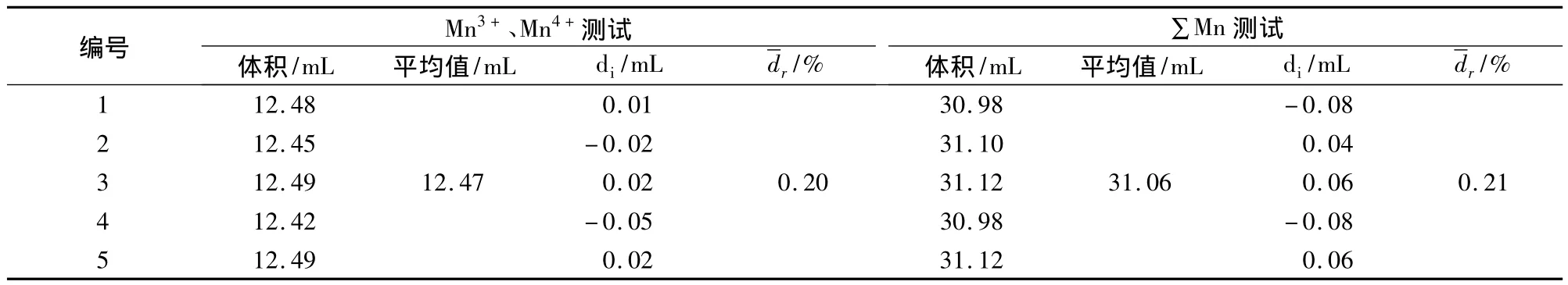
表5 Mn2O3的测试结果
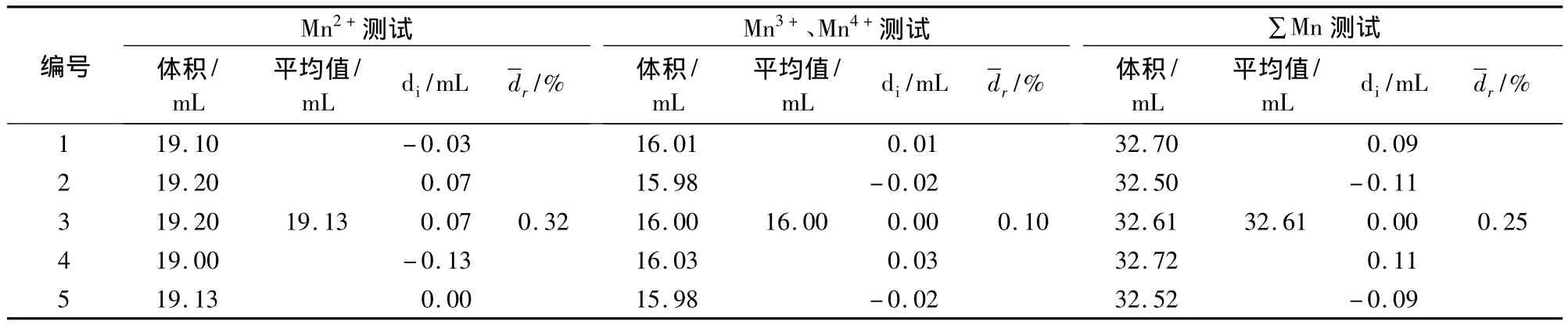
表6 Mn3O4的测试结果
表6结果表明:样品中含有Mn2+、Mn3+、Mn4+。通过三元一次方程组计算,可以得到样品中Mn2+、Mn3+、Mn4+的含量。根据 Mn2+、Mn3+、Mn4+的含量可以计算出样品中总锰含量。结果与∑Mn测试得到的总锰含量非常接近,误差为0.53%。
从表3~6发现数据重复性高,相对平均偏差小,具有很好的精确度和可信度。综合以上对纯的锰氧化物的测试结果,可以确定本试验方法对MnOx样品中锰含量测定具有很好的精确性。
根据不同样品中Mn2+、Mn3+和Mn4+的分布结果,可以得到不同氧化态的MnOx平均价态,结果如表7所示。
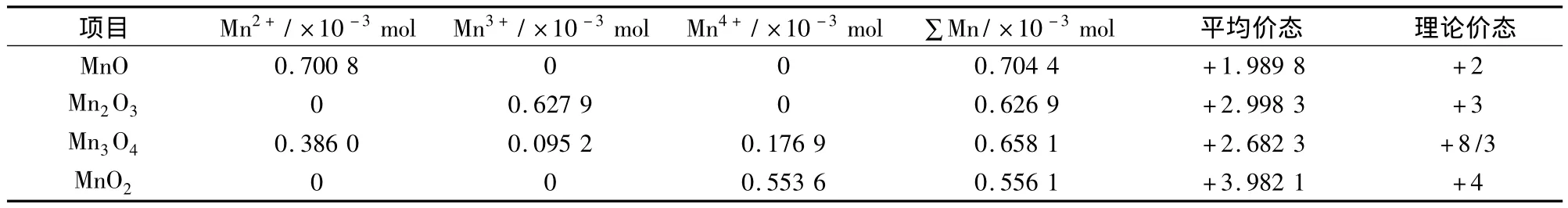
表7 纯MnOx价态分布的测试结果
表7结果表明:试验得到的各种氧化物的平均价态与理论价态结果一致。由此可见,本试验方法对MnOx样品中锰含量的测定具有良好的精确性以及准确性,方案是切实可行。
4 结语
试验结果表明:采用选择性溶解和计算法相结合的方法对MnOx样品中锰的含量及其平均价态的测量是可行的,具有较高的精确度。此方法方便快速,可以比较有效地解决MnOx测试方法不统一的问题及其应用的局限性。同时,精确地分析MnOx中锰的含量及其平均价态,可以对电池材料和催化材料性能的改善提供帮助。
[1]吕正中,黄可龙,刘素琴,等.差示光度法测定MnO2中的锰量[J].中国锰业,2008,18(3):39-40.
[2]Furman N H.Standard Methods of Chemical Analysis 6th[M].New York:D Van Nostrand Co Inc,1962:77 -79.
[3]吴辛友.二氧化锰中Mn2+、Mn3+、Mn4+测定方法的研究及应用[J].理化检验:化学分册,1997,35(5):204-209.
[4]熊奇,黄可龙,刘素琴,等.尖晶石型四氧化三锰中 Mn2+、Mn3+、Mn4+的测定方法和离子分布的研究[J].分析试验室,2000,19(5):68 -70.

