血管紧张素Ⅱ-1型受体拮抗剂在脑出血大鼠治疗中的作用
孙英晶,宁显忠
(辽宁医学院 附属第三医院 神经内科,辽宁 锦州 121000)
基础医学
血管紧张素Ⅱ-1型受体拮抗剂在脑出血大鼠治疗中的作用
孙英晶,宁显忠
(辽宁医学院 附属第三医院 神经内科,辽宁 锦州 121000)
目的探讨血管紧张素Ⅱ-1型受体(AT1R)拮抗剂在大鼠脑出血治疗中的神经保护作用及机制。方法以胶原酶诱导法建立大鼠脑出血模型48只,随机选取24只应用AT1R拮抗剂奥米沙坦干预治疗为治疗组,24只为未治组。分别在造模成功后的24 h、48 h及72 h处死大鼠,取脑组织。用HE染色观察脑组织病理学变化;用免疫组化及RT-PCR检测两组大鼠各时间点脑组织中血管紧张素Ⅱ(AngⅡ)、AT1R和白细胞抗原CD40配体(CD40L)的表达,并分别采用平均光密度及灰度比值对各指标表达做定量比较。用RT-PCR检测并比较两组大鼠在各时间点脑组织RNA浓度。结果治疗组脑内AngⅡ、AT1R和CD40L在各时间点蛋白和基因表达及RNA浓度值均较未治组低,脑水肿减轻,差异有显著性意义(P<0.05)。结论AT1R拮抗剂可使脑出血大鼠的炎症因子含量减低,对神经有保护作用。
脑出血;AT1R拮抗剂;免疫组化法;RT-PCR法
脑出血(intracerebral hemorrhage,ICH)是神经内科常见急症,是脑实质内血管的自发性、急性破裂出血,占国内脑卒中的17.1%~55.4%[1],由于目前治疗缺乏特异有效的手段,仅限于降颅压、神经营养药物或手术清除血肿,1个月内病死率超过40%,大多数幸存者常遗留严重的神经功能缺损[2]。为减少病死率及致残率,人们对脑出血后脑组织损伤的机制进行了研究。研究证实血肿周围产生了炎性反应[3-6],其中包括炎性细胞的局部浸润、炎性细胞因子的参与、补体的激活等,细胞因子包括白细胞介素类、肿瘤坏死因子等。白细胞分化抗原40(cluste of differentiation 40,CD40)属于TNF-α受体超家族成员,和CD40L结合后,能导致TNF-α等细胞因子和其它神经元毒素的产生,同时AngⅡ有促炎作用,并称其为促炎因子[7]。AT1R拮抗剂减轻前炎症反应因子及醛固酮的释放,且不减轻抗炎症反应因子糖皮质激素的释放已有报道[8-10]。本研究以胶原酶诱导法制备大鼠脑出血模型,应用HE染色法观察脑出血未治疗及应用AT1R拮抗剂奥米沙坦治疗后脑组织病理变化,用免疫组化法及RT-PCR法检测未治疗及治疗组不同时期脑组织AngⅡ、 AT1R、CD40L 等炎症因子的含量和RNA浓度值变化,探讨AT1R拮抗剂对脑出血大鼠的神经保护作用及机制。
1 材料和方法
1.1 研究对象及分组
辽宁医学院实验动物中心提供的健康成年雄性Sprague-Daw ley(SD)大鼠,体重250~350 g,采用Ⅳ型胶原酶诱导法制作脑出血模型,其方法参照文献[11]:术前12 h禁食,4 h禁水,用10%水合氯醛腹腔麻醉,俯卧固定于立体定位仪,常规消毒,取双耳间线与双眼间线之间正中长约1 cm做纵切口,暴露前囟和冠状缝,于前囟前1 mm中线右旁开3 mm处钻一直径约1.5 mm的圆孔,深达硬脑膜表面,用10 μL微量注射器抽取Ⅳ型胶原酶2 μL(按0.2 U/μL配制)并将其固定于定位仪,沿钻孔垂直进针至硬膜下5.5 mm处,缓慢将Ⅳ型胶原酶推注入脑,停针2 min后退针至硬膜下3 mm处,再次停针2 min后完全退出颅外,医用骨蜡封闭颅骨钻孔,缝合皮肤,麻醉清醒后送至动物房饲养。
取造模成功的48只随机分为2组,治疗组和未治组。分别在脑出血后24 h、48 h、72 h处死大鼠,每组每个时间点处死8只。每个时间点再分别取4只大鼠出血侧脑组织用于HE染色及免疫组化检测AngⅡ、 AT1R 、CD40L的蛋白表达,4只大鼠用于RT—PCR检测AngⅡ、 AT1R 和CD40L的基因表达及RNA浓度值测定。
1.2 方法
给药方法:脑出血治疗组造模后2 h予奥美沙坦按28 mg/Kg体重溶于2 mL生理盐水灌胃给药,给药后第1个24 h及第2个24 h分别再给未处死的大鼠同样的药物灌胃;脑出血未治疗组在造模后2 h给予和治疗组灌胃药液等体积的生理盐水,灌胃后第1个24 h及第2个24 h分别再给未处死的大鼠同样的生理盐水灌胃。
HE染色方法:(1)切片常规脱蜡、水化,自来水冲洗2~3 min;苏木素染色3 min,自来水冲洗1 min;(2)1%盐酸酒精分化20 s,自来水冲洗1 min;伊红染色3 min,自来水冲洗1 min;伊红染色3 min,自来水冲洗1 min;(3)经梯度酒精脱水(70%~80%、90%~95%、100%)各3 min;二甲苯Ⅰ、Ⅱ透明各5 min;中性树胶封片;(4)普通光镜下观察组织病理学变化:光镜下可见细胞核为蓝色,胞浆为红色。
检测方法:采用二氨基联苯胺(Diaminobenzidine,DAB)法行免疫组化染色,光镜观察,并应用图片分析软件Image—Pro Plus 6.0 进行光密度分析,用平均光密度值表示所测AngⅡ、 AT1R 及CD40L蛋白的表达情况,光密度值与蛋白含量成正比。用引物设计软件Primer 5进行RT-PCR法检测RNA的浓度值,用灰度比值表示所测AngⅡ、 AT1R 及CD40L的基因表达情况,灰度值与基因表达量增长趋势相反。
1.3 统计学方法
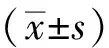
2 结 果
2.1 脑组织形态结构变化
光镜下,脑出血未治疗组在尾状核大片坏死区内有明显的炎性细胞浸润,神经细胞轻中度水肿,72 h病变达高峰;脑出血治疗组在各时间点尾状核坏死区域相对缩小,神经细胞轻度水肿。见图1~3。
2.2 免疫组化结果
脑出血后,大鼠脑组织中AngⅡ、CD40L及AT1R的平均光密度值从24 h开始升高,72 h平均光密度值最高,即各炎症因子的蛋白表达量在24 h最低,72 h最高。治疗组各时间点AngⅡ、AT1R、CD40L的平均光密度值均较未治疗组低,且与未治组比较相同炎症因子在各时间点平均光密度值差异均有显著性意义,P均<0.05,见表1。
2.3 RT-PCR法检测结果
脑出血后,大鼠脑组织中AngⅡ、CD40L、AT1R在24 h灰度比值最高,之后数值渐下降,72 h最低,即各炎症因子的基因表达量在24 h最低,72 h最高。治疗组各时间点AngⅡ、 AT1R 、CD40L的灰度比值均较未治疗组低,且与未治组比较相同炎症因子在各时间点灰度比值差异均有显著性意义,P均<0.05,见表2。
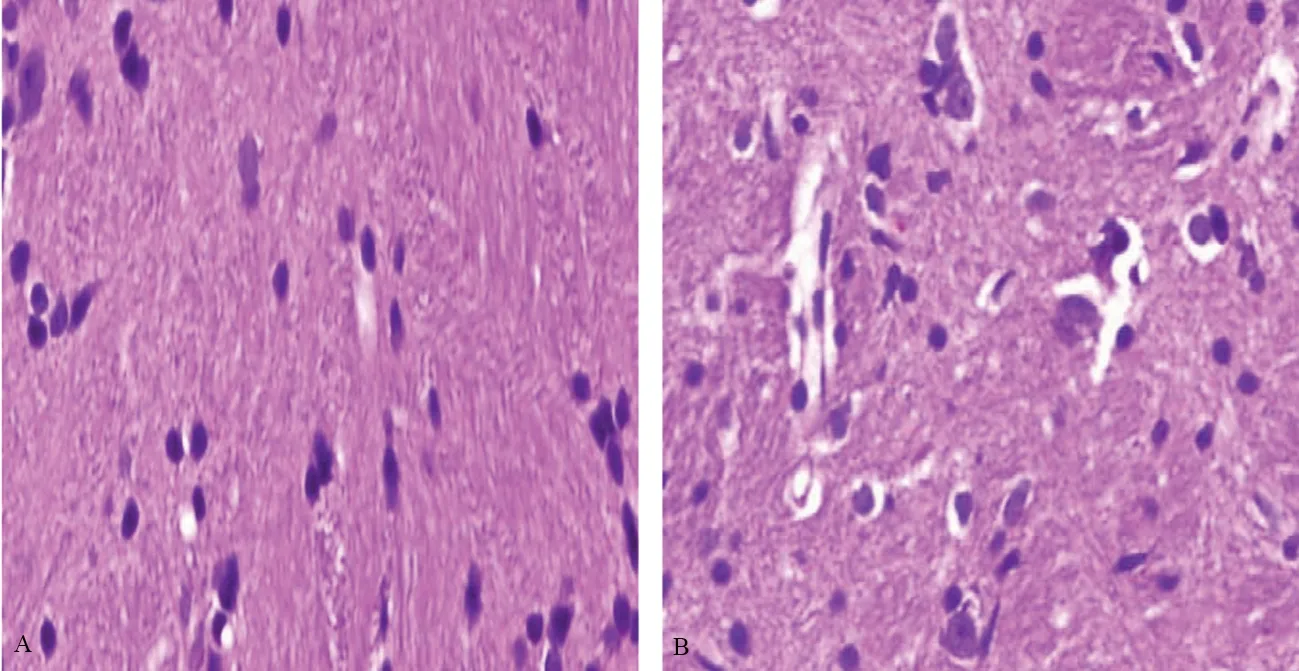
图1 2组大鼠24 h病灶侧HE染色(×400)
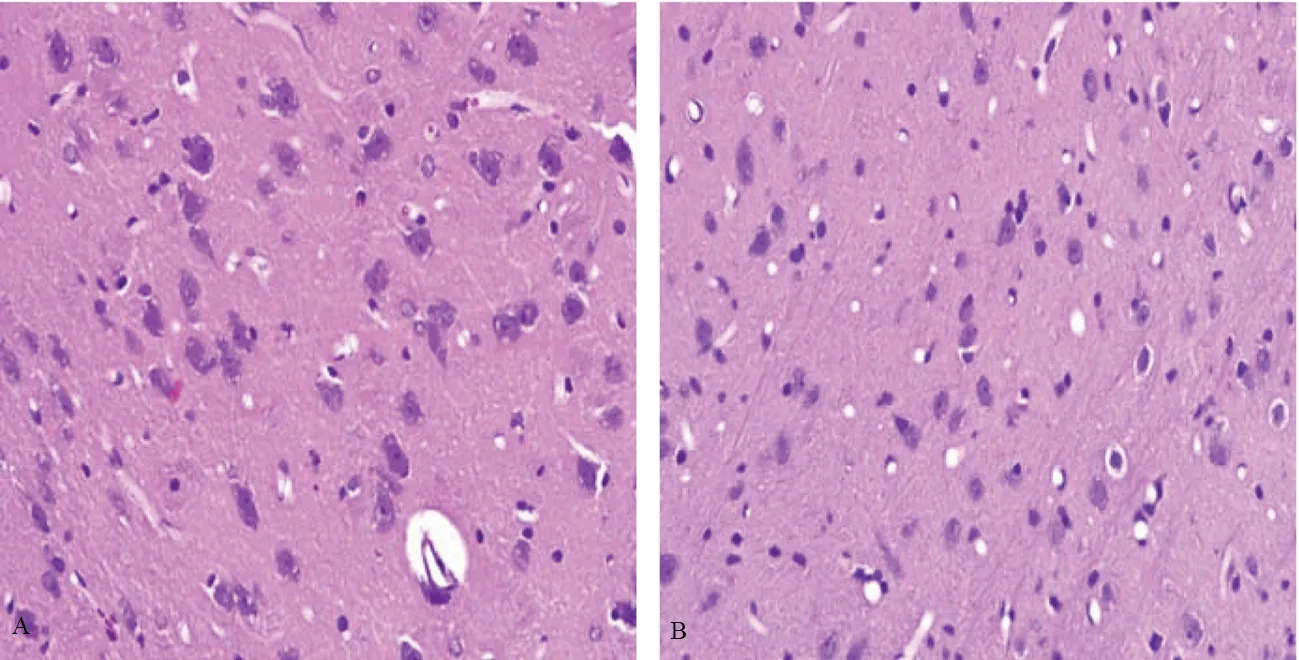
图2 2组大鼠48 h脑组织HE染色(×400)
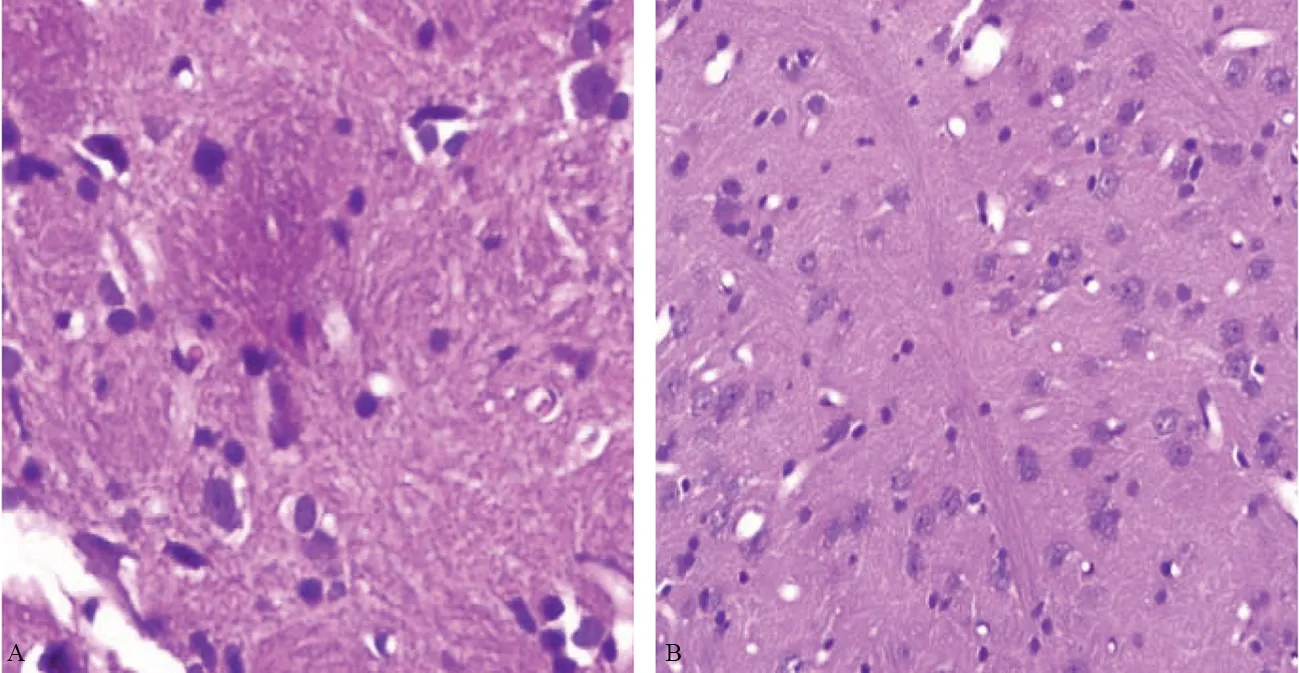
图3 2组大鼠72 h脑组织HE染色(×400)
表1 AngⅡ,AT1R和CD40L在2组大鼠各时间点的平均光密度值
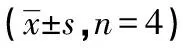

24h治疗组未治组48h治疗组未治组72h治疗组未治组AngⅡ0.040±0.0021)0.055±0.0010.047±0.0041)0.067±0.0030.065±0.0021)0.092±0.011AT1R0.033±0.0051)0.058±0.0040.052±0.0021)0.063±0.0010.073±0.0121)0.099±0.004CD40L0.145±0.0051)0.158±0.0060.161±0.0021)0.170±0.0020.172±0.0031)0.208±0.004
1)与未治组比较,P<0.05
表2 AngⅡ,AT1R和CD40L在2组大鼠各时间点的灰度比值
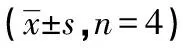

24h治疗组未治组48h治疗组未治组72h治疗组未治组AngⅡ0.787±0.0111)0.886±0.0500.679±0.0041)0.797±0.0030.610±0.0081)0.719±0.004AT1R0.856±0.0211)1.083±0.0280.699±0.0361)0.865±0.0180.630±0.0161)0.766±0.047CD40L1.050±0.0251)1.152±0.0240.893±0.0241)1.096±0.0160.807±0.0331)0.962±0.035
1)与未治组比较,P<0.05
2.4 RNA浓度值测定结果
与未治组比较,治疗组所测RNA浓度在24 h最低,之后渐升高,72 h浓度值最高, 2组间比较差异有显著性意义,P<0.05。见表3。
表3 RNA浓度在2组间的比较
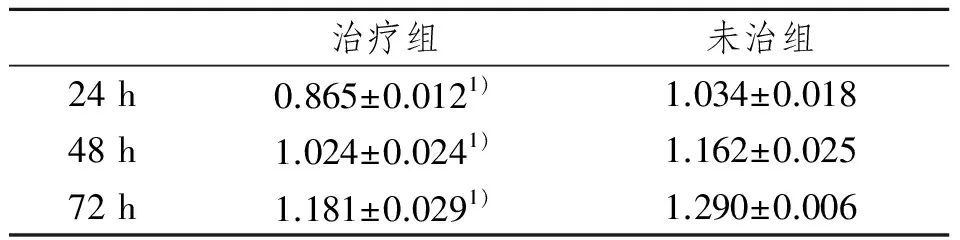
治疗组未治组24h0.865±0.0121)1.034±0.01848h1.024±0.0241)1.162±0.02572h1.181±0.0291)1.290±0.006
1) 与未治组比较,P<0.05
3 讨 论
脑出血是一种发病率很高的急性脑血管病,与同等体积的脑梗死相比,其死亡率和致残率均较高。大量实验证实,脑出血后存在炎症反应,且较非出血性脑损伤更为明显[12-13]。脑出血后细胞因子的主要来源是被激活的小胶质细胞[14]。小胶质细胞等被激活后产生并释放TNF-α,CD40是TNF-α受体超家族成员,在脑内,主要表达于小胶质细胞[15]和神经元及神经元样细胞[16],近来的流行病学资料显示CD40L是可能和脑卒中相关的炎症标志物之一[17]。近来研究证实,在脑内控制中枢和外周的交感肾上腺髓质系统、调节水和钠盐的摄入及脑血流变化[18]的AngⅡ有促炎作用,能促进经肿瘤坏死因子受体相关因子(tumor necrosis factor receptor related factors,TRAF)→2途径的CD40L的炎症反应过程,使脑损伤加重。研究表明:用AT1R阻滞剂能抑制脑出血局部的白细胞浸润、胶质细胞的激活和环氧化酶-2(COX2)表达,从而间接证实了AngⅡ与脑出血后的炎症反应有关[19]。
本实验研究结果显示在脑出血后24 h血肿周围脑组织出现小胶质细胞聚集及白细胞浸润,72 h炎症反应达高峰,且脑组织中AngⅡ、AT1R 及CD40L等炎症因子的蛋白及基因表达也呈同样的变化趋势,都与脑水肿变化趋势相同,表明脑出血后脑组织存在炎症反应,AngⅡ、AT1R 及CD40L均参与此反应过程,且炎症反应和脑水肿形成关系密切;与未治疗组比较,脑组织病变减轻,同时炎症反应也减轻,炎症因子含量下调。在脑缺血实验中研究提示应用小剂量AT1R拮抗剂可以通过与AT1R结合减轻炎症反应等途径,产生脑保护作用,而对血压无影响[20]。也就是说在脑出血中应用AT1R拮抗剂也可减轻脑组织病变,对神经功能有保护作用。
希望这个实验结果能广泛应用于临床,使同时接受其他综合治疗的脑出血患者的神经功能损伤进一步减轻,以提高生活质量,减轻社会负担。
[1] Jiang B,Wang WZ,Chen H,et al.Incidence and trends of stroke and its subtypes in China.Results from three large cities[J].Stroke,2006,37(1):63-68.
[2] Mendelow AD,Gregson BA,Fernandes HM,et al.Early surgury versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage(STICH):a randomised trial[J].Lancet,2005,365(9457):387-397.
[3] Gong C,Hoff JT,Keep RF.Acute inflammatory reaction following experimental intracerebral hemorrhage in rat[J].Brain Res,2000,871(1):57-65.
[4] Xue M,Del Bigio MR.Acute tissue damage after injections of thrombin and plasmin into rat striatum[J].Stroke,2001,32(9):2164-2169.
[5] Xi G,Hua Y,Keep RF,et al.Brain edema after intracerebral hemorrhage:the effects of systemic eomplement depletion[J].Acta Neurochir Suppl,2002,8(1):253-256.
[6] Peeling J,Yan HJ,Corbett D,et al.Effect of FK-506 on inflammation and behavioral outcome following intracerebral hemorrhage in rat[J].Exp Neurol,2001,167(2):341-347.
[7] 唐元升.高血压与冠心病[M]//于厚志,刘继东,唐元升. 冠心病危险因素. 北京:人民卫生出版社,2007:57-87.
[8] Jung KH,Chu K,Lee ST,et al.Blockade of AT1 receptor reduces apoptosis,inflammation and oxidative stress in normotensive rats with intracerebral hemorrhage[J].J Pharmacol Exp Ther, 2007,322(3):1051-1058.
[9] Sánchez-Lemus E, Benicky J, Pavel J,et al.Angiotensin ⅡAT1 blockade reduces the lipopolysaccharide-induced innate immune response in rats pleen[J]. Am J Physiol Regul Integr Comp Physiol,2009,296(5):R1376-R1384.
[10] Sánchez-Lemus E, Benicky J, Pavel J,et al.In vivo Angiotensin ⅡAT1 receptor blockade selectively inhibits LPS-induced innate immune response and ACTH release in rat pituitary gland[J].Brain Behav Immun,2009,23(7):945-957.
[11] Rosenberg GA, Mun-Bryce S, Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801-807.
[12] Xue M,Del Bigio MR. Intracortical hemorrhage injury in rats:relationship between blood fractions and brain cell death[J].Stroke,2000,31(7):1721-1727.
[13] Xue M,Del Bigio MR.Intracerebral injection of autologous whole blood in rats:time course of inflammation and cell death[J].Neurosci Lett,2000,283(3):230-232.
[14] Emsley HC,Tyrrell PJ.Inflammation and infection in clinical stroke[J].J Cereb Blood Flow Metab,2002,22(12):1399-1419.
[15] Benveniste EN,Nguyen VT,Wesemann DR.Molecular regulation of CD40 gene expression in macrophages and microglia[J].Brain Behav Immun,2004,18(1):7-12.
[16] Tan J,Town T,Mori T,et al.CD40 is expressed and function on neuronal cells[J].EMBO J,2002,21(4):643-652.
[17] 凌锋. 卒中与炎症[M]//凌锋. 脑血管病理论与实践. 北京:人民卫生出版社,2007,9:39-43.
[18] Saavedra JM.Brain angiotensin Ⅱ:new developments,unanswered questions and therapeutic opportunities[J].Cell Mol Neurobiol,2005,25(3/4):485-512.
[19] Ishikawa M,Vowinkel T,Stokes KY,et al.CD40/CD40 Ligand signaling in mouse cerebral microvasculature after focal ischemia reperfusion[J].Circulation,2005,111(13):1690-1696.
[20] Zhou J, Ando H, Macova M, et al.Angiotensin ⅡAT1receptor blockade abolishes brain mierovascular inflammation and heat shock protein responses in hypertensive rats[J].J Cereb Blood Flow Metab,2005,25(7):878-886.
RoleofAT1Rantagonistsinthetreatmentofcerebralhemorrhageinrats
SUNYing-jing,NINGXian-zhong
(DepartmentofNeurology,theThirdAffiliatedHospitalofLiaoningMedicalUniversity,Jinzhou121000,China)
ObjectiveDiscuss the nerve protective effect and mechanism of AT1R blocker in the treatment of cerebral hemorrhage in rats.MethodsThe ICH model induced via stereotaxic administration of collagenase type Ⅳ were 48,randomly divided into two groups, 24 of them were OLM(one kind of AT1R blocker)-treated ICH groups(referred to as treated groups hereinafter), 24 of them were untreated ICH groups, at twenty-four hours, forty-eight hours and seventy-two hours after ICH model were induced, the pathological changes of brain tissue were observed with microscope after HE staining,the related indicators such as AngⅡ, AT1R and CD40L of brain tissue were tested by IHC method and RT-PCR method,and were expressed by the average optical density and the gray level ratio index, the RNA levels of brain tissue were measured by RT-PCR method,and were compared with each other at the same time.ResultsCompared with the untreated groups,the levels of AngⅡ, AT1R and CD40L were decreased,brain edema relieved, and each index numeric comparisons had statistical significance(P<0.05) in the treated groups.ConclusionThe levels of related inflammatory factors decreased after AT1R blocker combining with AT1R in the brain tissue of rats with intracerebral hemorrhage, so as to inflammatory reaction reduced and nerve protective effects were played.
cerebral hemorrhage; AT1R antagonists; immunohistochemical method; RT-PCR method
10.11724/jdmu.2013.03.07
R743.34
A
1671-7295(2013)03-0239-05
孙英晶,宁显忠.血管紧张素Ⅱ-1型受体拮抗剂在脑出血大鼠治疗中的作用[J].大连医科大学学报,2013,35(3):239-243.
孙英晶(1975-),女,辽宁大连人,副主任医师。
宁显忠,主任医师。E-mail:ningxianzhong713@163.com
2013-03-25;
2013-05-08)

