十字花科植物FAE1基因的克隆与功能验证
庞 慧,李 莹,李密密,严琴琴,杭悦宇,孙小芹
〔江苏省·中国科学院植物研究所(南京中山植物园)江苏省植物迁地保护重点实验室,江苏南京210014〕
FAE1基因是第1个被发现的调控芥酸等超长链脂肪酸合成的关键基因[1],该基因主要通过编码β-酮酯酰 CoA 合酶(KCS)控制芥酸合成[1-2],同时也在蜡质及鞘脂类等超长链脂肪酸的合成中起重要作用[3]。FAE1基因最初克隆自拟南芥〔Arabidopsis thaliana(Linn.)Hey.〕[4],其后主要克隆自十字花科(Brassicaceae)植物,如从甘蓝型油菜(Brassica napus Linn.)、白菜型油菜(B.campestris Linn.)、芥菜型油菜(B.juncea Linn.)、黑芥(B.nigra Linn.)、白芥(Sinapis alba Linn.)和中欧芥〔Teesdalia nudicaulis(Linn.)R.Br.〕等种类中均获得 FAE1 基因[5-10]。虽然不同种类的FAE1基因在长度与序列上存在差异,但均无内含子。目前,FAE1基因的克隆方法主要有转座子标签法、探针法及EcoTILLING法(ecotype targeting induced local lesions in genomes)等[4,7,11],其中最常见的方法为同源序列扩增法[8,10]。
FAE1基因的功能验证主要包括酵母与植物转基因验证,这些研究大多也在十字花科植物中进行。酵母中脂肪酸延长酶活性很低,只能合成微量的超长链脂肪酸,是研究 FAE1编码蛋白活性的常用体系[12-13]。Millar等[14]将拟南芥的 FAE1 基因转化到酵母中,发现随着FAE1基因的表达长链脂肪酸在酵母中累积;而将诸葛菜〔Orychophragmus violaceus(Linn.)O.E.Schulz〕和荠〔Capsella bursa-pastoris(Linn.)Medikus〕2种零芥酸种类的 FAE1基因转化到酵母中,虽然都能表达出预期的蛋白产物,但却无长链脂肪酸的累积[9,15];中欧芥及海甘蓝(Crambe abyssinica Hochst.ex R.E.Fr.)的栽培品种‘Prophet’的FAE1基因功能除了在酵母中得到验证,还被转化至拟南芥中,同样发现该基因能显著促进长链脂肪酸的累积[16-17]。此外,将拟南芥的FAE1基因转化到烟草(Nicotiana tabacum Linn.)中,随 FAE1基因的表达长链脂肪酸在烟草中累积;在拟南芥中过量表达FAE1基因,其长链脂肪酸含量也明显提高[14]。由此可见,虽然十字花科种类很多,但FAE1基因的克隆与功能验证研究主要集中于芸薹属(Brassica Linn.)植物及拟南芥,而在其他十字花科植物中FAE1基因的特性尚未见研究报道。
鉴于此,作者对十字花科8属9种1亚种的FAE1基因进行了克隆、比对及功能验证,以期对十字花科植物中FAE1基因存在的普遍性及功能的相似性进行探讨。
1 材料和方法
1.1 材料
供试的十字花科8属9种1亚种包括芸薹属的非洲芥菜(B.tournefortii Gouan,原产地印度)、埃塞俄比亚芥(B.carinata A.Braun,原产地加拿大)和短喙芥(B.elongata Ehrhart,原产地伊朗);芝麻菜属(Eruca Miller)的芝麻菜〔E.vesicaria subsp.sativa(Miller)Thellung,原产地波兰〕;萝卜属(Raphanus Linn.)的野萝卜(R.raphanistrum Linn.,原产地印度);两节荠属(Crambe Linn.)的 C.filiformis Jacq.(原产地加拿大);菥蓂属(Thlaspi Linn.)的菥蓂(T.arvense Linn.原产地波兰);臭荠属(Coronopus Zinn)的臭荠〔C.didymus(Linn.)Smith,原产地中国江苏〕;荠属(Capsella Medikus)的荠〔C.bursa-pastoris(Linn.)Medikus,原产地中国江苏〕;碎米荠属(Cardamine Linn.)的小花碎米荠(C.parviflora Linn.,原产地中国江苏)。其中,非洲芥菜、埃塞俄比亚芥和C.filiformis种子由加拿大植物种质资源库(Plant Gene Resources of Canada,PGRC)提供,短喙芥、芝麻菜、野萝卜和菥蓂种子由美国种质资源库(Germplasm Resources Information Network,GRIN)提供;臭荠、荠和小花碎米荠种子均采自南京中山植物园。种子萌发后栽培于本所种质圃,幼苗长出后采集新鲜幼嫩叶片备用。
1.2 方法
1.2.1 FAE1基因的克隆与序列分析 按改良的CTAB法[18]从叶片中提取基因组DNA。在引物TF/TR[16]两侧分别加上 KpnI与 BamHI酶切位点,合成TFK引物(序列为5'-CGGGGTACCGCAATGACGTCC GTTAAC-3')和 TRB 引物(序列为 5'-CGCGGATCC GGACCGACCGTTTTGGAC-3')。使用TFK和TRB引物对各种类的FAE1基因进行扩增。
用PE-9700型PCR仪(Perkin Elmer公司生产)进行PCR 反应。扩增体系总体积20 μL,包含2.0 μL 10×PCR buffer、0.2 mmol·L-1dNTPs、2.0 mmol·L-1Mg2+、0.2 μmol·L-1引物、0.4 U Taq DNA 聚合酶和20 ng模板DNA,以灭菌双蒸水补足至20 μL。PCR反应程序为:95℃预变性3 min;95℃变性30 s,53℃退火40 s,72℃ 延伸1 min,共35个循环;最后于72℃保温7 min,4℃保存。PCR产物用质量体积分数 0.8%的琼脂糖凝胶(含 0.5 μg·mL-11×EB)电泳约1 h,用WV-BP330凝胶扫描分析系统(江苏捷达科技发展有限公司生产)进行观察和拍照。按AxyPrep DNA凝胶回收试剂盒方法将扩增产物进行割胶纯化,按pMD19-T载体试剂盒方法将纯化产物连接到pMD19-T载体〔购自宝生物工程(大连)有限公司〕上,通过PCR筛选的阳性克隆交上海华大基因有限公司进行测序。
用Sequencher软件对测序峰图进行编辑和拼接,采用Clustal W软件进行序列比对分析,用MEGA5.1软件对DNA和蛋白质序列的同源性进行比较。
1.2.2 FAE1基因的酵母转化和表达分析 酵母转化及培养参照文献[12]进行。用BamHI/KpnI双酶切pMD19-T重组载体,将目的片段连接到酵母表达载体pYES2/NT C(Invitrogen出品)上,位于载体半乳糖诱导表达启动子的下游,通过表达产生N末端融合了(His)6Gly标签的融合蛋白;以空载体pYES2/NT C作为阴性对照,转化到酵母菌株InvSc1中,并在含质量体积分数2%葡萄糖但不含尿嘧啶的培养基上(SC-ura)进行暗培养并筛选。转化的酵母细胞接种到含质量体积分数2%葡萄糖的SC-ura液体培养基中,于28℃条件下振荡暗培养过夜;用含质量体积分数2%半乳糖的SC-ura液体培养基将其稀释到OD600=0.02,并继续振荡暗培养至 OD600=1.4;将酵母培养物分为等量的2份,分别用于Western blot分析及气相色谱分析。
1.2.3 Western blot分析 用酵母蛋白提取试剂盒(南京凯基公司,Cat No.KGP650)提取酵母细胞总蛋白,然后用HisBind resin纯化蛋白。参照文献[12]进行Western blot分析,采用10%SDS-PAGE凝胶电泳,蛋白质分子量标准为PageRuler Prestained Protein Ladder(Fermentas公司出品)。将分离的蛋白转移到硝酸纤维素膜上进行Western blot分析,然后用一抗HisG抗体和碱性磷酸酶标记的二抗羊抗兔IgG检测,最后显色。
1.2.4 气相色谱分析 酵母细胞的脂肪酸分析参照文献[12]进行。酵母细胞用超纯水洗涤2次;然后用质量体积分数10%KOH-体积分数95%甲醇的混合溶液于80℃皂化反应2 h,反应结束后置于冰上冷冻,再用正己烷洗涤以去除未皂化物;剩余水相用6 mol·L-1HCl酸化。用正己烷萃取游离脂肪酸,减压浓缩以去除多余溶剂;游离脂肪酸用含1%H2SO4的甲醇溶液2 mL于60℃条件下甲基化1 h;然后用正己烷萃取脂肪酸甲酯,减压去除溶剂,剩余物用于气相色谱分析,脂肪酸含量采用峰面积归一法计算。
2 结果和分析
2.1 FAE1基因的克隆和序列分析
用引物TFK/TRB对供试的9种1变种的FAE1基因进行扩增,均得到Rf值相等的单一条带,其中,芝麻菜、Crambe filiformis、野萝卜、菥蓂、非洲芥菜、埃塞俄比亚芥和短喙芥的FAE1序列长度均为1 521 bp,臭荠的FAE1序列长度为1 517 bp,荠和小花碎米荠的FAE1序列长度为1 518 bp。所有种类的FAE1基因序列已在GenBank上登录,非洲芥菜、埃塞俄比亚芥、短喙芥、芝麻菜、野萝卜、Crambe filiformis、菥蓂、臭荠、荠和小花碎米荠的登录号分别为JX898749、JX898750、JX898751、JX898752、JX898753、JX898754、JX898755、JX898756、JX898757 和 JX898758。
供试的9种1亚种的FAE1序列相似性较高,相似度达89%。比对分析结果表明:对位排列矩阵长度为1 521 bp,其中,保守位点1 051个,占序列总长度的69.1%;变异位点470个,占总长度的30.9%;简约信息位点232个,占总长度的15.3%。臭荠、荠和小花碎米荠的FAE1序列在第132位均缺失3个碱基,臭荠的FAE1序列在第515位缺失1个碱基。
基于拟南芥的FAE1序列(GenBank登录号NM_119617.2),将供试种类的FAE1基因序列翻译成氨基酸序列,获得的氨基酸序列长度存在差异,但绝大部分编码完整。芝麻菜、Crambe filiformis、野萝卜、菥蓂、非洲芥菜、埃塞俄比亚芥和短喙芥的FAE1基因编码506个氨基酸,荠与小花碎米荠的编码505个氨基酸;而臭荠由于在515 bp处缺失1个碱基,导致其FAE1基因编码的氨基酸序列提前终止,仅编码186个氨基酸。比对分析结果显示:供试9种1亚种的FAE1基因编码的氨基酸序列也高度相似,相似度达88.9%;各种类的氨基酸序列间存在151个变异位点,其中有6个位点与种子芥酸相对含量有关(表1)。
2.2 FAE1基因功能的验证
2.2.1 Western blot分析结果 将供试9种1亚种的FAE1基因所构建的表达载体转化至酵母中,经Western blot分析,发现它们的FAE1基因在酵母中均表达出预期的蛋白产物,且编码蛋白的分子量相似,相对分子质量均为60 000左右。其中臭荠的FAE1基因由于移码突变只编码包含186个氨基酸的蛋白质,但实际上转化至酵母中仍可表达出分子量正常的蛋白产物;而从含有pYES2/NT C空载体的酵母菌株(对照)中则未检测出目标蛋白(图1)。
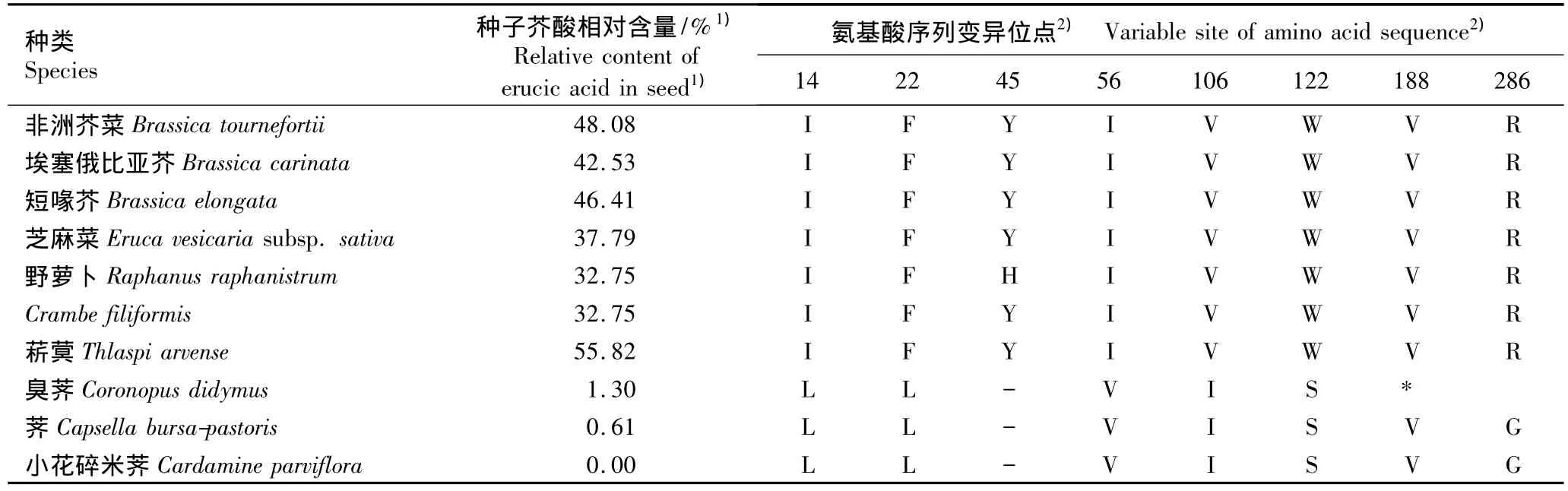
表1 十字花科植物FAE1基因编码的氨基酸序列变异位点与其种子芥酸相对含量的对应分析Table 1 Corresponding analysis of variable site of amino acid sequence encoded by FAE1 gene from Brassicaceae species to relative content of erucic acid in seed

图1 十字花科植物FAE1基因的转化酵母细胞中表达产物的Western blot分析结果Fig.1 Analysis result of Western blot of expression product in transformed yeast cell of FAE1 gene from Brassicaceae species
2.2.2 气相色谱分析结果 用气相色谱法分析各种类FAE1基因转化酵母中的芥酸含量,结果见表2。由表2可见:在作为对照的含pYES2/NT C空载体的酵母细胞中没有检测出芥酸,而在非洲芥菜、埃塞俄比亚芥、短喙芥、菥蓂、芝麻菜、野萝卜、C.filiformis和荠FAE1基因的转化酵母细胞中均有芥酸积累,其中在荠FAE1基因的转化酵母细胞中芥酸相对含量最高,达4.63%;而在臭荠和小花碎米荠FAE1基因的转化酵母细胞中芥酸相对含量均为0.00%。

表2 十字花科植物FAE1基因转化酵母细胞中芥酸相对含量的比较Table 2 Comparison of relative content of erucic acid in transformed yeast cell of FAE1 gene from Brassicaceae species
3 讨论和结论
3.1 FAE1基因编码的氨基酸序列与转化酵母细胞中芥酸含量的关系
前人对拟南芥及油菜突变体的研究结果[19]显示:在FAE1基因编码的氨基酸序列中有11个位点的任何一个发生突变,会导致高芥酸种类(通常种子中芥酸含量大于30%的为高芥酸种类,芥酸含量小于10%的为低芥酸种类[12])的FAE1基因转化酵母细胞中芥酸含量为0,这11个位点是6个半胱氨酸位点(Cys84、Cys223、Cys270、Cys312、Cys389 和 Cys460)、4个组氨酸位点(His302、His387、His391和 His420)及丝氨酸/苯丙氨酸位点(Ser/Phe282)。但武玉花等[9]的研究结果显示:这11个位点未发生任何变异,推测其他氨基酸位点的变异也与FAE1基因转化酵母的芥酸含量相关。本研究结果与武玉花等的结果基本一致,在本研究涉及的高、低芥酸种类中这11个位点也并未有任何变异,说明这11个位点的进化十分保守。而前人有关脂肪酸延长酶活性位点的研究是在遗传背景一致的材料间(如同种的不同品种间)进行的,因而在不同的物种间这些变异并不稳定。在本研究中,由FAE1编码的氨基酸序列的151个变异位点中有6个氨基酸变异位点与转化酵母的芥酸含量相关,如第14位氨基酸残基在转化酵母有芥酸积累的埃塞俄比亚芥等7种植物中为异亮氨酸,而在转化酵母无芥酸积累的臭荠和小花碎米荠中为亮氨酸,同样的情形还可见于第22位的苯丙氨酸/亮氨酸、第56位的异亮氨酸/缬氨酸、第106位的缬氨酸/异亮氨酸、第122位的色氨酸/丝氨酸、第286位的精氨酸/甘氨酸,因此,这6个氨基酸位点的变异可能是导致转化酵母无芥酸积累的原因之一,当然,这一结论还有待于采用定点突变实验加以验证。
从序列上看,由于移码突变,臭荠的FAE1基因只编码186个氨基酸,但在转化酵母中仍可表达出分子量正常的蛋白产物,这也许是由于基因本身的终止密码子比突变出现的终止密码子更有竞争优势,因而使基因仍可通读;但其转化酵母中的芥酸相对含量为0.00%,表明该编码蛋白并无酶活性,在酵母细胞中不能催化长链脂肪酸的合成。
3.2 FAE1基因转化酵母的芥酸含量与其种子芥酸含量的关系
前人的研究结果表明:十字花科植物的种子芥酸含量高,其FAE1基因转化至酵母中也使酵母细胞中的芥酸含量相应提高,反之亦然;如高芥酸植物油菜(Brassica napus Linn.)、甘蓝(B.oleracea Linn.)和芜青(B.rapa Linn.)的一些栽培品种,其FAE1基因转化酵母中芥酸含量可达1.94% ~2.19%;而低芥酸栽培植物B.napus‘Westar’的FAE1基因转化酵母中芥酸含量为0%[12-13];同样的情形也存在于高芥酸甘蓝型油菜‘中油821’、新疆白芥、新疆野芥(Sinapis arvensis Linn.)、菘蓝(Isatis indigotica Fort.)及低芥酸植物诸葛菜和荠中[9]。
本课题组前期对十字花科94种野生植物种子芥酸含量的分析结果表明[15]:非洲芥菜等6种1亚种的种子芥酸含量均高于30%,为高芥酸种类;臭荠与小花碎米荠种子芥酸含量为0.00% ~1.30%,为低芥酸种类。本研究结果显示:在非洲芥菜等6种1亚种FAE1基因的转化酵母细胞中芥酸相对含量为0.27%~2.50%,而在臭荠和小花碎米荠FAE1基因的转化酵母中芥酸相对含量为0.00%,证实了前期的研究结果;同时,除荠外的8种1亚种的种子芥酸相对含量与转化酵母细胞中的芥酸含量呈正相关(r=0.493),更明确了植物种子芥酸含量与该物种FAE1基因转化酵母细胞中芥酸含量的正相关关系。
3.3 荠的FAE1基因克隆与功能验证
前期的测定结果显示荠的种子中芥酸相对含量为0.61%,为低芥酸种类[15],其 FAE1基因转化酵母细胞中芥酸相对含量却远高于其他高芥酸种类,表明其编码的脂肪酸延长酶具有很高活性,这种特例之前未见报道。推测其原因可能是在荠体内受到各式元件调控而导致FAE1基因功能不正常,但在酵母表达系统中其基因编码区脱离了各式调控元件的作用,从而恢复正常功能;也可能是由于FAE1基因在植物体内可能受到包括甲基化在内的基因修饰和调节作用,关闭了该基因的活性,而在酵母中去甲基化后基因又重新活化表达[20]。在本实验过程中荠的FAE1基因扩增十分困难[9],作者也是尝试多次后才获得成功,这一现象也可能是该基因发生甲基化作用的佐证。
致谢:美国种质资源库与加拿大植物种质资源库馈赠部分种类的种子,中国农业科学院油料作物研究所卢长明研究员与武玉花助理研究员馈赠酵母菌株与质粒,江苏省农业科学院油料作物研究所高建芹副研究员完成脂肪酸的气相色谱分析,在此一并致谢!
[1]LESSIRE R,COSTAGLIOLI P,GARCIA C,et al.Acyl-CoA elongase:genomic studies[J].Plant Molecular Biology,2004,21(2):237-242.
[2]KUNST L,TAYLOR D C,UNDERHILL E W.Fatty acid elongation in developing seeds of Arabidopsis thaliana[J].Plant Physiology and Biochemistry,1992,30:425-434.
[3]JEROME J,RAFFAELE S,BOURDENX B,et al.The VLCFA elongase gene family in Arabidopsis thaliana:phylogenetic analysis,3D modelling and expression profiling[J].Plant Molecular Biology,2008,67:547-566.
[4]JAMES D W Jr,LIM E,KELLER J,et al.Directed tagging of the Arabidopsis fatty acid elongation 1(FAE1)gene with the maize transposon activator[J].The Plant Cell,1995,7(3):309-319.
[5]CLEMENS S,KUNST L.Isolation of a Brassica napus cDNA(accession no. AF009563)encoding β-ketoacyl-CoA synthase, a condensing enzyme involved in the biosynthesis of very long chain fatty acids in seeds(PGR97-125)[J].Plant Physiology,1997,115:313-314.
[6]FOURMANN M,BARRET P,RENARD M,et al.The two genes homologous to Arabidopsis FAE1 cosegregate with the two loci governing erucic acid content in Brassica napus[J].Theoretical and Applied Genetics,1998,96:852-858.
[7]BARRET P,DELOURME R,RENARD M,et al.A rapeseed FAE1 gene is linked to the E1 locus associated with variation in the content of erucic acid[J].Theoretical and Applied Genetics,1998,96:177-186.
[8]DAS S,ROSCOE T J,DELSENY M,et al.Cloning and molecular characterization of the fatty acid elongase 1 FAE1 gene from high and low erucic acid lines of Brassica campestris and Brassica oleracea[J].Plant Science,2002,162:245-250.
[9]武玉花,吴 刚,肖 玲,等.十字花科植物中低芥酸野生种的发掘和 FAE1基因的功能验证[J].中国农业科学,2009,42(11):3819-3827.
[10]ERIKSSON D,MERKER A.Cloning and functional characterization of genes involved in fatty acid biosynthesis in the novel oilseed crop Lepidium campestre L.[J].Plant Breeding,2011,130:407-409.
[11]WANG N,SHI L,TIAN F,et al.Assessment of FAE1 polymorphisms in three Brassica species using EcoTILLING and their association with differences in seed erucic acid contents[J].BMC Plant Biology,2010,10:137.
[12]KATAVIC V,MIETKIEWSKA E,BARTON D L,et al.Restoring enzyme activity in nonfunctional low erucic acid Brassica napus fatty acid elongase 1 by a single amino acid substitution[J].European Journal of Biochemistry,2002,269(22):5625-5631.
[13]KATAVIC V,BARTON D L,GIBLIN E M,et al.Gaining insight into the role of serine 282 in B.napus FAE1 condensing enzyme[J].FEBS Letters,2004,562(1/3):118-124.
[14]MILLAR A A,KUNST L.Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme[J].The Plant Journal,1997,12(1):121-131.
[15]孙小芹,庞 慧,郭建林,等.十字花科58属94种野生植物种子脂肪酸组分分析[J].林产化学与工业,2011,31(6):46-54.
[16]MIETKIEWSKA E,BROST J M,GIBLIN E M,et al.A Teesdalia nudicaulis FAE1 complements the FAE1 mutation in transgenic Arabidopsis thaliana plants and shows a preference for elongating oleic acid to eicosenoic acid[J].Plant Science,2007,173:198-205.
[17]MIETKIEWSKA E,BROST J M,GIBLIN E M,et al.Cloning and functional characterization of the fatty acid elongase 1(FAE1)gene from high erucic Crambe abyssinica cv. Prophet[J]. Plant Biotechnology Journal,2007,5(5):636-645.
[18]PATERSON A H,BRUBAKER C L,WENDEL J F.A rapid method for extraction of cotton(Gossypium spp.)genomic DNA suitable for RFLP or PCR analysis[J].Plant Molecular Biology Reporter,1993,11(2):122-127.
[19]GHANEVATI M,JAWORSKI J G.Active-site residues of a plant membrane-bound fatty acid elongase beta-ketoacyl-CoA synthase,FAE1 KCS[J].Biochimica et Biophysica Acta,2001,1530(1):77-85.
[20]VAN H H,INGELBRECHT I,VAN M M,et al.Post-transcriptional silencing of a neomycin phosphotransferaseⅡtransgene correlates with the accumulation of unproductive RNAs and with increased cytosine methylation of 3'flanking regions[J].The Plant Journal,1997,12(2):379-392.

