珊瑚菌石油醚部位化学成分的研究
窦晓兰,李 华,陆启玉
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 前言
葡萄状枝瑚菌(Ramaria botrytis)又名葡萄色顶枝瑚菌、珊瑚菌、扫帚菌,隶属于子囊菌亚门(Ascomycotina)、珊瑚菌科(Clavariaceae)、其形秀色美、营养丰富,属于可食大型真菌,富含多种对人体有益的碳水化合物、氨基酸和微量元素[1].另外,该菌具有良好的药用价值,据《中华本草》(1997)、《滇南本草》(1959)、《中国药用真菌图鉴》(1987)及《云南食用菌》(1984)记载该菌具有和胃理气、祛风、破血缓中等作用,同时对小白鼠肉瘤S-180和艾氏菌(Escherichia coli)的抑制率达到80%[2].该菌主要分布于我国吉林、辽宁、河南、云南、四川等地区,是一类重要的野生真菌资源.但是到目前为止,除了李华等[3]分析了珊瑚菌的化学成分外,有关该真菌所含的具体成分鲜有报道.因此,笔者以葡萄状枝瑚菌为试验材料,对其子实体的石油醚提取部位的化学成分进行了GC-MS分析,并进行了进一步的分离纯化和结构鉴定,阐明其主要成分,以促进该真菌的综合利用和深度开发.
1 材料与方法
1.1 试验材料
葡萄状枝瑚菌子实体干品购于云南哀牢山区,60℃烘干至恒重,粉碎至10目.95%乙醇、石油醚、乙酸乙酯、甲醇均为分析纯,所用水为蒸馏水.试验在室温下进行.
1.2 主要仪器
DSQ II 气质联用仪:Thermo Fisher Scientific公司;超导核磁共振仪:瑞士Bruke 400 MHz,内标为TMS;YRT-3熔点测试仪:天津市瑞来特仪器有限公司;旋转蒸发器:上海亚荣生化仪器厂;万能粉碎机:北京市永光明医疗仪器厂;电子恒温水浴锅:北京中兴伟业仪器有限公司;层析柱:郑州大学玻璃仪器厂;柱层析和薄层层析用硅胶均为青岛海洋化工厂.
1.3 试验方法
1.3.1 石油醚提取部位的制备
取30.0 g粉碎至40目的珊瑚菌干粉置于索氏抽提装置中,采用石油醚提取12 h,30℃旋转蒸发得淡黄色油状液体,具有氨味.
1.3.2 GC-MS分析
色谱:配备GsBP-5 ms毛细管柱,30 m×0.25 mm×0.25 m,程序升温,柱温 50 ℃,保持 3 min,以15℃/min至120℃,以3℃/min至250℃,以25℃/min至280℃,保持5 min,氦气作载气,进样口温度 260℃,分流比10∶1,柱流速1.0 mL/min.
质谱:EI(70 eV),接口温度 250 ℃,离子源温度220℃,扫描范围:40~500 aum.
1.3.3 单体化合物的提取、分离纯化
取10 kg葡萄状珊瑚菌,95%乙醇浸提4次,合并提取液,45℃减压浓缩至一定体积.等体积石油醚浸提3次,合并浓缩后得石油醚部位275.5 g.称取300 g硅胶石油醚湿法上柱,石油醚-乙酸乙酯 1∶0-25∶1-5∶1-1∶1-1∶3-0∶1 梯度洗脱,合并相同馏分.5:1洗脱部分利用硅胶柱层析进一步纯化,石油醚-乙酸乙酯梯度洗脱,最终得单体化合物S1和S2.

图1 珊瑚菌石油醚提取部位GC-MS总离子流图和部分放大图
2 结果与分析
2.1 石油醚提取部位成分分析
石油醚提取部位经充分挥发溶剂后计算得率为3.14%,采用GC-MS分析石油醚提取部位的总离子流色谱图,见图1.
由图1可以看出相对保留时间处于31.87、37.23、37.42、37.83、38.01 min 的 5 种物质含量较高,按峰面积归一化法计算5个成分占总成分的95%以上.经MS分析,通过HP MSD化学工作站检索NIST08.L标准质谱图库,得到以上5种物质最可能是棕榈酸、亚油酸、油酸、亚油酸乙酯、油酸乙酯.而这几种成分中,以亚油酸和油酸含量最高,油酸和人体必需脂肪酸亚油酸等不饱和脂肪酸是安全性高的抗癌药剂.另外,油酸可以用作药物吸收促进剂,对难吸收的抗菌物质、抗癌剂等药品有显著的促进吸收效果,可以用作稳定性和安全性高的医药基剂或辅助剂[4].由此可见,含低极性成分的珊瑚菌石油醚提取部位具有很好的医药和化工应用价值.
表1显示,珊瑚菌石油醚提取部位除了含有几种脂肪酸外,含苯环的低相对分子质量的化合物较多,MS谱库中给出的SI和RSI结果显示相似度不高,多数介于750~850之间,而符合度Prob值有的较低,可能是因为GC条件不同,导致化合物的裂解碎片不能很好与谱库中的质谱图进行匹配;另外,珊瑚菌石油醚提取部位的化学成分也可能是质谱库以外的物质.资料显示,该属内的含有大量的萜类和杂环类化合物[5-6],也会产生苯的特征峰,因此GC-MS分析只能大致反映组分的组成情况,若要完全确认所含化合物的种类,只能采用进一步的分离纯化,进行结构鉴定.但是相对而言,石油醚部位的化合物极性较小,数量多且性质相近,难以实现分离纯化,因此目前研究中药材石油醚提取部位的方法,尤其是分析挥发油成分,大多数还是采用GC-MS分析.
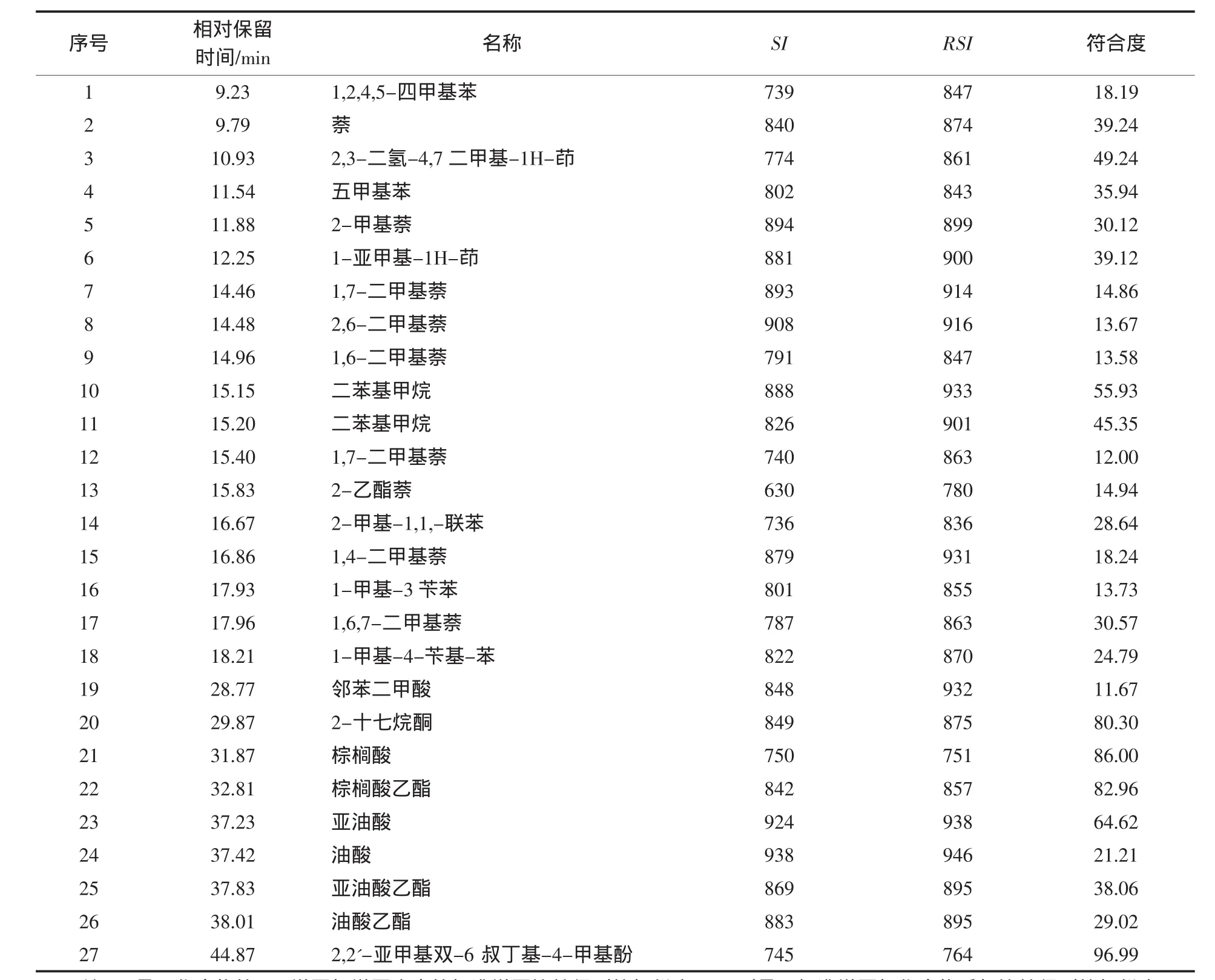
表1 珊瑚菌石油醚提取部位GC-MS分析结果
2.2 单体化合物结构鉴定
S1:无色针状结晶(甲醇-水),mp 148~150 ℃,与麦角甾醇标品混合,熔点不变.氯仿-甲醇(20∶1)展开,Rf值为0.7.10%硫酸乙醇溶液加热显色,斑点为墨绿色,Liebermann-burchard反应呈明显阳性.1H-NMR(400 MHz,CDCl3)δ:0.74~0.77(9H,m,18,26,27-CH3),0.81(3H,s,19-CH3),0.84(3H,d,J=6.8 Hz,28-CH3),0.93(3H,d,J=6.6 Hz,21-CH3),1.12~2.00(19H,m),2.02(1H,d,q,J=13.8,1.9 Hz,25-H),3.89(1H,m,3-H),5.07(1H,dd,J=16.8,7.2 Hz,23-H),5.15(1H,dd,J=16.8,7.2 Hz,22-H),6.19 (1H,d,J=8.5 Hz,6-H),5.50(1H,d,J=8.5 Hz,7-H).13C-NMR(100 MHz,CDCl3)数据如表2所示.综合以上数据与文献[7-9]报道的麦角甾醇一致,该化合物鉴定为麦角甾醇(erogosterol或(22E)-Ergosta-5,7,22-trien-3β -ol, 分 子 式 为C28H44O).
S2:无色针状或羽状结晶(甲醇-水),熔点173~175℃,与麦角甾醇过氧化物标品混合,熔点不下降.氯仿-甲醇展开,Rf值为0.3.10%硫酸乙醇溶液加热显色,斑点为墨绿色,Liebermannburchard反应呈明显阳性.1H-NMR(400 MHz,CDCl3)δ:0.56 (3H,s,18-CH3),0.76 (6H,t,J=6.4 Hz,26,27-CH3),0.84 (3H,d,J=6.8 Hz,28-CH3),0.88 (3H,s,19-CH3),0.96 (3H,d,J=6.6 Hz,21-CH3),1.10-2.05 (19H,m),2.21 (1H,m,20-H),2.39(1H,d,q,J=14.4,2.7 Hz,25-H),3.57(1H,m,3-H),5.11(1H,dd,J=15.4,7.0 Hz,23-H),5.15(1H,dd,J=15.4,7.0 Hz,22-H),5.31 (1H,dd,J=2.3,5.6 Hz,6-H),5.50 (1 H,dd,J=2.3,5.6 Hz,7-H).13C-NMR(100 MHz,CDCl3)数据如表 2 所示.综合以上数据与文献[7-9]报道的麦角甾醇过氧化物一致,该化合物鉴定为麦角甾醇过氧化物(ergosterol peroxide,5α,8α-peroside 或 5α,8αepidioxy-(22E,24R)-ergosta-6,22-dien-3β-ol,分子式为 C28H44O3).
麦角甾醇和麦角甾醇氧化物的化学结构式如图2所示.
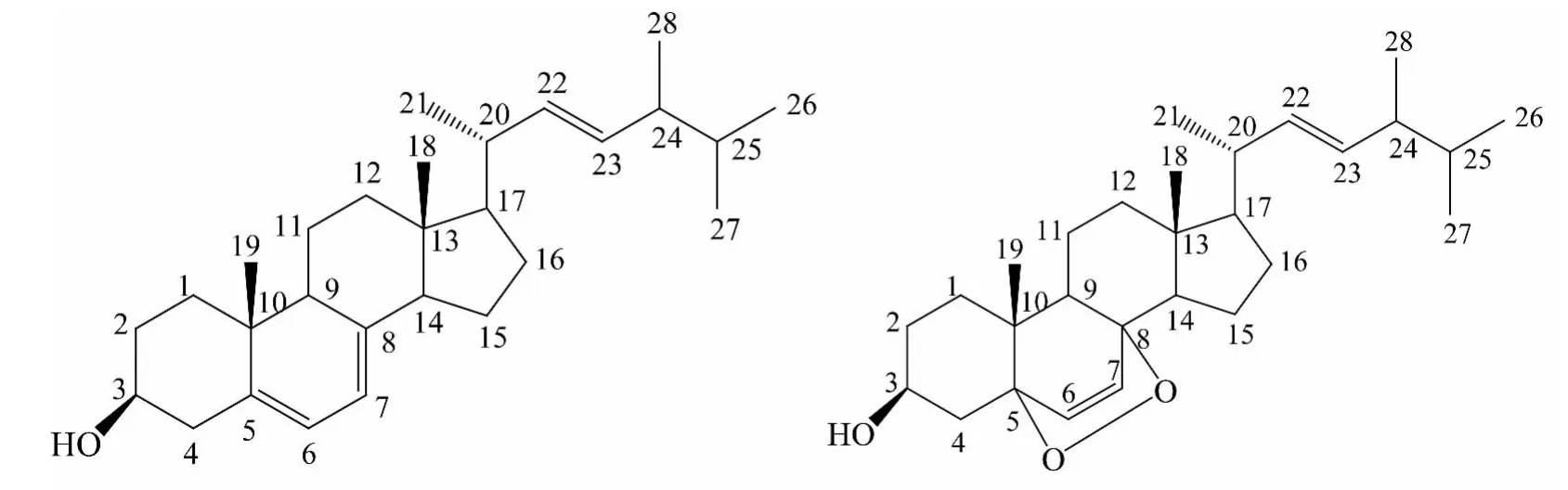
图2 麦角甾醇和麦角甾醇过氧化物的化学结构式

表2 麦角甾醇与麦角甾醇过氧化物的13C-NMR(100 MHz,CDCl3)数据
3 结论
珊瑚菌石油醚提取部位的化学组成经GC-MS分析表明,该组分中主要含有亚油酸、油酸、棕榈酸、亚油酸乙酯、油酸乙酯等物质,食用和药用价值较高.经溶剂提取、硅胶柱层析和重结晶等方法,在珊瑚菌乙醇提取后的石油醚萃取部位得到两个单体化合物,分别经核磁共振鉴定为麦角甾醇和麦角甾醇过氧化物,均属首次从该大型真菌中分离得到.通过对珊瑚菌石油醚部位化学成分的研究,可以为综合利用该真菌资源,进一步开发应用提供科学的理论依据.
[1] 陈文强,胥成浩.葡萄色顶枝瑚菌中矿质元素及氨基酸含量的测定[J].氨基酸和生物资源,2001,23(3):7-8.
[2] 卯晓岚.食用珊瑚菌[J].中国食用菌,1987(1):22-24.
[3] 李华,卫敏,陈俙妍,等.珊瑚菌总萜提取工艺研究[J].时珍国医国药,2012(3):35-36.
[4] 龚庆芳.亚稀褶黑菇等四种高等真菌的化学成分及其共生菌根信号分子研究[D].长沙:湖南师范大学,2008.
[5] 王琦,李志峰,陈刚,等.我国油酸的生产现状及展望[J].河北化工,2006,29(9):18-21.
[6] 郑永标.5种食药用大型真菌天然产物的研究[D].厦门:厦门大学,2008.
[7] Zheng Y B,Lu C H,Zheng Z H,et al.New sesqujterpenes from edible fungus Clavicorona pyxidata[J].Helv Chim Acta,2008,921(11):2174-2180.
[8] 麻兵继,伸进文,王佩佩,等.拟白蘑子实体化学成分研究[J].西北植物学报,2008,28(6):1255-1257.
[9] Nobuo K,Setsuko S,Motoyoshi S.Steroids from Calvatia cyathiformis[J].Phytochemistry,1994,37(1):213-215.
[10]麻兵继,文春南,吴婷婷,等.麦角甾醇过氧化物的抑菌活性研究[J].食品研究与开发,2012,33(7):42-44.

