复方归芍胶囊质量标准研究
★ 李养学 谭志灿 李素梅 江洁怡 程青云 彭丽诗 (.广东省中医研究所 广州50095;.广州中医药大学 广州50405)
复方归芍胶囊是广东省第二中医院医院制剂,由当归、白芍、黄芪、白术、柴胡、延胡索、阿胶、茯苓等药物组成,具有气血双补、调经止痛、健脾利湿的功效,在临床上用于治疗气血不足、脾不统血之月经不调、痛经等症。为了更好地控制其内在质量,保证临床疗效,本文采用薄层色谱法对方中当归、白芍、黄芪和柴胡进行了定性鉴别,采用高效液相色谱法对方中阿魏酸的含量进行了测定。
1 仪器与试药
1.1 仪器
Agilent 1200 高效液相色谱仪(美国);Camag Automatic TLC Sampler 4 全自动薄层点样仪(瑞士);Camag Reprostar 3 薄层成像系统(瑞士);KQ5200DE 型数控超声波清洗器(昆山);PBQ - II型薄层自动铺板器(重庆);DHG -9070A 电热恒温干燥箱(上海);Sartorius BP211D 分析天平(德国);HWS-26 电热恒温水浴锅(上海)。
1.2 试药
当归对照药材(批号:120927 -201014)、白芍对照药材(批号:120905 -200508)、黄芪对照药材(批号:120974 - 200508)、柴胡对照药材(批号:120992 -200504)、阿魏酸对照品(批号:110773 -200611)均购于中国药品生物制品检定所;复方归芍胶囊(批号:120801、120802、120803)由广东省第二中医院制剂室提供;乙腈为色谱纯,水为双蒸水;其余均为分析纯。
2 定性鉴别[1-4]
2.1 当归TLC 鉴别
取本品内容物5g,加1%碳酸氢钠溶液50mL,超声处理20 分钟,离心,取上清液,用稀盐酸调节pH 值至2 -3,用乙醚振摇提取2 次,每次20mL,合并乙醚液,挥干,残渣加甲醇1mL 使溶解,作为供试品溶液。另取当归对照药材2g,同法制成对照药材溶液。再取缺当归的阴性样品5g,同供试品溶液制备方法制成当归阴性对照溶液。照薄层色谱法(《中国药典》2010 年版一部附录VIB)试验,吸取上述三种溶液各10μL,分别点于同一硅胶G 薄层板上,以环己烷三氯甲烷-乙酸乙酯-甲酸(4∶1∶1∶0.1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰(见图1)。

图1 当归TLC 图
2.2 白芍TLC 鉴别
取本品内容物5g,加乙醇50mL,超声处理30分钟,滤过,滤液蒸干,残渣加水5mL,微热使溶解,放冷,通过D101 型大孔吸附树脂柱(内径为1.5cm,柱高为12cm),以水50mL 洗脱,弃去水液,再用20%乙醇50mL 洗脱,收集洗脱液,蒸干,残渣加乙醇lmL 使溶解,作为供试品溶液。另取白芍对照药材0.5g,加乙醇10mL,超声处理5 分钟,滤过,滤液蒸干,残渣加乙醇lmL 使溶解,作为对照药材溶液。再取缺白芍的阴性样品5g,同供试品溶液制备方法制成白芍阴性对照溶液。照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各10μL,分别点于同一硅胶G 薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰(见图2)。
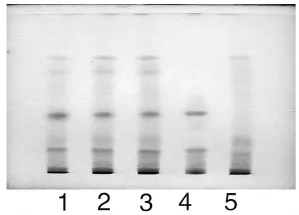
图2 白芍TLC 图
2.3 黄芪TLC 鉴别
取本品内容物10g,加水50mL,加热回流30 分钟,滤过,滤液用水饱和的正丁醇振摇提取2 次,每次40mL,合并正丁醇液,用氨试液充分洗涤2 次,每次40mL,弃去氨液,正丁醇液蒸干,残渣加甲醇1mL使溶解,作为供试品溶液。另取黄芪对照药材3g,同法制成对照药材溶液。再取缺黄芪的阴性样品10g,同供试品溶液制备方法制成黄芪阴性对照溶液。照薄层色谱法(附录ⅥB)试验,吸取上述3 种溶液各5μL,分别点于同一硅胶G 薄层板上,以三氯甲烷-甲醇-水(13:7:2)的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性对照无干扰(见图3)。
2.4 柴胡TLC 鉴别
取“2.3”项下供试品溶液作为供试品溶液。另取柴胡对照药材1g,同法制成对照药材溶液。再取缺柴胡的阴性样品10g,同供试品溶液制备方法制成柴胡阴性对照溶液。照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各5μL,分别点于同一硅胶G薄层板上,以正丁醇-乙酸乙酯-稀氨水(1→10)(4∶1∶5)的上层溶液为展开剂,展开,取出,晾干,喷以2%对二甲氨基苯甲醛的40%硫酸溶液,在60℃加热至斑点显色清晰,分别置日光和置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰(见图4)。
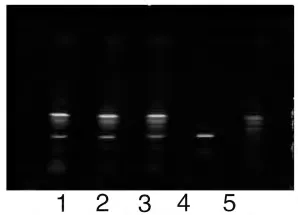
图3 黄芪TLC 图;
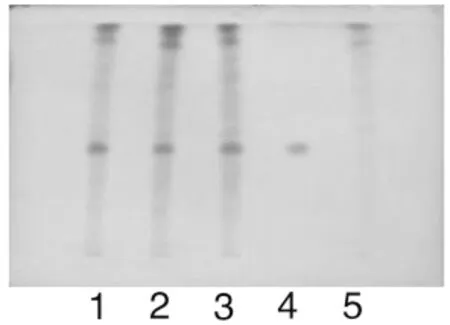
图4 柴胡TLC 图
3 阿魏酸含量测定[1,5]
3.1 色谱条件
色谱柱:Agilent Extend C18(4.6 ×250mm,5μm)柱;流动相:以甲醇为流动相A,以1%醋酸溶液为流动相B,按表1 中的规定进行梯度洗脱;流速为1.0mL/分;检测波长为316nm;柱温为35℃。
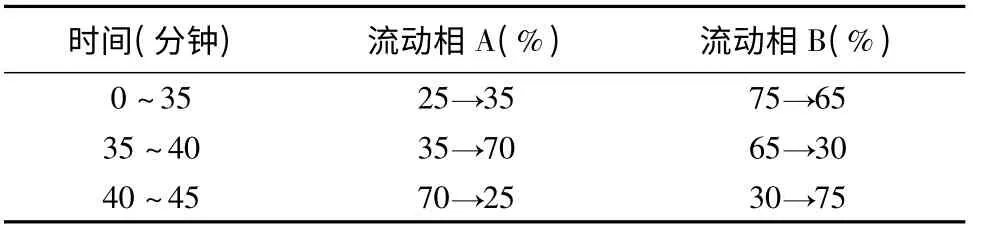
表1 流动相梯度
3.2 对照品溶液的制备
取阿魏酸对照品适量,精密称定,置棕色量瓶中,加70%甲醇制成每1mL 含10.50μg 的溶液,即得。
3.3 供试品溶液的制备
取本品内容物3g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20mL,密塞,称定重量,加热回流30 分钟,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,静置,取上清液滤过,取续滤液,即得。
3.4 当归阴性对照溶液的制备
取当归阴性对照样品,按照“3.3”项下方法制备阴性对照溶液。
3.5 空白试验
分别精密吸取上述溶液各10μL,注入液相色谱仪,在上述色谱条件下测定。结果阴性对照溶液色谱在对照品色谱相应的位置上,无其他色谱峰干扰,说明该方法专属性较好(见图5)。
3.6 线性关系考察
精密称取阿魏酸对照品适量,加70%甲醇溶解制成每1mL 含阿魏酸25.06μg 的溶液,分别精密移取1、2、3、4、5、6mL 于10mL 量瓶中,加70%甲醇稀释至刻度。精密吸取各浓度对照品溶液10μL,注入液相色谱仪,测定,记录峰面积,以阿魏酸的进样量为横坐标X,以色谱峰面积为纵坐标Y,计算回归方程,结果表明阿魏酸在25.06 ~150.36ng 范围内线性关系良好,其回归方程为:Y =6.3353X -6.6305,相关系数r=0.99999。

图5 阿魏酸HPLC 图
3.7 精密度试验
精密吸取阿魏酸对照品溶液(10. 50μg/mL)10μL,连续进样6 次,其峰面积平均值为680.4381,RSD 为0.38%,表明仪器精密度良好(见表2)。
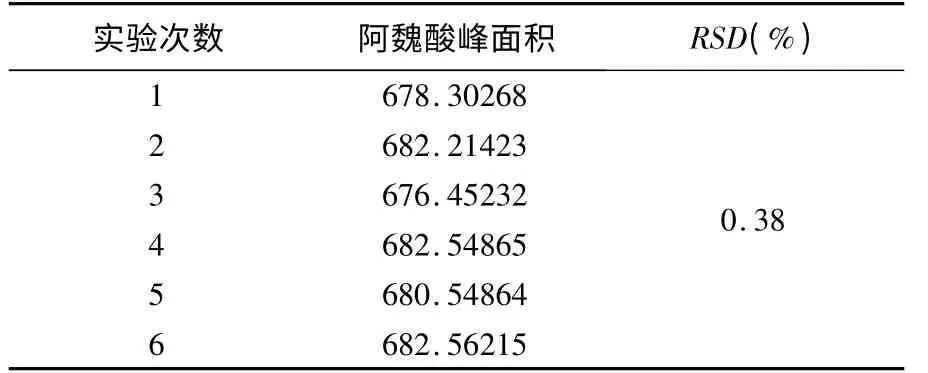
表2 精密度试验结果(n=6)
3.8 稳定性试验
取本品内容物(批号:120801)3g,精密称定,按“3.3”项下方法制备供试品溶液,分别于0,2,4,8,12 小时,18 小时进样10μL,测得其峰面积RSD 为0.43%,表明供试品溶液在18 小时内稳定(见表3)。
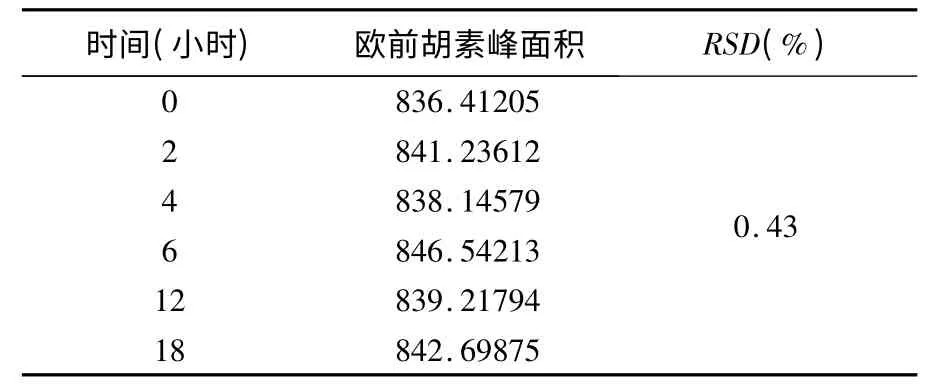
表3 稳定性试验结果(n=5)
3.9 重复性试验
取同一批次样品(批号:120801),分别精密称取6 份,按“3.3”项下方法制备供试品溶液,依法测定,计算阿魏酸的平均含量为0.0645mg/g,RSD 为0.68%,结果表明本方法有较好的重复性(见表4)。
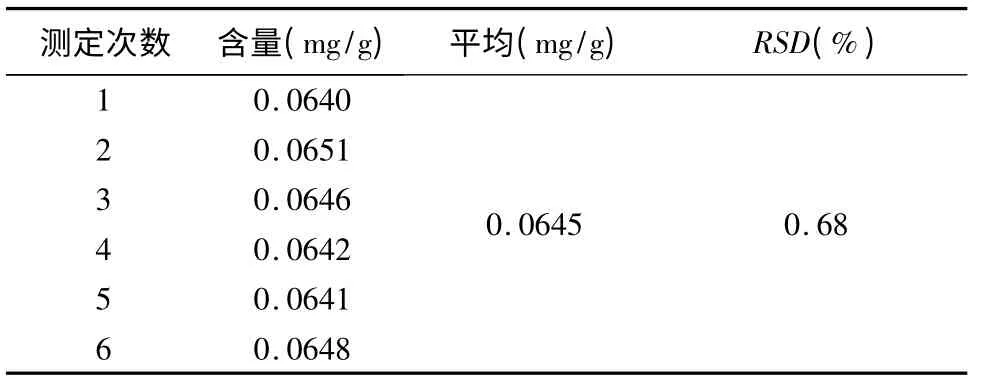
表4 样品重现性试验(n=6)
3.10 加样回收率试验
取已知含量(0. 0643mg/g)的样品(批号:120801)6 份,每份约1.5g,精密称定,分别精密加入一定量的阿魏酸对照品,按“3.3”项下方法制备供试品溶液,依法测定,计算平均回收率为98.46%,RSD 为1.85%。结果表明:回收率较好,此方法可行(见表5)。

表5 加样回收率试验结果
3.11 含量测定
分别 取3 批 样 品(批 号:120801、120802、120803),按“3.3”项下方法制备供试品溶液,分别测定阿魏酸的含量,计算结果(见表6)。

表6 样品含量测定结果
4 讨论
4.1 对方中白芍进行薄层鉴别时,采用药典方法展开效果不佳。尝试多种方法后,最终采用D101 型大孔吸附树脂柱纯化样品,结果斑点清晰,分离效果好。
4.2 对方中柴胡进行薄层鉴别时,曾尝试多种制备方法及不同展开系统,最终采用文中所述方法,结果薄层色谱斑点清晰,分离度较好。
4.3 在阿魏酸的含量测定过程中,经过多次试验,最终采用甲醇-1%醋酸溶液为流动相进行梯度洗脱,结果分离度较理想,阿魏酸峰形较好。另外,分别考察了提取方法,提取时间和提取溶剂等因素,结果以20mL 70%甲醇为提取溶剂,加热回流30 分钟,提取效果较佳。
5 结论
本文所建立的TLC 方法能准确、快速地鉴别方中所含当归、白芍、黄芪和柴胡,其TLC 特征斑点清晰,分离度好,阴性对照均无干扰;阿魏酸的HPLC含量测定方法操作简单,准确可靠,重现性好。上述方法可作为复方归芍胶囊的质量控制方法。
[1]国家药典委员会.中华人民共和国药典2010 年版(一部)[S].北京:中国医药科技出版社,2010:96,124,263,283.
[2]苏克剑,孙黎,黄旭彬,等.肝八味胶囊的薄层定性鉴别[J].中国医院药学杂志,2008,28(11):932 -933.
[3]贺银梅,李赟,夏继伟.柴术乳康胶囊质量标准的研究[J]. 内蒙古中医药,2008,27(11):102.
[4]涂瑶生,毕晓黎.益肾康胶囊质量标准的研究[J].中国实验方剂学杂志,2006,12(8):16 -18.
[5]贺云彪,刘军,伍良知.高效液相色谱法测定当归养血丸中阿魏酸含量[J].中国现代药物应用,2010,4(16):15 -16.

