多噬伯克霍尔德氏菌WS-FJ9对草甘膦的降解特性
李冠喜,吴小芹,叶建仁
(1. 南京林业大学森林资源与环境学院,南京 210037; 2. 连云港市农业科学院, 连云港 222006;3. 江苏省有害生物入侵预防与控制重点实验室, 南京 210037)
多噬伯克霍尔德氏菌WS-FJ9对草甘膦的降解特性
李冠喜1,2,3,吴小芹1,3,*,叶建仁1,3
(1. 南京林业大学森林资源与环境学院,南京 210037; 2. 连云港市农业科学院, 连云港 222006;3. 江苏省有害生物入侵预防与控制重点实验室, 南京 210037)
长期或不当施用草甘膦会对非靶标生物和环境造成破坏作用。微生物是生物修复的重要生物资源,利用微生物及其产生的降解酶处理环境中有机磷农药的方法,已显示出良好的应用前景,是近年来研究有机磷农药降解的主要发展方向。研究分离松树根际土壤的高效解磷细菌多噬伯克霍尔德氏菌(Burkholderiamultivorans)WS-FJ9菌株对草甘膦的降解特性及其降解条件的优化。采用添加不同浓度草甘膦NA平板接种WS-FJ9菌株观察其对草甘膦的耐受性;分别以草甘膦为唯一碳源、氮源或磷源,探讨WS-FJ9菌株对草甘膦的利用状况;采用低进水量间歇式反应器法(FBR)测定了WS-FJ9菌株降解草甘膦动力学参数;利用Plackett-Burman(PB)、Central Composite Design(CCD)试验设计及响应面分析法(RSM)筛选与优化影响WS-FJ9菌株降解草甘膦的主要因素。WS-FJ9菌株有效降解草甘膦的最大耐受浓度为0.4%; WS-FJ9菌株在以草甘膦为唯一碳源、氮源或磷源培养基上均能正常生长;WS-FJ9菌株对草甘膦的亲和性常数(Ks值)为65 μL/mL,对草甘膦降解的极限浓度(Smin)为21.9 μL/mL;通过PB试验,筛选出3个影响菌株降解草甘膦的关键因素为培养温度、葡萄糖及硫酸铵的加入量,通过CCD设计及响应面法优化分析得到影响草甘膦降解率的关键因素的二阶模型,确定了WS-FJ9菌株降解草甘膦的最优实验操作条件为:培养温度27.7℃,葡萄糖和硫酸铵的加入量分别为0.67、0.50 g/L。实验条件下WS-FJ9菌株对草甘膦的降解率最高为72.83%。
多噬伯克霍尔德氏菌;降解;草甘膦;优化
草甘膦(Glyphosate,简称GPA)又称农达,学名 N-(膦酸甲基)甘氨酸(C3H8NO5P),是由美国孟山都公司(Monsanto)开发的一种有机磷除草剂,具有内吸作用,杀草谱广,主要用于果园、林地、农作物、免耕地等进行化学除草。尽管草甘膦具有高效、低毒、低残留等特点,但长期或不当施用对非靶标生物和环境造成的破坏作用不容忽视[1- 2]。近年来对草甘膦安全性的研究已成为焦点。刘攀[3]研究表明土壤环境中50%—80%的益虫死于残留的草甘膦污染。耿德贵等[4]研究发现草甘膦能明显地诱发黄鳝染色体数目和结构畸变率上升。邓晓等[5]研究发现草甘膦对土壤微生物的种群数量及土壤中细菌、放线菌和真菌生长速率均具有一定的抑制作用。Daruich等[6]、Fujii等[7]、Dallegrave等[8]分别以鼠类进行了草甘膦的毒性试验,结果表明,长期接触草甘膦可导致妊娠期雌鼠后代的大脑产生多功能性变异,导致胎儿的骨骼无法正常发育。Poulsen等[9]研究表明草甘膦能够穿透人类胎盘障碍进入胎儿室继而对人类胎儿的发育造成伤害。
微生物是生物修复的重要生物资源,利用微生物及其产生的降解酶处理环境中有机磷农药的方法,已显示出良好的应用前景,是近年来研究有机磷农药降解的主要发展方向。目前,在我国已有高抗或降解草甘膦的菌株被分离筛选出来[10- 12],大多属于假单孢菌属(Pseudomonas)、节杆菌属(Arthrobacter)、肠肝菌科菌(Enterobacteriaceae)、根瘤菌科(Rhizobiaceae)等。多噬伯克霍尔德氏菌(Burkholderiamultivorans)WS-FJ9菌株为本实验室在前期研究中从松树根际筛选获得的1株高效解磷细菌,前期的研究表明,该菌对哺乳动物安全可靠,具有促进植物生长和生物防治的功能。为探讨该菌是否具有生物降解农药残留的功能以及该菌在试验条件下最大降解率究竟与哪些因素有关以及这些因素的水平对降解率的影响究竟有多大,为今后深入研究草甘膦降解菌制剂做好前期的准备工作,本研究采用添加草甘膦的NA平板接种该菌株观察其对草甘膦的耐受性;分别以草甘膦为唯一碳源、氮源或磷源,探讨其对草甘膦的利用状况;采用低进水量间歇式反应器法(FBR)测定其降解草甘膦动力学参数;在前期对该菌生长特性研究的基础上,利用Plackett-Burman (PB) 及Central Composite Design (CCD) 试验设计对影响其降解草甘膦有关的8个因素进行筛选优化。研究结果可为开发草甘膦降解菌剂实现农药残留的生物修复提供菌种资源和参考依据,对农林业的可持续发展及环境的保护具有重要意义。
1 材料与方法
1.1 供试菌株、草甘膦及降解培养基
供试菌株为多噬伯克霍尔德氏菌(Burkholderiamultivorans)WS-FJ9菌株由本实验室分离筛选所得,已保藏于中国典型培养物保藏中心CCTCC (No. CCTCC M2011435)[13]。供试草甘膦为四川贝尔化工集团有限公司生产(含量为30%)。供试降解培养基为唯一磷源(改良蒙金娜有机磷培养基)、唯一碳源和唯一氮源培养基[12]。
1.2 WS-FJ9菌株对草甘麟的耐受性检测
将WS-FJ9菌株分别接种于含草甘磷0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%的NA平板上,28℃培养3 d,观察菌株的生长情况。
1.3 WS-FJ9菌株的唯一碳源、氮源和磷源试验
将WS-FJ9菌株活化后,用接种环挑取少量菌体接种于装有50 mL NB 液体培养基的100 mL三角瓶中,28℃、200 r/min振荡培养48 h。发酵液( 4℃,4629×g) 离心5 min,无菌生理盐水润洗菌体3次后,无菌生理盐水调节成浓度为1×108cfu/mL的菌悬液。分别将1 mL菌悬液接种于50 mL唯一碳源、唯一氮源和唯一磷源培养基,以不加碳源、氮源、或磷源的培养基为各自空白对照。28℃、200 r/min摇床振荡培养3 d,离心后上清液采用HWλIOSγ型分光光度计测定600 nm处的吸光度。
1.4 草甘膦降解率的测定
将1 mL菌悬液接种于含50 mL以草甘膦为唯一磷源培养基的100 mL三角瓶中(部分三角瓶中的装液量按试验要求进行),28℃、200 r/min摇床振荡培养3 d后,降解发酵液转移至50mL离心管中,加入0.5 g无磷活性炭,采用SM- 650D型超声波细胞破碎仪进行细胞破碎20 min后离心 (4℃,4629×g) 10 min,取上清液测定无机磷含量;取5 mL草甘膦降解发酵液置于凯氏瓶中,加入9 mL的浓硫酸和1 mL高氯酸,用电炉消煮,至消煮液呈现透明,冷却后调节pH值至7.0,再定容至50mL,测定总磷含量。磷含量的测定采用钼锑抗比色法[14]。草甘膦降解率=(M1-M2)/M1×100%(M1:培养前有机磷含量;M2:培养后有机磷含量;有机磷含量=总磷含量-无机磷含量)。
1.5 WS-FJ9菌株降解草甘膦动力学参数的测定
将WS-FJ9菌株的菌悬液按1%接种量接种到NB液体培养基上28℃、200 r /min振荡培养3 d后,取2 L发酵液( 4℃,4629×g) 离心5 min后,菌体用无菌生理盐水润洗3次后加入含2 L灭菌的唯一磷源基础培养基的容器内制成生化反应器,置于28℃恒温培养箱中。动力学参数测定参照周军等[15]的方法,采用FBR(低进水量间歇式反应器)法,草甘膦含量的测定按1.4的方法进行,将测定的动力学参数用下式计算极限浓度:
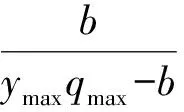
式中,Smin为极限浓度(μL/mL);Ks为细菌对基质的亲和性常数(μL/mL);ymax为细菌最大产率系数(mg/mg);qmax为最大比基质利用速率(d-1);b为细菌衰减系数(d-1)。
1.6 WS-FJ9菌株降解草甘麟PB试验设计
选取影响WS-FJ9菌株降解草甘膦的8个因素,采用Plackett-Burman(PB)设计方案进行关键变量的筛选。试验设计如表2所示,8个变量分别通过12次实验进行评价分析,每个变量通过两个水平(低水平-1和高水平+1)来检测。响应值通过降解率来衡量。每个变量的显著性通过P值和显著水平确定。
1.7 WS-FJ9菌株降解草甘麟中心复合试验及验证
采用中心复合试验设计(Central Composite Design,CCD)法对由Plackett-Burman筛选出的关键因素进行试验设计,同时固定其他非关键因素。中心复合试验包括含3个关键变量的20组实验,每个变量包含5个水平(表4)。当确定一个关键变量的最优水平,可以得到其它两个变量的等高线图和三维立体图,而确定这两个关键变量的最优值。回归模型的可信度由决定系数(R2)进行评估。以PB试验、CCD试验确定的最佳降解因素,进行WS-FJ9菌株降解草甘膦试验,验证优化方案。
1.8 数据分析与处理
采用Office 2003和Design Expert 8.07(Stat-Ease Inc., Minneapolis, USA)软件进行PB、CCD试验设计、数据差异显著性检验(Plt;0.05)、回归分析及图表绘制。
2 结果与分析
2.1 WS-FJ9菌株对草甘膦的耐受性
NA平板上草甘膦含量从0.1%增加到0.4%的过程中,菌株的生长状况没有明显的变化,均表现为旺盛生长;草甘膦含量继续增加,菌株的长势逐渐减弱;当草甘膦达到0.8%时,菌株不能生长(表1)。表明多噬伯克霍尔德氏菌(Burkholderiamultivorans)WS-FJ9菌株对草甘麟有一定的耐受能力,当草甘膦含量为0.4%时,菌株长势不减弱,说明菌株对草甘膦耐受的最大浓度为0.4%。

表1 多噬伯克霍尔德氏菌WS-FJ9菌株对草甘麟的耐受性
++++:生长旺盛;+++:生长较好;++:生长;+:生长很少;-:不生长
2.2 WS-FJ9菌株在唯一碳源、氮源和磷源培养基上的生长状况
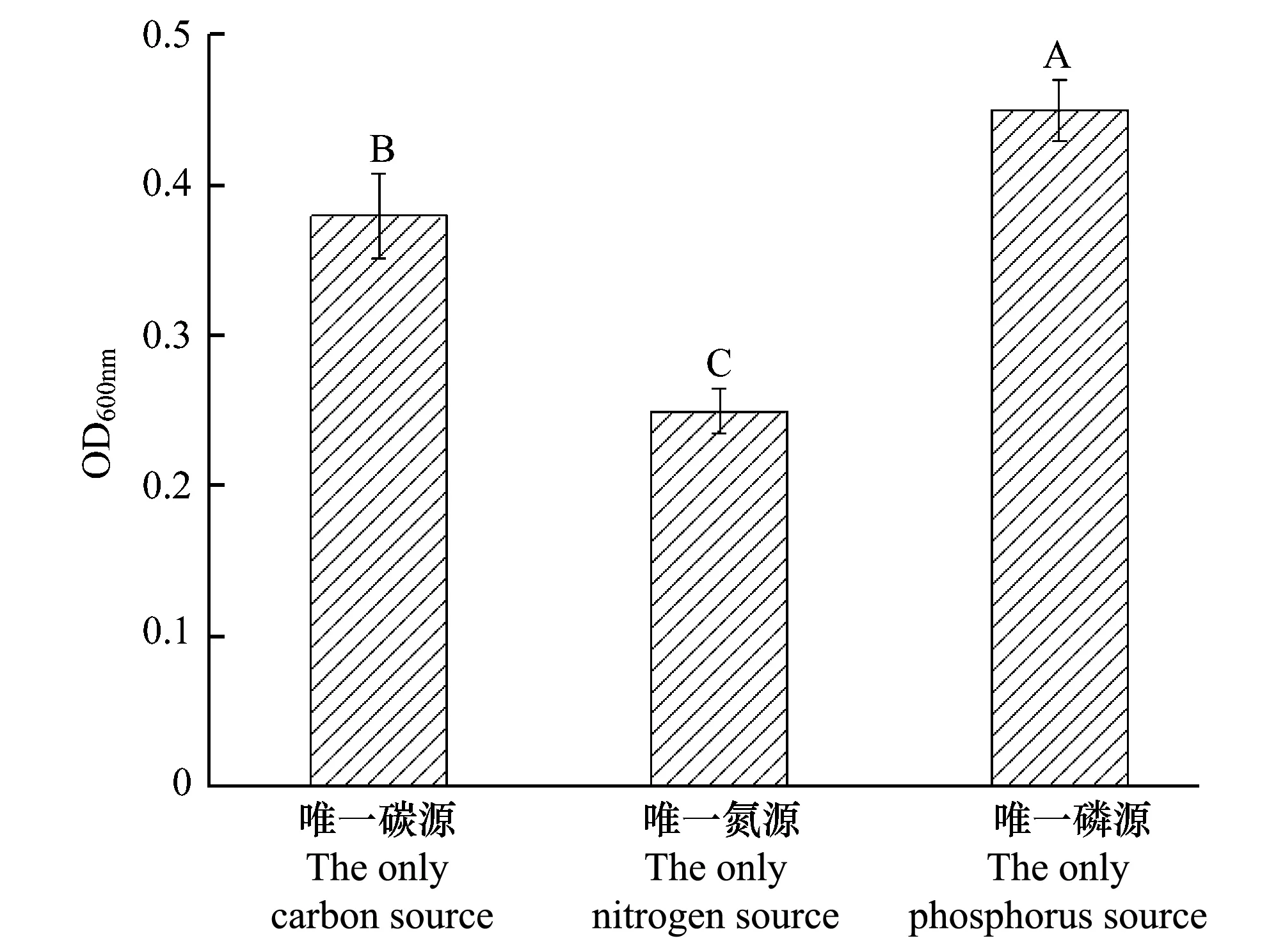
图1 多噬伯克霍尔德氏菌WS-FJ9菌株在以草甘膦为唯一碳源、氮源和磷源培养基上的生长状况Fig.1 The growth status of strain B.multivorans WS-FJ9 on the medium by glyphosate as the only carbon source, the only nitrogen source and the only phosphorus source
WS-FJ9菌株在以草甘膦为唯一碳源、氮源和磷源培养基上均能正常生长。由图1可知,菌株在以草甘膦为唯一磷源的培养基上生长最好,唯一碳源培养基次之,唯一氮源培养基最差。因此,在后续试验中均采用以草甘膦为唯一磷源的培养基。
2.3 WS-FJ9菌株降解草甘膦的动力学参数
反应器中草甘膦的浓度始终维持在较低的水平,有利于探明微量有机物污染生物修复的机制。测定结果如下:Ks=65 μL/mL;ymax=0.31 mg/mg;qmax=1.625 d-1;b=0.127 d-1。把测定结果代入1.5的公式,经计算得到B.multivoransWS-FJ9降解草甘膦的极限浓度(Smin)的值为21.9 μL/mL。表明该菌可应用于微量有机物生物高度净化技术,对痕量农药的污染治理具有很好的应用潜力。
2.4 WS-FJ9菌株降解草甘麟关键影响因素的筛选
Plackett-Burman试验设计及结果见表2。采用Design Expert 8.07软件对表3中的降解率数据进行回归分析,得到各影响因素的偏回归系数(表3)。由表3可看出,X2(初始pH)、X5(葡萄糖)、X6((NH4)2SO4)表现为负效应,而其它因素表现为正效应。因素X1(温度)、X5(葡萄糖)、X6((NH4)2SO4)为主要影响因子,其贡献值分别为18.85%、39.09%和29.01%,而其他因素对响应值降解率为低值影响。经影响因素筛选,得到以降解率为响应值的线性回归方程:Y=35.24+3.54X1-4.07X5-35.07X6,方程中Y为预测的降解率,Xi为变量。方差分析模型的P值为0.0007,决定系数(R2)为0.8705,调整系数(adjR2)为0.8220,变化系数(CV)为14.30%,精密度为12.570,表明该数学模型能较好的表征实验的实际情况。
2.5 WS-FJ9菌株降解草甘麟关键影响因素CCD试验结果及效应分析
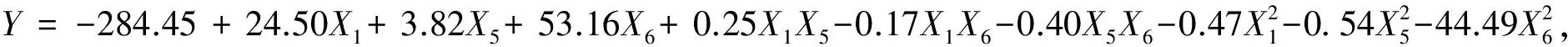
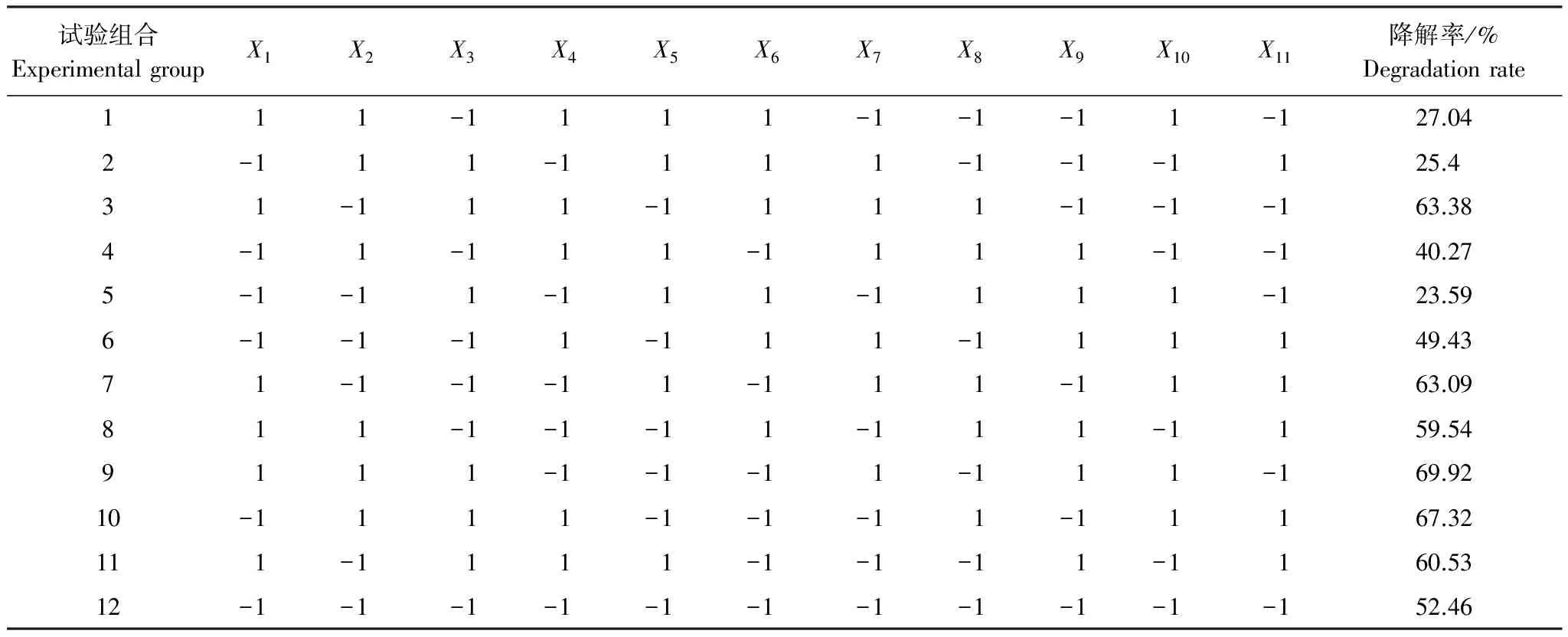
表2 Plackett-Burman试验设计及结果
X1:温度,-1为24℃,1为28℃;X2:初始pH值,-1为6.0,1为7.0;X3:接种量,-1为1%,1为5%;X4:100 mL三角瓶装液量,-1为50 mL,1为75 mL;X5:葡萄糖加入量,-1为10 g/L,1为15 g/L;X6:(NH4)2SO4加入量,-1为0.5g/L,1为1 g/L;X7:转速,-1为160 r/min,1为200 r/min;X8:GPA加入量,-1为0.1%,1为0.4%;X9、X10、X11:虚拟因素
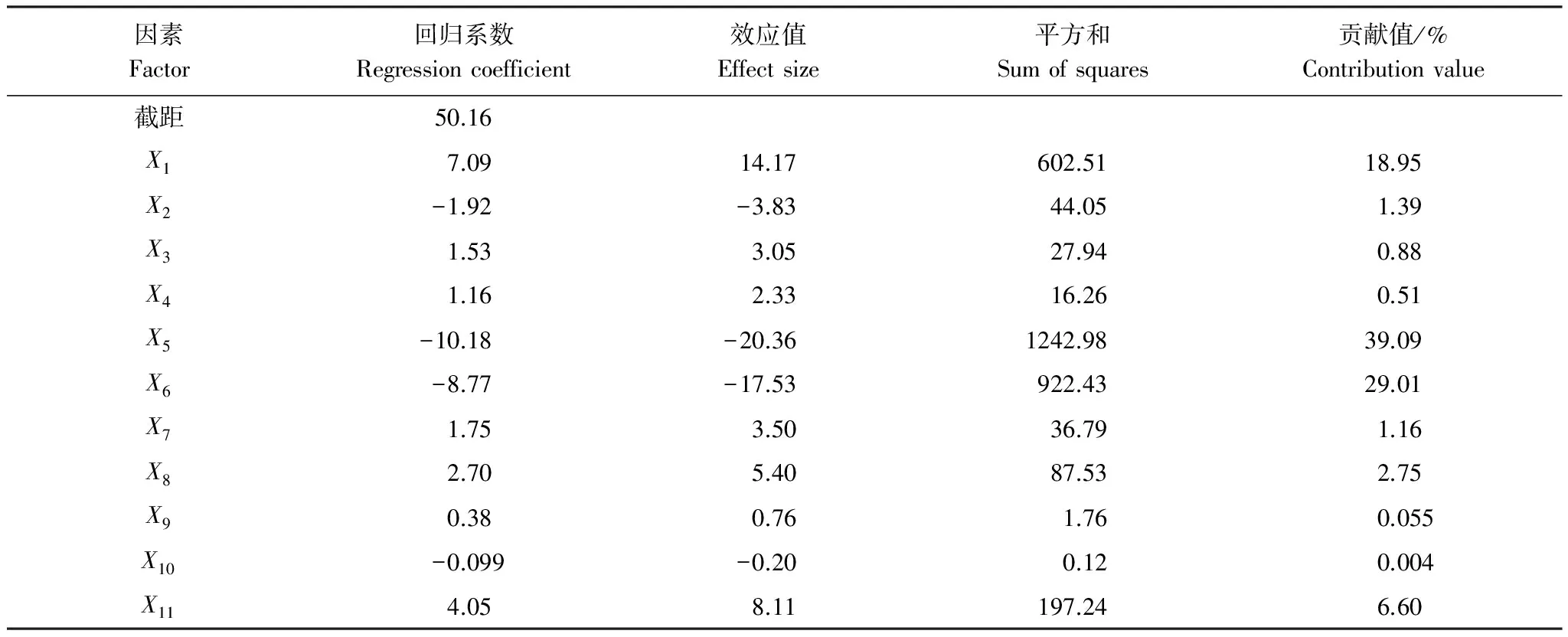
表3 偏回归系数及影响因子的显著性分析
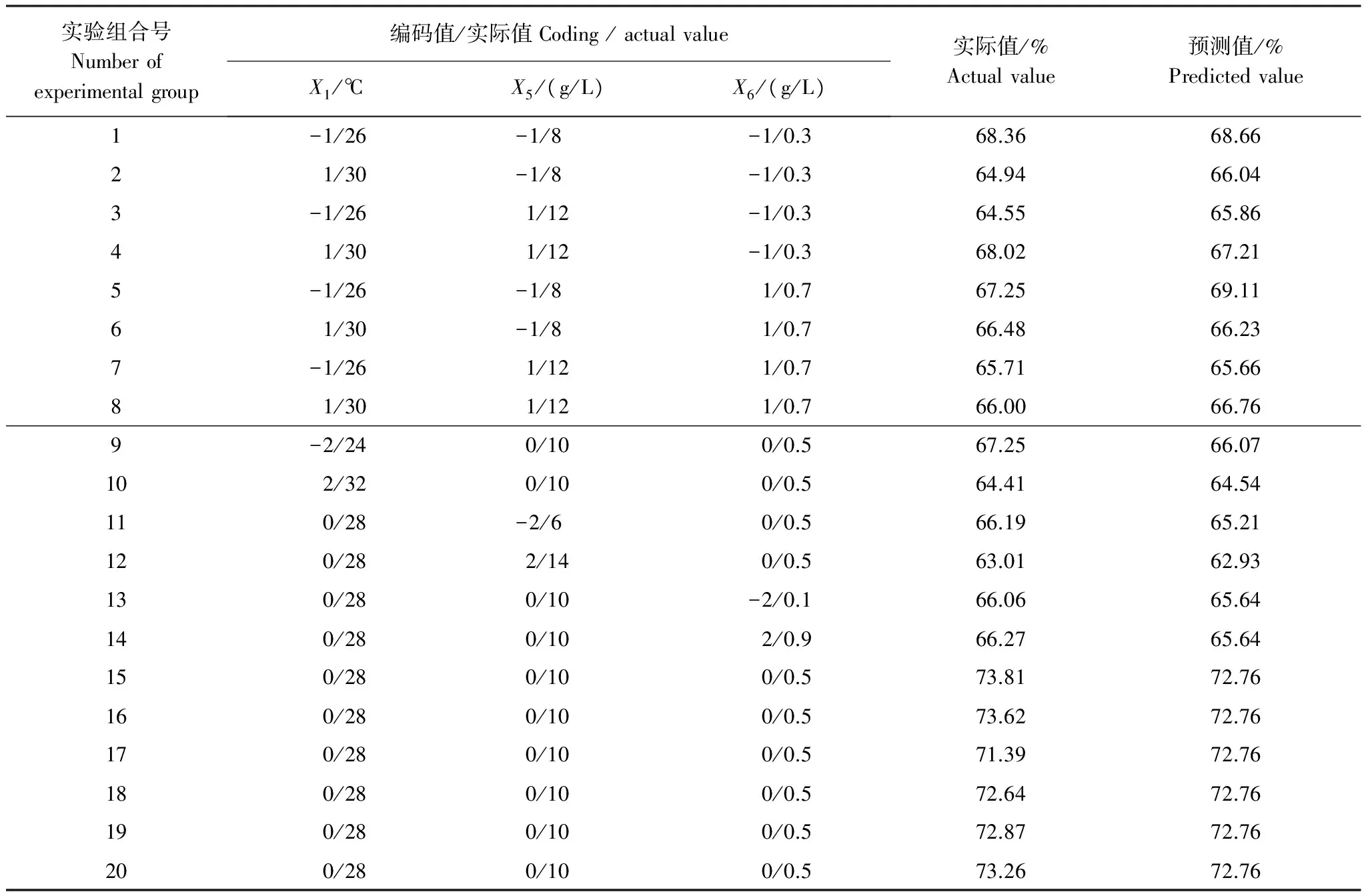
表4 中心组合设计及结果
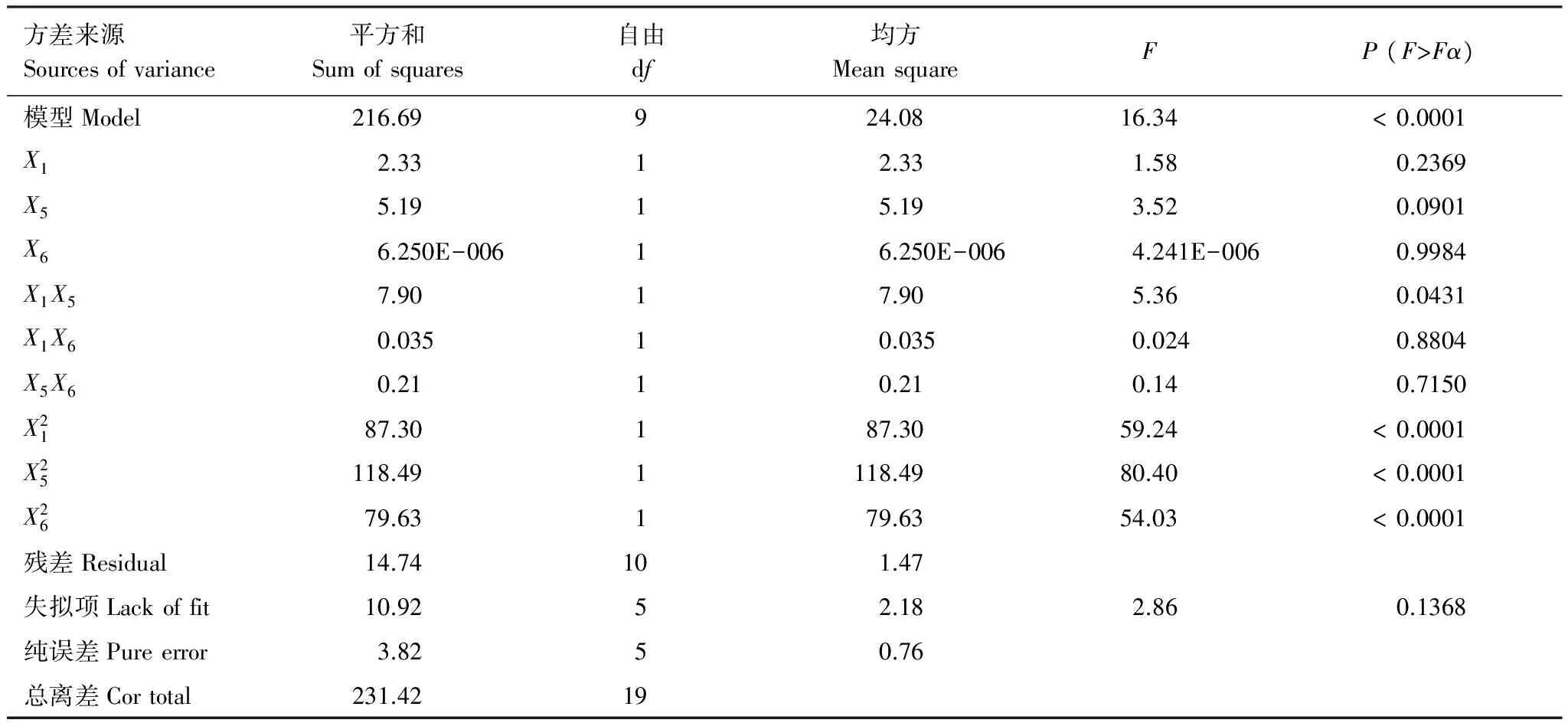
表5 降解率优化的模型适配和方差分析结果
2.6 WS-FJ9菌株降解草甘麟的响应面分析及验证
为进一步优化多噬伯克霍尔德氏菌(B.multivorans)WS-FJ9菌株对草甘麟的降解率,等高线图和三维立体图被用于对实验数据进行分析。它们能更直观的显示不同变量以及它们的交互作用对响应值的影响。等高线的形状能够反应交互作用是否显著。椭圆表示交互作用显著,而非椭圆则相反。等高线图(图2,图3,图4)清晰的表明,温度和葡萄糖加入量的交互作用显著,而温度和硫酸铵加入量,以及葡萄糖和硫酸铵加入量之间交互作用不显著。该结果和表7中的分析结果一致,表明这些结果真实反应了不同变量之间的相互作用。图2显示硫酸铵加入量在最佳值为0.50 g/L条件下,温度和葡萄糖加入量对降解率的交互影响;图3显示葡萄糖加入量在最佳值为9.67 g/L条件下,温度和硫酸铵加入量对降解率的交互影响;图4显示温度在最佳值为27.7 ℃条件下,硫酸铵和葡萄糖加入量对降解率的交互影响。由设计软件得到WS-FJ9菌株降解草甘麟最优条件为:固定其他因素,关键因素蒙金娜基础培养基中葡萄糖和硫酸铵的加入量分别为9.67、0.50 g/L,温度控制在27.7 ℃,理论计算草甘麟降解率达72.83%。按照优化后的条件,蒙金娜基础培养基中葡萄糖和硫酸铵的加入量分别为9.67、0.50 g/L,其他成分按基础配方,草甘麟加入量0.4%,100 mL三角瓶装液量50 mL,接种量1%,初始pH7.0,转速200 r/min,温度控制在27.7 ℃。3 d后实测草甘膦降解率为71.98%,与预测值72.83%较接近,证明了WS-FJ9菌株降解草甘麟优化处理时PB和CCD方法联用的可行性和准确性。
2.选择素材。打开Photoshop软件,点击“文件——打开”,选择我们要处理的图片。此时图片1的图层处于锁定状态(如图2所示)。
3 结论和讨论
近年来,利用微生物的降解功能处理环境中的草甘膦污染越来越受到人们的重视,将草甘膦降解菌制成生物菌剂用于草甘膦环境污染的生物修复已成为国内外研究热点。目前国内外已开发出的一系列处理草甘膦废水的工业方法[16- 18]的应用都存在一定的局限性,主要是施工量大、设备成本高、而且处理结果不理想易造成二次污染等。利用高效降解微生物来降解工业废水中的草甘膦具有处理方便、快捷、迅速,成本相对低廉等优点。

图2 温度和葡萄糖加入量对草甘膦降解率交互影响的三维曲面图和等高线图Fig.2 Surface and contour plots of mutual effect for temperature and glucose quantity on the degradation rate of glyphosate

图3 温度和硫酸铵加入量对草甘膦降解率交互影响的三维曲面图和等高线图Fig.3 Surface and contour plots of mutual effect for temperature and ammonium sulfate quantity on the degradation rate of glyphosate
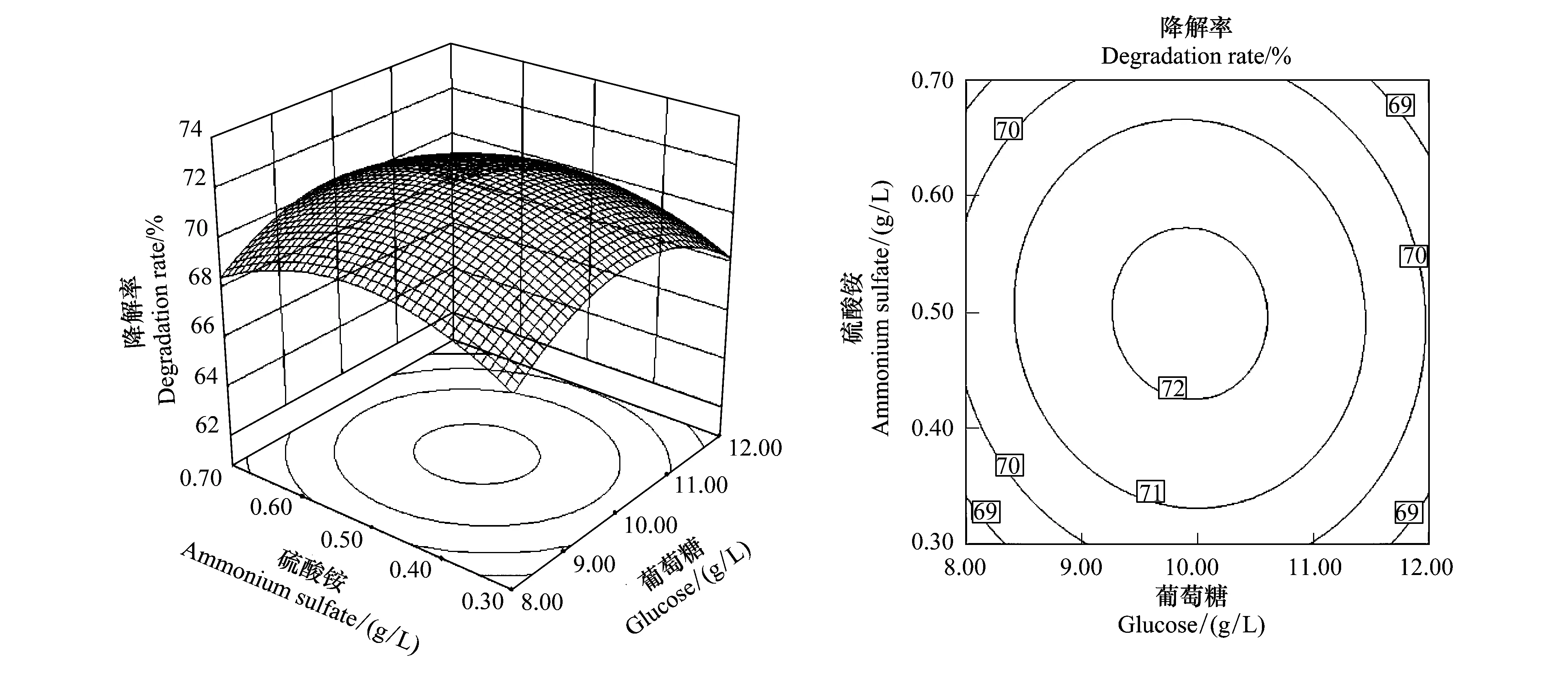
图4 葡萄糖和硫酸铵加入量对草甘膦降解率交互影响的三维曲面图和等高线图Fig.4 Surface and contour plots of mutual effect for glucose and ammonium sulfate quantity on the degradation rate of glyphosate
本研究采用添加草甘膦的NA平板接种多噬伯克霍尔德氏菌(Burkholderiamultivorans)WS-FJ9菌株,结果表明该菌对草甘膦具有较高耐受性(耐受浓度达0.4%),可以应用于高含量草甘膦污染的治理。据报道,草甘膦在其生产废水池中的含量在0.1%—1%之间,在长期使用草甘膦地区的地表水中的含量在0.009%—0.86%之间,不同地区草甘膦的含量不同是因其还与雨水径流及水流路径有关[19- 21]。因此,该菌可用于草甘膦生产废水的治理,同时由于该菌在以草甘膦为唯一碳源、唯一氮源或唯一磷源的培养基上均能正常生长,这将有利于在草甘膦污染的治理过程中进一步降低成本。
近年研究发现,许多化学物质即使在很低的浓度下对人体和生态环境仍然产生很大的危害,生物高度净化技术成为新的研究热点。该技术的理论关键点在于生物降解极限浓度(Smin)和基质亲和性常数(Ks)[22- 23],认为在低基质浓度情况下,降解速率同基质的浓度成正比关系,当基质浓度降至某一值时,微生物的生长速率与死亡速率达到了动态平衡,此时的浓度即为极限浓度(Smin);在微量化学物质高度净化过程中,净化速率主要取决于微生物对基质的亲和性,Ks越低亲和性就越好,净化速率也就越高,而常量化学物质的一般净化主要取决于微生物的增殖量[24]。周军等[15]经过试验测定了苯胺的各降解动力学参数,其Smin和Ks值分别为0.025 mg/L和0.077 mg/L。本研究所测定的Smin和Ks值分别为65 μL/mL 和21.9 μL/mL,因此,WS-FJ9菌株可应用于痕量污染(农田及各种低草甘膦含量污染的水体)的治理,是生物高度净化技术中极有应用潜力的菌株。
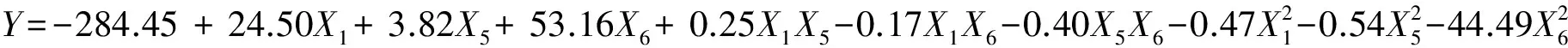
微生物通过驯化筛选可以增强某一特定功能。汤鸣强等[10]采用培养基中添加不同浓度梯度的草甘膦对从耕作土壤中分离到草甘膦降解菌进行驯化培养与筛选,获得一株对草甘膦具有高耐受性、高降解能力的菌株胶红酵母RhodotorulamucilaginosaZM- 1 (降解率为85.38%)。本研究所采用的B.multivoransWS-FJ9适应能力强,耐受力已达0.4%草甘膦含量的浓度。如果进行定向驯化筛选,相信其对草甘膦的耐受性及降解能力会有较大的提高,这有待于进一步研究。另外,本研究采用PB和CCD试验设计连用及RSM分析法进行了实验条件优化,相对于传统的单因素实验和正交实验,具有试验次数少、周期短,求得的回归方程精度高等优点,并能通过图形分析较直观地寻求最优考察因素值、确定试验因素及其交互作用在试验过程中对指标响应值的影响[25]。
[1] Busse M D, Ratcliff A W, Shestak C J, Powers R F. Glyphosate toxicity and the effects of long-term vegetation control on soil microbial communities. Soil Biology amp; Biochemistry, 2001, 33(12/13): 1777- 1789.
[2] Koger C H, Shaner D L, Krutz L J, Walker T W, Buehring N, Henry W B, Thomas W E, Wilcut J W. Rice (Oryzasativa) response to drift rates of glyphosate. Pest Management Science, 2005, 61(12): 1161- 1167.
[3] Liu P. Effects of Glyphosate on the Soil Microecosystem and Research of Glyphosate-degradation and Glyphosate-resistance Fungi [D]. Changchun: Jilin University, 2009.
[4] Geng D G, Chen G, Han Y, Pan S Y, Zhao R J. The studies on the mutagenesis of the herbicide glyphosate in cells ofMonopterusalbus. Journal of Xuzhou Normal University: Natural Sconces, 2000, 18(2): 59- 61.
[5] Deng X, Li Y Q. Effect of glyphosate on soil microorganisms. Chinese Journal of Pesticides, 2005, 44(2): 59- 62.
[6] Daruich J, Zirulnik F, Gimenez M S. Effect of the herbicide glyphosate on enzymatic activity in pregnant rats and their fetuses. Environmental Research, 2001, 85(3): 226- 231.
[7] Fujii T. Transgenerational effects of maternal exposure to chemicals on the functional development of the brain in the offspring. Cancer Causes and Control, 1997, 8(3): 524- 528.
[8] Dallegrave E, Mantese F D G, Coelho R S, Pereira J D, Dalsenter P R, Langeloh A. The teratogenic potential of the herbicide glyphosate-Roundup in Wistar rats. Toxicology Letters, 2003, 142(1/2): 45- 52.
[9] Poulsen M S, Rytting E, Mose T, Knudsen L E. Modeling placental transport: Correlation ofinvitroBeWo cell permeability andexvivohuman placental perfusion. Toxicology in Vitro, 2009, 23(7): 1380-1386.
[10] Tang M Q, You M S. Isolation and identification of a glyphosate-resistant yeasty strain (ZM-1) and its optimal growth and degradation traits. Microbiology China, 2010, 37(9): 1402-1409.
[11] Wang C. Preliminary Studies on Glyphosate-degradation byBacilluscereus[D]. Baoding: Agricultural University of Hebei, 2012.
[12] Kang J T. Study on Screening, Isolation and Identification of the Glyphosate Methlparathion-Degrading Bacterium [D]. Ya′an: Sichuan Agricultural University, 2010.
[13] Hou L. Studies on Screening of Efficient Phosphate-solubilizing Bacteria in the Rhizosphere of Pine Trees and on Their Characteristics [D]. Nanjing: Nanjing Forestry University, 2012.
[14] Zhang X S. Analysis of the factors affecting the available P content in the fermentation liquid of P bacteria determined by Mo-Sb colorimetry. Journal of Anhui Agricultural Sciences, 2008, 36(12): 4822- 4823.
[15] Zhou J, Zhao Q X, Jin X B. Threshold of aniline biodegradation. Environmental Pollution amp; Control, 2004, 26(6): 401- 403, 414- 414, 395- 395.
[16] Peng B, Wang L, Li Y R. Research on adsorption of glyphosate from wastewater by active aluminum oxide. Journal of Chemical Industry amp; Engineering, 2007, 28(1): 44- 48.
[17] Huang J, Hu X, Li Y, Wei J. Treatment of high salinity organic wastewater by iron-carbon microelectrolysis process. Environmental Protection of Chemical Industry, 2007, 27(3): 250- 252.
[18] Huang Y M, Li Q H, Zhou X B, Yu Z H, Huang Q L. Treatment of glyphosate wastewater by Fenton reagent oxidation-magnesium salt precipitation process. Environmental Protection of Chemical Industry, 2007, 27(2): 156- 159.
[19] Hua X M, Jiang X L. Characteristics and control countermeasures of pesticide pollution and its damage on environment in China. Research of Environmental Sciences, 2000, 13(3): 40- 43.
[20] Chang F C, Simcik M F, Capel P D. Occurrence and fate of the herbicide glyphosate and its degradate aminomethylphosphonic acid in the atmosphere. Environmental Toxicology and Chemistry, 2011, 30(3): 548- 555.
[21] Coupe R H, Kalkhof S J, Capel P D, Gregoire C. Fate and transport of glyphosate and aminomethylphosphonic acid in surface waters of agricultural basins. Pest Management Science, 2011, 68(1): 16- 30.
[22] Ribes J, Keesman K, Spanjers H. Modelling anaerobic biomass growth kinetics with a substrate threshold concentration. Water Research, 2004, 38(20): 4502- 4510.
[23] Schmidt S K, Scow K M, Alexander S M. Kinetics of P-nitrophenol mineralization by aPseudomonassp.: effects of second substrates. Applied and Environmental Microbiology, 1987, 53(11): 2617- 2623.
[24] Li J Y, Zhao Q X, Sun X B, Li D. Factors affecting kinetic threshold concentration of biodegradation. Journal of East China University of Science and Technology: Natural Science Edition, 2006, 32(3): 309- 312.
[25] Wang F H, Liu L, Wang Y H, Yang B. Optimization of protease activity fromBacillussubtilisGS- 1 and potential applications in protein hydrolysis. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2012, 51(4): 79- 86.
参考文献:
[3] 刘攀. 草甘膦对土壤微生态的影响及其抗性和降解真菌的研究 [D]. 长春: 吉林大学, 2009.
[5] 邓晓, 李雅琦. 草甘膦对土壤微生物影响的研究. 农药, 2005, 44(2): 59- 62.
[10] 汤鸣强, 尤民生. 抗草甘膦酵母菌ZM- 1的分离鉴定及其生长降解特性. 微生物学通报, 2010, 37(9): 1402- 1409.
[11] 王聪. 蜡样芽孢杆菌 (Bacilluscereus) 对草甘膦降解作用的初步研究 [D]. 保定: 河北农业大学, 2012.
[12] 康纪婷. 有机磷农药草甘膦降解菌的筛选、分离及其鉴定 [D]. 雅安: 四川农业大学, 2010.
[13] 侯亮. 松树根际高效解磷细菌的筛选及其解磷特性的研究 [D]. 南京: 南京林业大学, 2012.
[14] 张祥胜. 钼锑抗比色法测定磷细菌发酵液中有效磷含量测定值的影响因素分析. 安徽农业科学, 2008, 36(12): 4822- 4823.
[15] 周军, 赵庆祥, 金雪标. 苯胺生物降解极限的研究. 环境污染与防治, 2004, 26(6): 401- 403.
[16] 彭波, 王黎, 李艳荣. 活性氧化铝吸附法处理草甘膦生产废水的研究. 化学工业与工程技术, 2007, 28(1): 44- 48.
[17] 黄瑾, 胡翔, 李毅, 魏杰. 铁碳微电解法处理高盐度有机废水. 化工环保, 2007, 27(3): 250- 252.
[18] 黄燕梅, 李启辉, 周锡波, 余在华, 黄庆莉. Fenton 氧化- 镁盐沉淀法处理草甘膦废水. 化工环保, 2008, 27(2): 156- 159.
[19] 华小梅, 江希流. 我国农药环境污染与危害的特点及控制对策. 环境科学研究, 2000, 13(3): 40- 43.
[24] 李娟英, 赵庆祥, 孙贤波, 李丹. 有机物生物降解动力学极限浓度的影响因素. 华东理工大学学报: 自然科学版, 2006, 32(3): 309- 312.
[25] 王方华, 刘亮, 王永华, 杨博. 产蛋白酶菌株BacillussubtilisGS- 1发酵条件优化及蛋白酶水解应用初步研究. 中山大学学报: 自然科学版, 2012, 51(4): 79- 86.
ThecharacterizationofglyphosatedegradationbyBurkholderiamultivoransWS-FJ9
LI Guanxi1,2,3, WU Xiaoqin1,3,*,YE Jianren1,3
1CollegeofForestResourcesandEnvironmentNanjingForestryUniversity,Nanjing210037,China2LianyungangMunicipalAcademyofAgriculturalSciences,Lianyungang222006,China3JiangsuKeyLaboratoryforPreventionandManagementofInvasiveSpecies,Nanjing210037,China
Long-term or inappropriate use of glyphosate may damage the non-target organisms and environment. Microbes are important biological resources for bioremediation. In recent years, the method of using microbes and its catabolic enzymes to remediate organophosphorus pesticides in the environment has shown a promising potential in application. It is the main direction of research on organophosphorus pesticide degradation. This study aimed to investigate the degradation of glyphosate by an efficient phosphate solubilizing bacteriumBurkholderia.multivoransWS-FJ9 which was isolated from pine rhizosphere. Strain WS-FJ9 was grown on the plates of nutrient agar (NA) with different concentrations of glyphosate to determine the tolerance of strain WS-F19 to glyphosate. Glyphosate can be used by strain WS-FJ9 as the sole sources of carbon, nitrogen and phosphorus, respectively. The degradation dynamical parameters of strain WS-FJ9 on glyphosate were determined using low flooding quantity batch reactor method (FBR). Plackett-Burman (PB) design, central composite design (CCD), and Response Surface Methodology (RSM) were employed to screen and optimize the main factors of strain WS-FJ9 degrading glyphosate. The maximum concentration of tolerance to glyphosate for strain WS-FJ9 to remain efficiently degrading glyphosate was 0.4%. The affinity constant (Ks) of strain WS-FJ9 to glyphosate was 65 μL/mL and the minimal concentration (Smin) of glyphosate degraded by WS-FJ9 was 21.9 μL/mL. Three key factors (cultural temperature,glucose and ammonium sulfate) for the glyphosate degradation by strain WS-FJ9 were selected using PB design. The quadratic model for the three significant factors was established using CCD design and RSM with glyphosate degradation rate as the target response. Under the optimal degradation conditions, the incubation temperature was 27.7℃, and the amount of glucose and ammonium sulfate supplemented were 9.67 g/L and 0.50 g/L, respectively. The degradation rate of glyphosate by strain WS-FJ9 reached 72.83%.
Burkholderiamultivorans; degradation; glyphosate; optimization
国家林业公益性行业科研专项(201004061);江苏省普通高校研究生科研创新计划(CXLX11- 0552);江苏高校优势学科建设工程(PAPD)资助项目
2013- 02- 25;
2013- 07- 08
*通讯作者Corresponding author.E-mail: xqwu@njfu.edu.cn
10.5846/stxb201302250296
李冠喜,吴小芹,叶建仁.多噬伯克霍尔德氏菌WS-FJ9对草甘膦的降解特性.生态学报,2013,33(21):6885- 6894.
Li G X, Wu X Q,Ye J R.The characterization of glyphosate degradation byBurkholderiamultivoransWS-FJ9.Acta Ecologica Sinica,2013,33(21):6885- 6894.

