球形棕囊藻囊体形成对摄食化学信息的响应
魏 静,王小冬
(1. 中国海洋大学环境科学与工程学院,青岛 266100;2. 暨南大学赤潮与水环境研究中心,广州 510632)
棕囊藻(Phaeocystis)引发的有害藻华遍布从热带到南北两极的广大海区,在海洋碳、氮和硫循环过程中具有重要的调控作用[1-2].棕囊藻具有复杂的异型生活史[3],其生长阶段中包括微小的单细胞以及巨大的囊体阶段,单细胞只有几个微米,囊体直径一般为几百微米,中国南海和渤海发现的球形棕囊藻囊体直径甚至达到 3,cm,是世界上发现的最大的球形棕囊藻[4-5].棕囊藻藻华发生时多以囊体形态存在,单细胞偶尔存在[5].囊体外被由一层轻薄、坚韧而又具有弹性的半透膜组成,细胞分布于囊体外被内表层,而内部没有细胞仅仅为一些液体,因此整个囊体为中空状[6-7].
由于棕囊藻囊体坚韧的外被及相对较大的囊体体积,从而造成棕囊藻和摄食者之间的粒径不匹配(size-mismatch),导致浮游动物无法对囊体细胞进行有效的摄食,从而显著降低了囊体内细胞的死亡率[8-11].球形棕囊藻囊体形成和体积提高属于诱导性防御,摄食者的加入可以显著提高囊体体积[9].即使不直接接触浮游动物,棕囊藻囊体体积依然提高,可溶性化学信息在摄食-抑制摄食过程中具有重要的作用[10].Long 等[11]2007 年发现球形棕囊藻能够有效辨别摄食信息的性质从而引发不同的生理响应:当中型浮游动物(>200,μm)摄食时,囊体体积降低;当微型浮游动物摄食(20~200,μm)时,囊体体积升高,从而降低了摄食的效率.
但是上述研究中采用的棕囊藻囊体体积均小于500,μm,而我国发现的球形棕囊藻囊体则能达到3,cm,已经远远超过中型浮游动物的粒径范围.微型浮游动物摄食提高囊体体积而中型浮游动物摄食引起囊体体积降低这一规律可能并不适应我国海区球形棕囊藻.在本研究中,分别利用微型和中型摄食者摄食球形棕囊藻,观察其囊体形成和体积变化,从而探索棕囊藻对浮游动物摄食的生理响应.考虑到我国南海及其渤海海域频发的球形棕囊藻藻华导致的经济损失和生态灾难,本研究也可为球形棕囊藻藻华的防治提供一定的理论依据.
1 材料与方法
1.1 藻种的培养
本研究中所用球形棕囊藻取自天津塘沽沿海藻华发生现场,囊体直径范围为 500,µm~1,cm,小心挑选健康完整的囊体用于实验.球形棕囊藻培养在盐度为30,psu 的f/2 培养基中,温度保持为20,℃,光照强度为100,μmol/(m2·s),光暗比为 12,h∶12,h.每隔7,d 更换部分培养基,使棕囊藻保持在指数生长期.
本次研究中采用的摄食者分别为海洋弯曲甲藻(Oxyrrhis marina,OM)以及中华哲水蚤(Calanus sinicus,CS).海洋弯曲甲藻购自美国西华盛顿大学Shannon Point 海洋中心,体长约 27,μm.海洋弯曲甲藻是摄食实验中反复使用的微型摄食者,能够大量摄食球形棕囊藻[9].而中华哲水蚤是我国海区主要的中型浮游动物,本次研究使用的中华哲水蚤采自广东大亚湾,通过潜水Ⅱ型网进行垂直拖网,样品置于黑暗水体中,立即带回实验室进行挑取,选择游动活跃的雌性中华哲水蚤进行实验,中华哲水蚤体长约2.4,cm.
1.2 摄食者对棕囊藻的摄食
将海洋弯曲甲藻和中华哲水蚤分别培养于 1,L的平底烧瓶中(Duran group,German),加入盐生杜氏藻(Dunaliella salina)进行喂养(细胞密度为 4×103,/mL).每天取 10,mL 培养液,通过 GF/F 膜过滤掉浮游植物和动物颗粒,保留过滤液进行实验.同时在烧瓶中重新加入 10,mL 新鲜 f/2 培养液保持饵料生长旺盛.
将球形棕囊藻单细胞接种至15 个透明培养瓶中(BD Biosciences,USA),接种体积为 500,mL,初始浓度为 4,000,个/mL.其中 5 个培养瓶每天加入 10,mL新鲜 f/2 培养液作为对照组,其余 10 个培养瓶分别加入上述滤出液作为摄食组(OM 组和 CS 组).所有培养瓶每天均取出 10,mL 培养液,保持培养体积的恒定.所有培养瓶均置于摇床上(VWR Scientific,USA)晃动,摇床转速为10,r/min,保持细胞均匀分布.培养温度为 20,℃,光照强度为 100,µmol/(m2·s),光暗比为12,h∶12,h.
1.3 取样与测定
研究表明,相同条件下,球形棕囊藻在 4~12,d内为指数生长期[12].本次实验于第 8 天结束,每个培养瓶中取出 20,mL 培养液,加入终浓度为 4%的酸性Lugol′s 溶液固定.在 Nikon TS100 倒置显微镜下观察计数囊体数量、囊体体积、囊体内细胞数量[12].另取 2 份 20,mL 培养液,分别通过 20.0,µm 和 0.7,µm的滤膜,90%丙酮萃取24,h 后利用 TD-700 荧光计测定囊体细胞叶绿素含量以及总叶绿素含量.最后将所有摄食者和饵料加入终浓度为 4%的酸性 Lugol′s溶液固定,计数摄食者和饵料的浓度.
1.4 数据处理
应用SigmaStat(v3.5,SPSS)进行数据统计和差异性检验.分析摄食组和对照组间球形棕囊藻囊体数量、囊体体积和囊体细胞数量的差异采用 One Way ANOVA,回归线斜率差异性利用 One Way ANCOVA 检验,显著性水平设置为p<0.05.
2 结 果
2.1 摄食信息产生
2 种摄食者均大量摄食了盐生杜氏藻,其中海洋弯曲甲藻有效控制了杜氏藻的生长,并且自身密度提高了约5 倍(见表1).尽管中华哲水蚤中饵料浓度依然很高,但是中华哲水蚤的密度在实验前后保持不变,且烧瓶底存在大量粪球,说明中华哲水蚤的摄食行为活跃.滤出液中存在可溶性摄食信息.
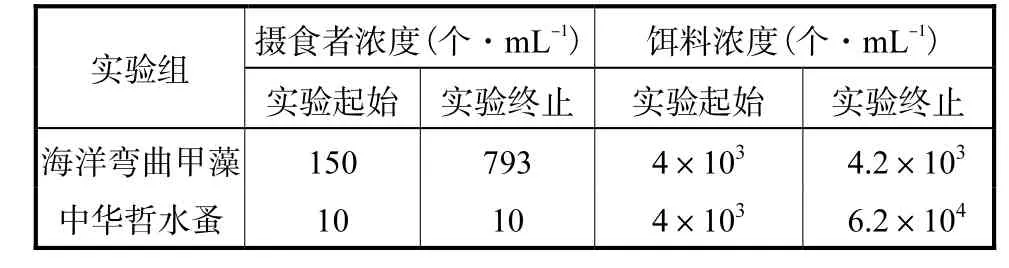
表1 实验前后摄食者和饵料浓度变化Tab.1 Changes in the grazer and prey concentration
2.2 球形棕囊藻囊体数量
无摄食压力时,球形棕囊藻囊体数量为 433.3,个/mL(见图 1).当存在摄食压力时,无论是微型摄食者还是中型浮游动物,囊体数量均显著提高(p=0.025),分别达到 666.0,个/mL 和 702.8,个/mL,但是2 个摄食组间并未有显著差异(p=0.05).
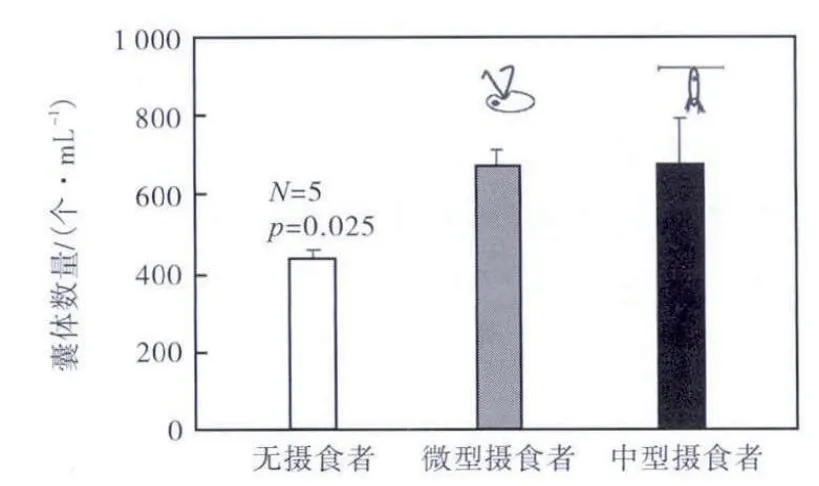
图1 不同类型摄食压力下囊体数量Fig.1 Colony amount under grazing pressure
2.3 球形棕囊藻囊体直径
对照组中球形棕囊藻囊体直径平均为2.5,mm(见图 2),而引入摄食信息后的囊体直径分别达到 5.5,mm(OM 组)和 7.8,mm(CS 组),均显著高于对照组(p<0.001),且 CS 组囊体直径显著高于 OM组(p<0.001).说明中华哲水蚤产生的摄食信息导致球形棕囊藻囊体直径进一步提高.
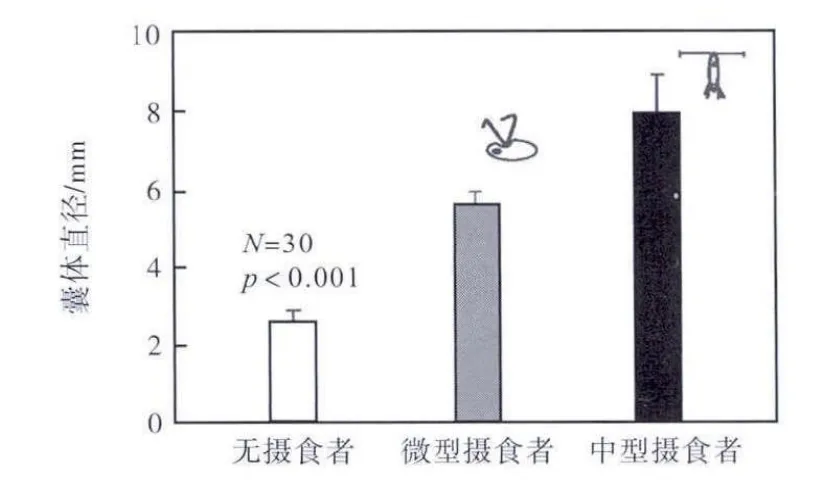
图2 不同摄食压力下囊体直径Fig.2 Colony diameters under grazing pressure
2.4 囊体叶绿素比例
未感受到摄食压力胁迫时,球形棕囊藻囊体细胞叶绿素为总叶绿素的 42.0%(见图 3).而一旦感受到摄食压力,细胞更多的以囊体细胞形态存在,其比例显著高于对照组(p<0.001),同囊体直径相似,CS 组囊体直径显著高于OM 组(p<0.001).
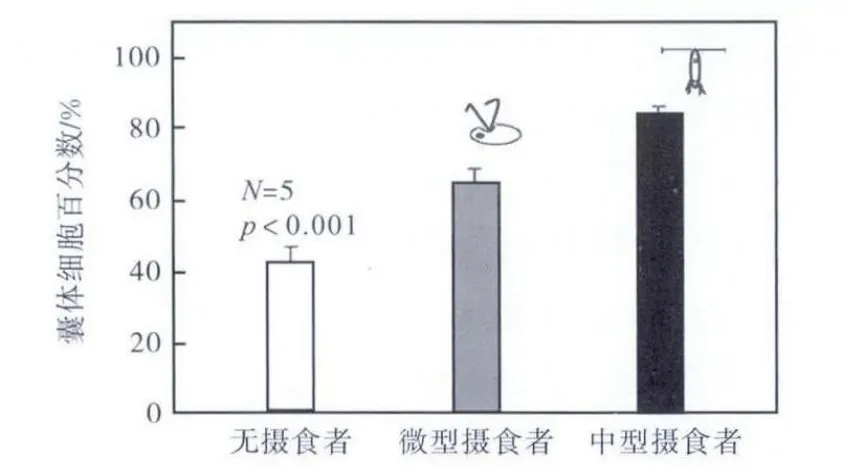
图3 不同摄食压力下囊体细胞叶绿素百分数Fig.3 Percentage of colonial chlorophyll a under grazing pressure
2.5 囊体细胞分布
将球形棕囊藻直径和囊体细胞线性回归,其斜率代表单位面积囊体细胞的密度.但是摄食压力并未有效改变囊体细胞分布,2 个摄食组中单位面积细胞密度同对照组无显著性差异(p>0.05),如图 4所示.
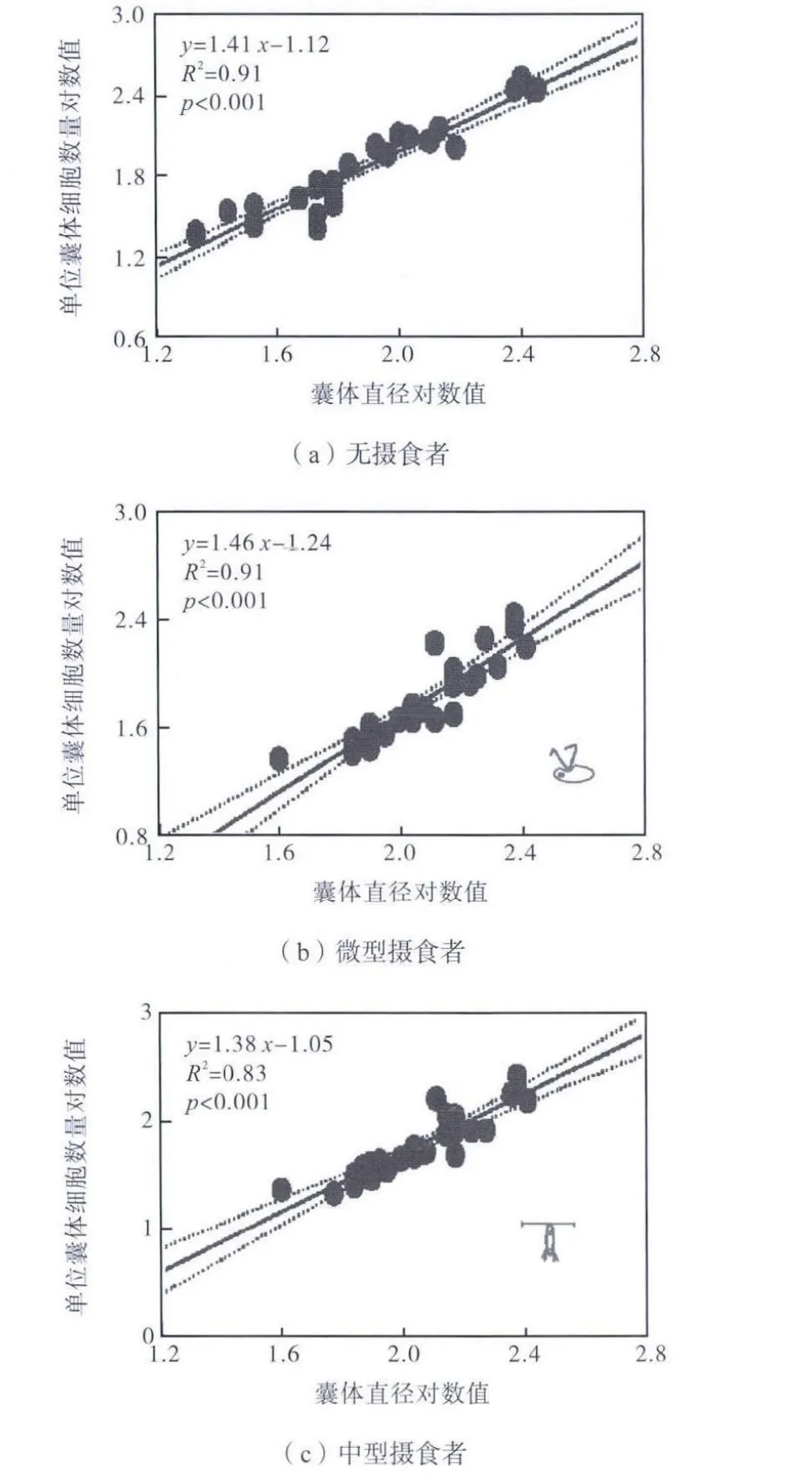
图4 不同摄食压力下单位囊体面积的细胞丰度Fig.4 Cell concentration per unit colony surface under grazing pressure
3 讨 论
由于培养体系中每天更新 f/2 培养液,因此滤出液添加至实验组中并不会导致营养盐限制.尽管哲水蚤可能排泄氨氮[9],但是棕囊藻囊体的形成更加依赖于硝酸盐,因此滤出液中营养盐浓度和结构的微量变化并非导致棕囊藻囊体结构变化的主因[9],而摄食化学信息才是囊体形态变化的关键因素.浮游动物摄食和浮游植物抵御摄食过程并不需要两者的直接接触,浮游动物通过释放摄食波可在较远距离感受浮游植物细胞的存在,而浮游植物也可通过物理感受器感受浮游动物的运动或者化学感受器捕捉可溶性化学信息,从而做出逃逸、抵制和抗拒等行为[9,13].本次研究中,浮游动物的培养滤出液即引发了球形棕囊藻的生理抵抗行为,说明球形棕囊藻对于此类化学信息感觉敏锐.
研究结果表明:微型摄食者的摄食信息提高了囊体直径,中型浮游动物的摄食则导致棕囊藻囊体体积继续增大.Long 等[11]利用汤氏纺锤水蚤(Acartia tonsa)对球形棕囊藻CCMP 627 进行摄食,发现囊体比例和体积均下降.他们认为中型浮游动物优先选择摄食囊体,球形棕囊藻的生活史由囊体向单细胞转化有效降低了摄食死亡率.而 Tang[11]利用汤氏纺锤水蚤摄食球形棕囊藻 CCMP 1528,囊体体积和比例均提高,同本文的研究结果相同,同 Long 等[12]的结果相反.球形棕囊藻株系差异可能导致上述研究结果的不同.球形棕囊藻 CCMP 627 常常失去囊体的能力,即使形成囊体,其体积也在 500,µm 之下.而CCMP 1528 和本次研究采用的棕囊藻株系则始终保留着形成囊体的能力,且囊体直径经常达到 1,cm 以上.从而使得球形棕囊藻在面临中型浮游动物的摄食信息时具有提高囊体直径的空间.
球形棕囊藻囊体的形成和直径提高导致了摄食者和食物颗粒间的粒径不匹配,抑制了摄食者的摄食效率,保护了棕囊藻囊体细胞[13].当面临摄食压力时,球形棕囊藻能够迅速提高囊体的数量,并且提高囊体的体积以抵制摄食[9].本次研究结果同样清楚说明了球形棕囊藻的这一生理特点.当感受到摄食信息时,囊体的数量提高了约 50%,囊体直径甚至提高了约 3 倍,接近中华哲水蚤体长.球形棕囊藻的单细胞更多以囊体细胞的形态存在,其比例从40%提高到60%~80%.由于中华哲水蚤摄食范围在其体长的1/10~1/100 内[14],因此巨型囊体无法被中华哲水蚤摄食,而细胞直径只有 27,µm 的海洋弯曲甲藻更无法摄食囊体,从而同样降低了微型和中型摄食者的摄食压力.
尽管摄食压力有效提高了囊体的数量和体积,但是并未改变囊体的结构和细胞分布.即使摄食信息出现导致囊体体积快速的提高,囊体的细胞分布依然保持恒定,单位面积的细胞含量并未随囊体的提高而降低,囊体体积和细胞数量回归斜率的值保持 1.46左右,同历史研究的结果具有很强的可比性[9,12].球形棕囊藻囊体外被由一层致密坚韧的黏多糖组成[6],囊体形成需要占用细胞产生总碳量的 30%~40%,从而保持整个囊体结构和强度的稳定[7],因此囊体内细胞分布在一般条件不会有大幅度变化.只有当温度、营养盐或者光照等限制因素发生剧烈变化时,囊体细胞分布才会发生显著变化.当球形棕囊藻和南极棕囊藻(P. antarctica)的培养温度提高 4,℃时,单位面积的囊体细胞密度显著提高,使得棕囊藻囊体包含更多的细胞[12].相对于硝酸盐,铵盐和尿素为氮源时也显著降低了单位面积的囊体细胞数量[15].相对于上述物理或者化学因素,摄食等生物因素对于囊体结构的影响不显著.棕囊藻对摄食压力的响应可能属于长期进化过程中特点,保守型较强,因此在囊体提高过程中不需要耗费过多的能量,也不需要改变囊体结构,不仅保持了囊体的稳定性,而且有效降低了摄食死亡率.
浮游动物摄食和浮游植物抵御摄食过程并不需要两者的直接接触,浮游植物可以通过感受浮游动物释放的可溶性化学信息做出逃逸、抵制和抗拒等行为.本次研究中,浮游动物的培养滤出液即引发了球形棕囊藻的生理抵抗行为,说明球形棕囊藻对于此类化学信息感觉敏锐.同其他浮游植物不同,球形棕囊藻通过生活史转化将自身粒径从μm 提高到 cm,跨越了 7 个数量级,远远超过了微型浮游动物的粒径,甚至超过了中华哲水蚤的摄食粒径范围,导致几乎所有的浮游动物无法摄食,这可能解释了棕囊藻藻华发生现场浮游动物数量极低的原因.尽管 Long 等[11]认为球形棕囊藻根据摄食者的粒径可以调整囊体的体积,导致两者粒径的不匹配.但是比较而言巨大囊体能够抵御摄食者的范围更广,生态优势更加明显.再加上囊体外被严谨致密的结构,抑制了海洋细菌和病毒的感染,球形棕囊藻显著降低了死亡率.因此,囊体形成和生活史转化赋予了球形棕囊藻较优越的竞争优势,能够形成巨型囊体使我国球形棕囊藻的优势尤其显著,有助于其频繁导致大规模的藻华.
4 结 语
球形棕囊藻囊体形成是抵御浮游动物摄食的有效策略.球形棕囊藻能感受浮游动物释放的摄食化学信息,其有效地改变了棕囊藻的生活史转变过程.尽管有研究证明桡足类等中型浮游动物能够降低球形棕囊藻的囊体形成率和囊体体积,但是本文的研究证实:海洋弯曲甲藻等微型摄食者提高了球形棕囊藻的囊体数量和囊体直径,而中华哲水蚤释放的摄食信息诱导球形棕囊藻囊体直径持续提高,超过了中型浮游动物的摄食范围,从而有效降低了摄食死亡率.球形棕囊藻频繁形成大规模藻华的原因可能归因于其生活史转化和囊体形成所赋予的竞争优势.
[1]Lancelot C,Keller M D,Rousseau V,et al. Autoecology of the marine HaptophytePhaeocystis sp[J].Physiological Ecology of Harmful Algal Blooms,NATO ASI Series G:Ecological Sciences,1998,41:209-224.
[2]Schoemann V,Becquevort S,Stefels J,et al.Phaeocystisblooms in the global ocean and their controlling mechanisms:A review[J].Journal of Sea Research,2005,53(1/2):43-66.
[3]齐雨藻,沈萍萍,王 艳. 棕囊藻属(Phaeocystis)的分类与生活史(综述)[J]. 热带亚热带植物学报,2001,9(2):174-184.Qi Yuzao,Shen Pingping,Wang Yan. Taxonomy and lifecycle of genusPhaeocystis(Prymnesiphyceae)[J].Journal of Tropical and Subtropical Botany,2001,9(2):174-184(in Chinese).
[4]Chen Yueqin,Wang Ning,Zhang Peng,et al. Molecular evidence identifies bloom-formingPhaeocystis(Prymnesiophyta)from coastal waters of southeast China asPhaeocystis globosa[J].Biochemical Systematics and Ecology,2002,30(1):15-22.
[5]Rousseau V,Chréstiennot-Dinet M J,Jacobsen A,et al. The life cycle ofPhaeocystis:State of knowledge and presumptive role in ecology[J].Biogeochemical,2007,83(1/2/3):29-47.
[6]Van Rijssel M,Hamm C,Gieskes W W C.Phaeocystis globosa(Prymnesiophyceae) colonies : Hollow structures built with small amounts of polysaccharides[J].European Journal of Phycology,1997,32(2):185-192.
[7]Hamm C E,Simson D A,Merkel R,et al. Colonies ofPhaeocystis globosaare protected by a thin but tough skin[J].Marine Ecology Progress Series,1999,187:101-111.
[8]Brussaard C P D,Kuipers B,Veldhuise M J W. A mesocosm study ofPhaeocystis globosapopulation dynamics:I. Regulatory role of viruses in bloom control[J].Harmful Algae,2005,4(5):859-874.
[9]Jakobsen H H,Tang K W. Effects of protozoan grazing on colony formation inPhaeocystis globosa(Prymnesiophyceae)and the potential costs and benefits[J].Aquatic Microbial Ecology,2002,27(3):261-273.
[10]Tang K W. Grazing and colony size development inPhaeocystis globosa(Prymnesiophyceae):The role of a chemical signal[J].Journal of Plankton Research,2003,25(7):831-842.
[11]Long J D,Smalley G W,Barsby T,et al. Chemical cues induce consumer-specific defenses in a bloomforming marine phytoplankton [J].Proceedings of the National Academy of Science of the United States of America,2007,104(25):10512-10517.
[12]Wang Xiaodong,Tang K W,Wang Yan,et al. Temperature effects on growth,colony development and carbon partitioning in threePhaeocystisspecies [J].Aquatic Biology,2010,9(3):239-249.
[13]Nejstgaard J C,Tang K W,Steinke M,et al. Zooplankton grazing onPhaeocystis:A quantitative review and future challenges [J].Biogeochemistry,2007,83(1/2/3):147-172.
[14]王小冬,孙 军,刘东艳,等. 海洋中型浮游动物的选择性摄食对浮游植物群落的控制[J]. 海洋科学进展,2005,23(4):524-535.Wang Xiaodong,Sun Jun,Liu Dongyan,et al. Control of phytoplankton community by marine mesozooplankton selective grazing [J].Advances in Marine Science,2005,23(4):524-535(in Chinese).
[15]Wang Xiaodong,Wang Yan,Smith W O Jr. The role of nitrogen on the growth and colony development ofPhaeocystis globosa(Prymnesiophyceae) [J].European Journal of Phycology,2011,46(3):305-314.
——以“不同咖啡因饮料对水蚤心率的影响”为例

