去肾交感神经术对高血压大鼠左室肥厚及其炎症因子的影响
谭丽华,李小刚,郭运忠,唐晓鸿,杨 侃,蒋卫红
(1.中南大学湘雅三医院心内科,湖南长沙 410013;2.湖南省马王堆疗养院心内科,湖南长沙 410016)
左室肥厚是高血压导致的常见靶器官损害之一,交感神经系统活性亢进与免疫炎症反应在左室肥厚发生与发展中发挥了重要作用[1-2]。左室肥厚是预测心脑血管事件的独立危险因素[3],改善高血压预后的研究重点在于逆转左室肥厚。动物实验发现,阻断肾交感神经对慢性交感神经过度激活引起的器官特异性损伤有积极作用[4-5],Krum 等[6]在经皮导管肾动脉射频消融治疗顽固性高血压患者的随访研究中发现,患者在术后血压下降的同时伴随左室质量的减轻,提示去肾交感神经治疗可能延缓或逆转高血压靶器官损害,但其机制尚不清楚。本研究通过对自发性高血压大鼠(spontaneously hypertensive rats,SHR)行去肾交感神经术,观察其手术前后血压、左室质量指数(left ventricular mass index,LVMI)及心肌局部Toll样受体 4(Toll-like receptor 4,TLR4)、核转录因子 κB(nuclear transcription factor κB,NF-κB)、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)及白细胞介素-6(inter leukin-6,IL-6)的变化,以探讨去肾交感神经术逆转左室肥厚作用的可能机制。
1 材料与方法
1.1 动物和试剂 SHR大鼠36只,同批同周龄WKY大鼠12只,体重240~280 g,由北京维通利华实验动物技术有限公司提供。兔抗鼠TLR4单克隆抗体和兔抗鼠NF-κB P65单克隆抗体均购自美国SantaCruz公司;兔抗鼠TNF-α多克隆抗体和兔抗鼠IL-6多克隆抗体则购自武汉博士德生物工程有限公司;山羊抗兔IgG购自美国Proteintech公司。
1.2 分组及处理 将36只SHR大鼠随机分为SHR对照组、手术组和假手术组,每组12只;另取12只同批同周龄WKY大鼠作为WKY对照组。WKY对照组与SHR对照组、手术组与假手术组组间心率、体重差异无统计学意义(P>0.05)。各组同条件喂养到12周龄时处死SHR对照组及WKY对照组大鼠,手术组及假手术组大鼠分别给予去肾交感神经术及假手术处理后于术后1周、6周分批(每批各组6只)处死,均留取心脏组织标本。
1.3 去肾交感神经术 腹腔内注射水合氯醛25mg/kg麻醉大鼠,沿腹白线,剪毛,消毒铺巾,切开皮肤,逐层分离皮下组织及肌肉,暴露出肾脏,见输尿管及包在鞘内的动、静脉及神经,剥离动静脉鞘,在解剖显微镜(×25)下找出所有肾神经,切断,并用棉球蘸溶于95%乙醇的10%苯酚溶液涂抹动静脉周围;假手术组仅开腹,保留肾交感神经仅用生理盐水涂抹;随后逐层缝合伤口,待大鼠自主苏醒,术后第3天腹腔注射青霉素预防感染。
1.4 检测指标及方法
1.4.1 血压测量 应用大鼠尾动脉无创血压测量仪测量,室温下,将安静状态大鼠置于固定装置,将尾动脉无创血压测量仪的尾部气囊套入鼠尾近心端,脉搏换能器套入气囊装置内,并缓慢加热至39℃使鼠尾血管充分扩张,另一端通过生理四通道信号采集仪连于电脑,待电脑收集信号稳定后,充气加压,直到脉搏信号成为一条直线,然后逐渐放气减压,待脉搏信号出现规则波形时,电脑读出血压值,每只大鼠每3分钟测1次,重复3次取均值。
1.4.2 LVMI计算 各组大鼠处死后留取心脏,沿房室交界处分离大血管、左右心房及右心室,用预冷的PBS液充分冲洗,滤纸吸干水份,称量左心室(包括室间隔)的湿重,以左室重量与体重之比计算LVMI。
1.4.3 心肌组织 TLR4、TNF-α 及 IL-6 含量检测 SABC法常规进行免疫组化染色:心肌组织常规石蜡包埋,5 μm厚度切片,常规脱蜡至水;滴加3%过氧化氢用以封阻内源性过氧化物酶;置于pH 6.0的0.01 mmol/L柠檬酸盐缓冲液80℃水浴(TNF-α或IL-6则需用95℃水浴修复)热修复20 min;PBS浸洗后滴加动物血清封阻,室温下孵育2h;滴加 TLR4或 TNF-α或IL-6一抗(均为1:100稀释)湿盒中常温孵育过夜;PBS浸洗后滴加二抗湿盒中孵育2 h;滴加辣根过氧化物酶标记链酶卵白素孵育2 h;DAB显色,PBS终止,脱水透明、封片。
1.4.4 心肌组织 TLR4、NF-κB、TNF-α 及 IL-6蛋白表达水平检测 在检测TLR4、TNF-α及IL-6时,取各组大鼠心肌组织匀浆后用RIPA组织细胞裂解液裂解,提取细胞总蛋白;检测NF-κB时,用核蛋白提取试剂盒提取各组心肌细胞核蛋白,之后上述4个指标均利用SDS-聚丙烯酰胺凝胶(SDS-PAGE)进行蛋白质分离,电转至PVDF膜,用TBST配制的5%脱脂奶粉封闭1 h后进行一抗孵育,在封闭液中按1∶1000加入一抗(对应的参照物均为β-actin),缓慢摇动4℃过夜,弃去一抗,TBS洗膜,加用封闭液稀释HRP标记的二抗(Proteintech,稀释比例1∶3000),缓慢摇动 45 ~60 min,TBS 洗膜后ECL显色曝光,显影定影,拍照观察胶片上的条带,并分别用 Quantity One软件分析 TLR4/βactin、NF-κB/β-actin、TNF-α/β-actin、IL-6/βactin的灰度比值。
1.5 统计学处理 应用SPSS 16.0统计软件进行数据分析。实验结果以表示,多个样本均数的比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠收缩压、舒张压及LVMI的变化SHR对照组收缩压、舒张压及LVMI较 WKY对照组显著升高(P<0.05)。肾交感神经切除术1周后,手术组大鼠收缩压、舒张压、LVMI较SHR对照组及假手术组明显降低(P<0.05);手术后6周,手术组大鼠收缩压、舒张压与SHR对照组及假手术组差异无统计学意义(P>0.05);但LVMI仍较假手术组降低(P<0.05),见表1。
2.2 各组心肌组织TLR4、TNF-α和IL-6表达变化 TLR4阳性表达主要位于心肌细胞胞膜及胞浆,呈棕黄色颗粒,在12周龄SHR大鼠心肌中即出现较多TLR4的阳性表达,1周假手术组TLR4阳性表达与SHR对照组相近,而去肾交感神经术后1周手术组及6周手术组TLR4表达则均较相应周龄的假手术组明显减少;TNF-α及IL-6阳性表达主要位于胞浆,其在各组中的表达均与TLR4一致,见图1。
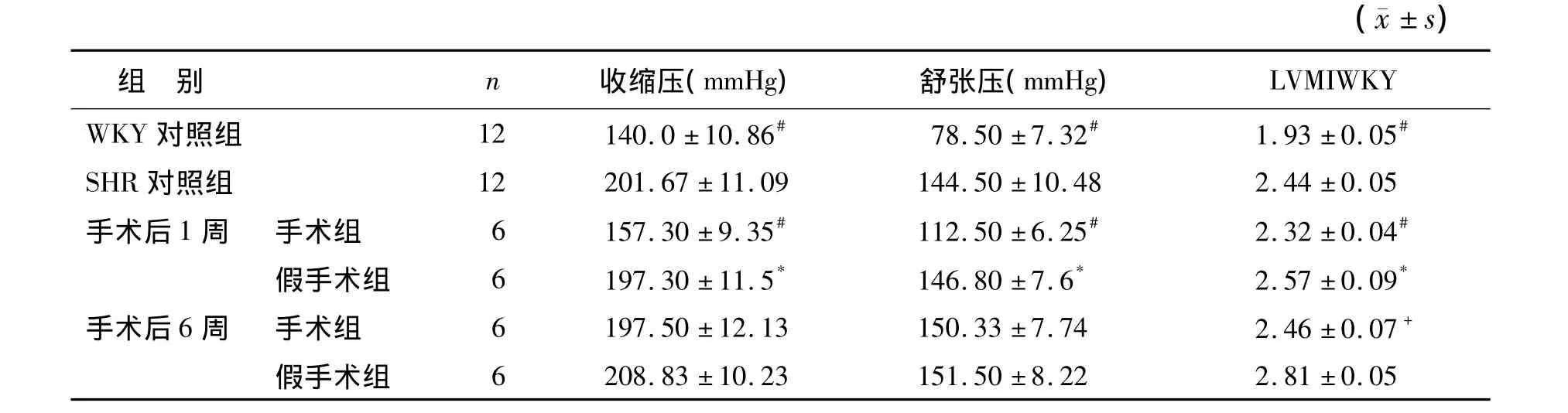
表1 各组大鼠收缩压、舒张压及LVMI的变化Table 1 SBP,DBP and LVMI of SHR from each group
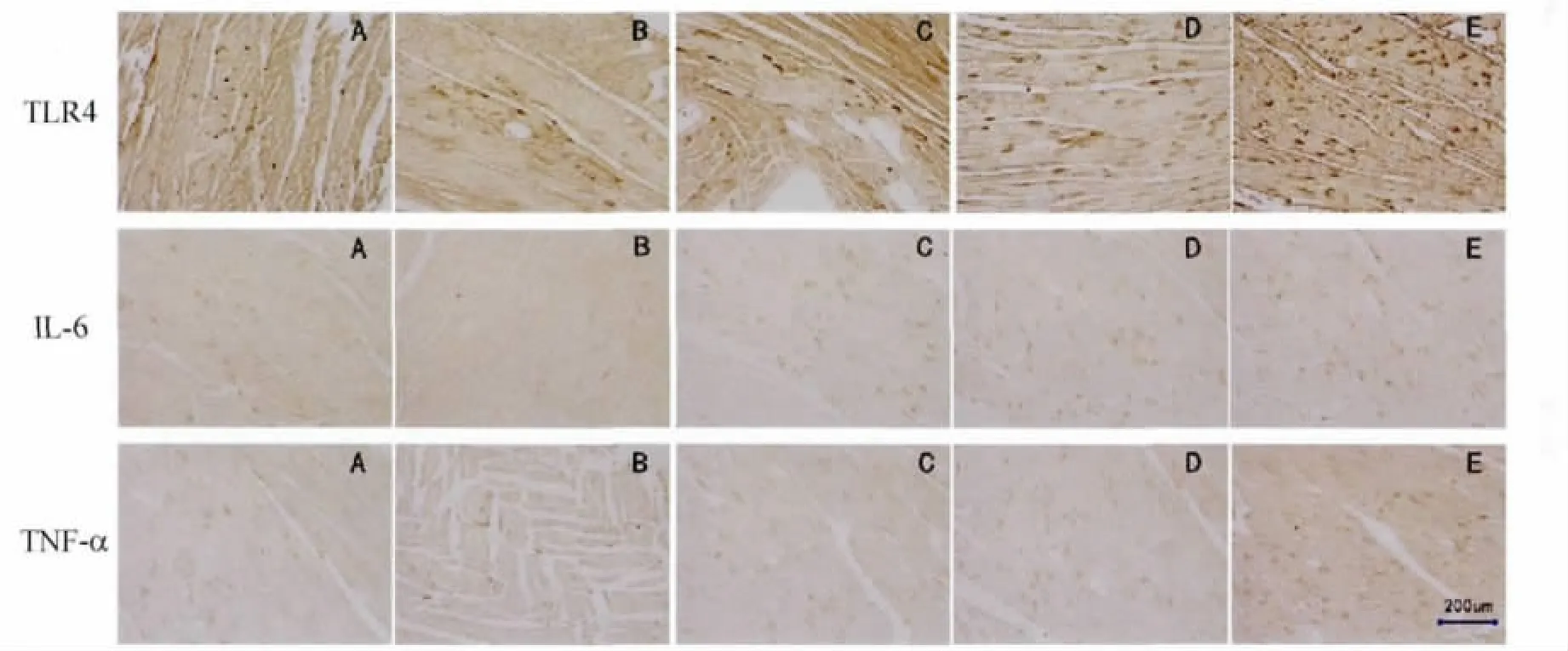
图1 各组心肌组织TLR4、IL-6、TNF-α免疫组化检测结果Fig.1 The myocardial expression of TLR4,IL-6,TNF-α in each group by immunohistochemical method
半定量检测结果显示,SHR组心肌TLR4、NF-κB、TNF-α 和IL-6的蛋白表达较WKY 对照组均升高(P<0.05);术后1周SHR上述指标较SHR对照及假手术组降低(P<0.05);6周后,SHR 心肌 TLR4、NF-κB、TNF-α、IL-6 蛋白表达仍低于假手术组(P<0.05),见表2、图2。
3 讨论
肾交感神经系统慢性激活在高血压及其靶器官损害的发生发展中起着重要作用,动物实验表明,肾交感神经阻断后可延缓高血压的发生或降低血压[7]。近年,去肾交感神经治疗已经成为高血压及其他慢性交感活性亢进疾病如心力衰竭、高血压合并糖耐量异常及慢性肾功能不全等的研究热点[8-10]。Krum 等[6]发现,该治疗方式不仅能有效降低血压,对高血压左室肥厚也有积极的影响,但其机制尚未阐明。本研究通过对SHR大鼠行去肾交感神经术,术后1周发现SHR大鼠血压及LVMI较假手术组均显著降低,考虑此时压力负荷的减轻可能是影响LVMI重要因素;然而在术后6周时手术组大鼠血压回升,考虑可能与肾交感神经存在部分再生有关,我们后续有关“肾胺酶在肾交感神经对自发性高血压大鼠降压机制的探讨”的实验结果支持这个假设;而LVMI仍明显低于假手术组,由此我们推测术后6周大鼠LVMI的改变可能还存在另外的影响因素。

表2 各组大鼠心肌组织TLR4、NF-κB、TNF-α和IL-6蛋白表达的半定量分析Table 2 The protein expression of TLR4,NF-κB,TNF-α,IL-6 detected by Western blot

图2 各组大鼠心肌组织 TLR4、NF-κB、TNF-α和IL-6蛋白表达Fig.2 The protein expression of TLR4,NF-κB,TNF-α,IL-6 detected by Western blot
许多研究认为高血压左室肥厚是一种低度慢性炎症过程[11-12],免疫炎症机制在高血压左室肥厚的发生发展过程中发挥了重要作用。目前研究认为TLR4及其介导的NF-κB信号途径与高血压左室肥厚的发生发展关系密切,它通过激活心肌中的原发免疫机制和炎症反应,参与了左室肥厚的形成和发展[13-15]。本研究发现12周龄SHR与同周龄WKY大鼠比较,已形成了高血压,并出现了明显的左室肥厚,且SHR随着高血压发病时间的延长,左室肥厚加重,同时伴有心肌 TLR4、NF-κB、TNF-α、IL-6 等免疫炎症因子表达的增加,证实了免疫-炎症反应确实参与了SHR左室肥厚的发展。既往有研究发现神经系统与免疫炎症反应之间存在相互作用关系[16-17],理论上认为通过抑制交感神经系统活性可引起免疫炎症反应作用的减弱,从而达到改善左室肥厚的作用。本研究我们发现去肾交感神经术后LVMI降低,而心肌局部炎症因子 TLR4、NF-κB、TNF-α、IL-6 也呈降低趋势,推测术后左室肥厚的改善可能与心肌局部免疫炎症水平的改变有关。故结合以往实验的结果我们认为去肾交感神经术减轻SHR左室肥厚的作用除与压力负荷的减轻有关外,可能也与心肌局部免疫炎症通路作用的抑制有关。
综上所述,由于交感神经系统和免疫炎症均参与了高血压左室肥厚的发生发展,且两者之间相互影响,共同促进了左室肥厚的进展,去肾交感神经治疗通过作用于上述两种机制而对高血压及其靶器官损害产生积极的影响,对改善高血压患者的预后具有重要意义。但由于存在肾交感神经再生或全身交感系统参与的反馈调节,该疗法的长期安全性及有效性亟需更多循证医学的证据证实。
[1]DORN G W II.The fuzzy logic of physiological cardiac hypertrophy [J].Hypertension,2007,49(5):962-970.
[2]SALLES G F,FISZMAN R,CARDOSO C R,et al.Relation of left ventricular hypertrophy with systemic inflammation and endothelial damage in resistant hypertension[J].Hypertension,2007,50(4):723-728.
[3]BOMBELLI M,FACCHETTI R,CARUGO S,et al.Left ventricular hypertrophy increases cardiovascular risk independently of in-office and out-ofoffice blood pressure values[J].J Hypertens,2009,27(12):2458-2464.
[4]DIBONA G F.Neural control of the kidney:past,present,and future [J].Hypertension,2003,41(3 Pt 2):621-624.
[5]DIBONA G F.Physiologyinperspective:The Wisdom of the body.Neural control of the kidney[J].Am J Physiol Regul Integr Comp Physiol,2005,289(3):R633-R641.
[6]KRUM H,SCHLAICH M,WHITBOURN R,et al.Catheter-based renal sympathetic denervation for resistanthypertension a multicentre safety and proof-of-principle cohort study [J].Lancet,2009,373(9671):1275-1281.
[7]WEINSTOCK M,GORODETSKY E,KALMAN R.Renal denervation prevents sodium retention and hypertension in salt-sensitive rabbits with genetic baroreflex impairment[J].Clin Sci(Lond),1996,90(4):287-293.
[8]KIMURA G,FUKUTA H.Catheter-based renal sympathetic denervation for treatment of hypertension [J].Nippon Naika Gakkai Zasshi,2011,100(2):441-445.
[9]MAHFOUD F,SCHLAICH M,KINDERMANN I,et al.Effectofrenalsympathetic denervation on glucose metabolism in patients with resistant hypertension:a pilot study[J].Circulation,2011,123(18):1940-1946.
[10]PROCHNAU D,LAUTEN A,BUSCH M,et al.Catheter-based radiofrequency ablation therapy of the renalsympathetic-nerve system for drug resistant hypertension in a patient with end-stage renal disease[J].Int J Cardiol,2011,5(12):234-239.
[11]KUWAHARA F,KAI H,TOKUDA K,et al.Hypertensive myocardialfibrosisand diastolic dysfunction.Another model of inflammation?[J].Hypertension,2004,43(4):739-745.
[12]TSIOUFIS C,STOUGIANNOS P,KAKKAVAS A,etal.Relation ofleftventricularconcentric remodeling to levels of C-reactive protein and serum amyloid A in patients with essential hypertension[J].Am J Cardiol,2005,96(2):252-256.
[13]FRANTZ S,KOBZIK L,KIM Y D,et al.Toll 4(TLR4)expression in cardiac myocytes in normal and failing myocardium [J].J Clin Invest,1999,104(3):271-280.
[14]ZHANG D,GAUSSIN V,TAFFET G E,et al.TAK1 is activated in the myocardium after pressure overload and is sufficient to provoke heart failure in transgenic mice[J].Nat Med,2000,6(5):556-563.
[15]PURCELL N H,MOLKENTIN J D.Is nuclear factor-κB an attractive therapeutic targetfor treating cardiac hypertrophy [J].Circulation,2003,108(6):638-640.
[16]CHROUSOS G P.The stress response and immune function:Clinical implications[J].Ann NY Acad Sci,2000,917:38-47.
[17]LEVICK S P,MURRAY D B,JANICKI J S,et al.Sympathetic nervous system modulation of inflammation and remodeling in the hypertensive heart[J].Hypertension,2010,55(2):270-276.

