幽门螺杆菌脂多糖对胃粘膜shh信号通路相关蛋白Gli、Ptch-1表达的影响
张 军,张国新,陈菲菲,何邦顺,叶 峰,潘晓林
(1.南京医科大学附属南京医院消化科,南京市第一医院消化科,江苏南京 210006;2.南京医科大学第一附属医院消化科,江苏南京 210029)
幽门螺杆菌(Helicobacter pylori,Hp)定植于人体胃黏膜表面,其感染与胃十二指肠疾病的发生密切相关[1]。Hp脂多糖是Hp的致病因子之一,在Hp感染相关的疾病中起重要作用。胃上皮细胞完整性的破坏大多数是通过Hp表面脂多糖减弱粘膜细胞和细胞外基质蛋白间的相互作用而发生的[2]。Sonic Hedgehog(Shh)信号通路在维持成熟组织的内环境稳定,慢性炎症的组织修复和癌症发生等多种进程中发挥着重要作用[3]。Nishizawa 等[4]发现,当Hp感染形成胃黏膜慢性炎症或萎缩时,Shh表达下降;早期根除Hp,Shh表达可恢复正常。Lee等[5]研究发现,伴 Hp感染的胃癌中,Shh表达明显上升。可见,Hp感染对Shh信号通路的表达有影响作用,但是目前Hp与Shh信号通路之间相互作用的具体机制尚未明确。本研究旨在通过体外细胞实验,选择Hp的毒力因子脂多糖作为刺激因子,观察脂多糖刺激后Shh信号通路中相关蛋白Gli、Ptch-1的表达情况,从而探讨Hp脂多糖对该信号通路的作用。
1 材料与方法
1.1 实验材料 人胃黏膜上皮细胞株GES-1由南京市第一医院中心实验室提供并保存。Hp菌株26695由江苏省人民医院馈赠。鲎试剂购于厦门市鲎试剂实验厂。Gli、Ptch-1抗体均购自cell signal公司,噻唑蓝(MTT)购自美国Sigma公司。
1.2 Hp培养 在微需氧环境中,37℃培养,厌氧孵箱内放置少量的水以保持湿度,气体交换使箱内气体氧气、二氧化碳、氮气的质量分数分别为5%、10%、85%。将菌种(Hp26695)接种于哥伦比亚培养基(加入10%的脱纤维羊血),逐日观察培养基中细菌菌落的特征及显微镜下细菌的形态特点。培养72h后观察菌落呈无色半透明,针尖样大小,并经快速尿素酶试验判定阳性,提示培养的细菌为Hp。
1.3 Hp脂多糖的制备 参考Luo[6]的热酚水法提取出Hp脂多糖,经动态比浊法证实为内毒素,并且测得其浓度为1.062×105EU/ml(1 ng=2.5 EU),即最后提取出Hp脂多糖浓度为42.48μg/ml。
1.4 GES-1细胞培养和分组 常规复苏GES-1细胞后,使用高糖DMEM培养基(含10%胎牛血清,pH 7.4),于含 50 ml/l二氧化碳的37℃、饱和湿度的恒温细胞培养箱内培养,约48 h换液一次,细胞生长至覆盖约70% ~80%培养瓶底面时按1∶3比例传代。预实验除用无Hp脂多糖刺激的GES-1细胞做阴性对照外,分别用 Hp 脂多糖浓度 0.5μg/ml、1μg/ml、5μg/ml刺激GES-1细胞,采用Western Blot法检测Shh信号通路中Ptch-1蛋白的表达情况,发现Hp脂多糖浓度为1μg/ml时Ptch-1蛋白开始较阴性对照组表达降低,考虑Hp脂多糖浓度为1μg/ml为最低有效刺激浓度。在此预实验基础上,本实验分6组,分别为阴性对照组、脂多糖 1μg/ml干预组、10μg/ml干预组、20μg/ml干预组、30μg/ml干预组、40μg/ml干预组。实验时取对数生长期细胞。
1.5 MTT法检测细胞增殖 将处于对数生长期的细胞,用胰蛋白酶消化后,450×g离心5 min,收集细胞沉淀,往细胞沉淀中加入高糖DMEM培养基制成细胞悬液,以每孔2×105个细胞加入96孔培养板中,每孔体积200μl,培养24 h,使细胞同步化后分别加入不同浓度Hp脂多糖,同时设不加脂多糖的阴性对照组以及只加入培养基、MTT、二甲基亚砜而无GES-1细胞的调零孔。培养24 h后,加入5%MTT 10μl,继续培养4 h后每孔加入150μl二甲基亚砜(DMSO),室温震荡10 min溶解。每组设5个复孔,重复3次,以490 nm为测定波长,用酶标仪检测吸光度值,计算细胞生长抑制率。细胞生长抑制率=(阴性对照孔吸光度值-加Hp脂多糖孔吸光度值)/(阴性对照组吸光度值)×100%。
1.6 Western Blot法检测 Gli、Ptch-1 蛋白水平取对数生长期的细胞,接种于6孔板,分别加3 ml不同浓度脂多糖,培养24 h后加入蛋白裂解液,得到全蛋白提取物,Bradford法进行蛋白浓度测定。提取的蛋白样品与蛋白上样缓冲液混合后,煮沸5 min。进行 SDS-PAGE凝胶电泳、转膜,用5%脱脂牛奶封闭1 h后,分别加入一抗,4℃过夜。TBST洗4次后加入辣根过氧化物酶标记的二抗,室温作用2 h,再次用TBST洗膜,然后使用ECL法显色,GIS凝胶图像分析系统照相并分析处理。上述反应以β-actin作为内参照,结果用Alphalmager TM 2200图像分析系统对胶片扫描并进行平均灰度值(average density values,ADV)测定,以 ADV Gli、Ptch-1/ADV β-actin的比值作为各组产物相对表达值。
1.7 统计学分析 采用SPSS 11.5统计学软件进行数据处理及分析,多组样本均数间比较采用单因素方差分析;变量间相关分析用Person相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Hp脂多糖对GES-1细胞增殖的影响 在倒置相差显微镜下可以观察到,经Hp脂多糖刺激后细胞形态变圆,分布变稀疏,高浓度组甚至可见到细胞崩解后的碎片、颗粒等;而阴性对照组GES-1细胞贴壁良好,轮廓清晰。不同浓度Hp脂多糖刺激组的细胞增殖抑制均较阴性对照组增强(均P<0.05),见图1。并且随着Hp脂多糖浓度增加,其对GES-1细胞增殖抑制越强,两者呈正相关(r=0.985,P <0.001),见图2。提示Hp脂多糖可以抑制GES-1细胞生长。
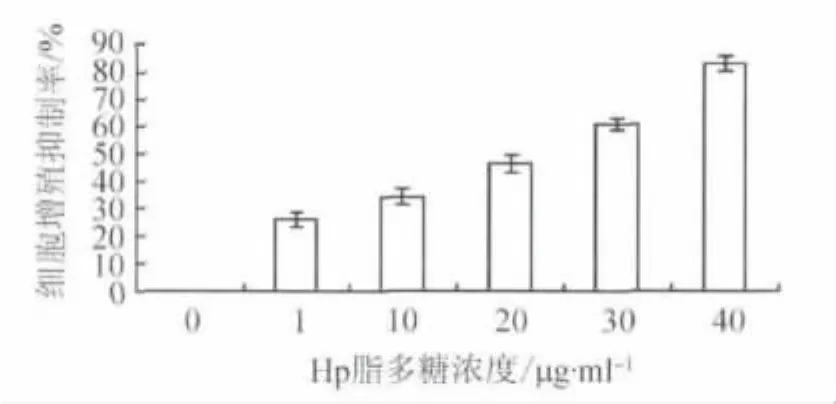
图1 不同浓度Hp脂多糖对GES-1细胞增殖的影响Fig.1 The effectsofHp-LPS with different concentrations on GES-1 cell growth

图2 Hp脂多糖浓度与GES-1细胞增殖抑制的相关性分析Fig.2 The relation between the concentrations of Hp-LPS and the inhibition rates of GES-1 cell growth
2.2 Hp脂多糖对GES-1细胞Shh信号通路相关蛋白Gli、Ptch-1表达的影响 图3为Hp脂多糖干预各组Gli、Ptch-1蛋白表达的Western Blot结果。表1、图4为蛋白 Gli/β-actin、Ptch-1/β-actin比值分析数据及柱状图。结果显示不同浓度Hp脂多糖Gli、Ptch-1蛋白的相对表达较阴性对照组均降低(均P<0.05)。将Hp脂多糖浓度与Gli蛋白相对表达值进行相关性分析,结果两者呈负相关(r=-0.945,P<0.001);将Hp脂多糖浓度与Ptch-1蛋白相对表达值进行相关性分析,两者也呈负相关(r=-0.985,P <0.001),说明随着 Hp 脂多糖浓度的升高,GES-1细胞中Shh信号通路相关蛋白Ptch-1、Gli的表达量逐渐减少,见图5。
3 讨论
研究发现,Hp感染后首先是引起慢性炎症,进而发生胃黏膜萎缩、肠上皮化生、不典型增生、最终导致癌变[7-8]。然而,Hp确切的致病机制至今还不是很清楚。
Hp的致病因子分两类:一类是定植因子,如鞭毛、适应性的酶和蛋白等;另一类是毒力因子,它能使机体产生炎症和免疫反应,最终导致一系列疾病的形成。脂多糖是Hp的毒力因子之一,在Hp感染及Hp相关疾病中起重要作用。Hp脂多糖能介导多种细胞因子和趋化因子的释放,从而介导免疫反应的发生[9-10]。

图3 Western Blot法检测GES-1细胞中Gli、Ptch-1蛋白表达结果Fig.3 The expression of Gli and Ptch-1 proteins in GES-1 cells detected by Western Blot

表1 不同浓度Hp脂多糖作用下GES-1细胞中 Gli/β-actin、Ptch-1/β-actin 比值比较Table 1 The comparison of Gli protein/β-actin and Ptch-1 protein/β-actin ratios in GES-1 cells after treatment of Hp-LPS with different concentrations
Shh信号通路是调节昆虫和脊椎动物胚胎发育的经典通路之一。主要由分泌型信号蛋白Shh配体、跨膜蛋白受体Ptch(Ptch1、Ptch2)和另一跨膜蛋白Smo以及下游转录因子Gli蛋白(Gli1、Gli2、Gli3)组成[11]。一般认为在缺乏Shh配体信号的刺激下,Ptch与Smo结合,Ptch抑制Smo的活性,此时该信号通路处于失活状态;而当Shh配体存在时,Shh配体与跨膜蛋白受体Ptch结合后,解除了Ptch对Smo的抑制,Smo进入胞质中,引发细胞内信号的下传,激活转录因子Gli,Gli以全长的形式进入细胞核内,启动靶基因的转录,将细胞外的Shh信号传递到细胞内,从而调控细胞的生长发育[12]。

Suzuki等[13]研究发现,蒙古沙鼠在 Hp 感染51周后,Shh基因的表达明显下降,而且该基因的表达与壁细胞的丢失及腺颈部细胞的分化受阻呈正相关。在Hp感染阳性患者中,Shh表达亦显著下调,而且该蛋白表达下调与萎缩及肠化病变严重程度之间存在显著正相关[14]。可见,Hp感染对Shh信号通路的表达有影响作用,但是目前Hp与Shh信号通路之间的具体作用机制尚未明确,其通过何种毒力因子造成Shh信号通路中相关成员的表达发生变化仍然不确定。Piotrowski等[15]观察了从 Hp中提取的脂多糖对胃上皮细胞的影响,发现脂多糖能够引起胃粘膜上皮细胞凋亡的显著增加,且凋亡指数与胃炎的严重程度及脂多糖的剂量有关。而本次实验MTT结果提示Hp脂多糖可以抑制GES-1细胞活性,且随着Hp脂多糖浓度增加,其抑制能力增强,这与Piotrowski等的研究结果一致,但其机制尚不明确。脂多糖对巨噬细胞及胃粘膜细胞有强大的激活作用,释放多种炎性细胞因子。研究显示Hp脂多糖能激活NF-κB,从而引起多种细胞因子合成和释放[16]。Kim 等[17]在人胃癌细胞株(AGS)中用一种特殊的抑制剂抑制NF-κB的激活,结果发现Shh的表达也受到抑制。Yang等[18]研究证实,在肺小血管上皮细胞中细菌脂多糖能影响Shh信号通路的表达。这些研究均提示Hp脂多糖可能是通过NF-κB等因子影响Shh信号通路表达。
因此本研究选择Hp脂多糖作为刺激因子,探讨Hp脂多糖与Shh信号通路之间的关系。本实验证实用不同浓度的Hp脂多糖刺激GES-1细胞后,Shh信号通路中相关蛋白Gli与Ptch-1的表达均较阴性对照组明显降低,且随着Hp脂多糖浓度的增加,其对Shh信号通路相关蛋白Gli、Ptch-1的抑制能力增强。本研究提示Hp感染后可能通过脂多糖抑制了Shh信号通路,从而对细胞产生损伤,并导致细胞的增殖抑制;随着Hp脂多糖浓度增加,Shh信号通路相关成员表达逐渐降低,GES-1细胞损伤逐渐加重。我们推测可能是随着Hp脂多糖浓度增加,更多Shh信号通路相关蛋白的表达被抑制,细胞损伤随之加重。
近年来很多研究显示Shh信号通路与消化道肿瘤如胃癌关系也十分密切[14,19]。WHO 已将Hp定为胃癌的第一类致癌因子,因此有必要进一步在胃癌细胞中观察Hp脂多糖对Shh信号通路的影响。此外本研究主要通过体外细胞实验观察到Hp脂多糖能影响Shh信号通路相关蛋白的表达,在此基础上可进行动物实验,以探讨体内环境下Hp脂多糖与Shh信号通路两者的相互关系。
[1]HILDRETH C J,LYNM C,GLASSR M.Helicobacter pylori[J].JAMA,2008,300(11):1374.
[2]SLOMIANY A.Sucralfate Counteracts the Inhibition of Gasteic Mucosal Ucin Recptor by H.Pylori Lipopolysaccaride [J].Scand J Fastroenterol,1995,210(30):77-81.
[3]KATOH Y,KATOH M.Hedgehog signaling pathway and gastrointestinal stem cell signaling network[J].Int J Mol Med,2006,18(6):1019-1023.
[4]NISHIZAWA T,SUZUKI H,NAKAGAWA I,et al.Early Helicobacter pylori eradication restores sonic hedgehog expression in the gastric mucosa of Mongolian gerbils[J].Digestion,2009,79(2):99-108.
[5]LEE K M,LEE J S,JUNG H S,et al.Late reactivation of sonic hedgehog by Helicobacter pylori results in population of gastric epithelial cells that are resistant to apoptosis:implication for gastric carcinogenesis[J].Cancer Lett,2010,187(1):44-53.
[6]LUO Yi-hui,YAN Jie,MAO Ya-fei.Helicobacter pylori lipopolysaccharide:Biological activities in vitro and in vivo,pathological correlation to human chronic gastritis and peptic ulcer[J].World J Gastroenterol,2004,10(14):2055-2059.
[7]DIXON M F.Prospects for intervention in gastric carcinogenesis:reversibility of gastric atrophy and intestinal metaplasia[J].Gut,2001,49(1):2-4.
[8]MEINING A,MORGNER A,MIEHLKE S,et al.Atrophy-metaplasia-dysplasia-carcinoma sequence in the stomach:a reality or merely an hypothesis?[J].Best Pract Res Cli Gastroenterol,2001,15(6):983-998.
[9]BHATTACHARYYA A,PATHAK S,DATTA S,et al.Mitogen-activated protein kinases and nuclear factor-kappa B regulate Helicobacter pylori-mediated interleukin-8 release from macrophages [J].Biochem J,2002,368(Pt 1):121-129.
[10]INNOCENTI M, SVENNERHOLM A M,QUIDING-JÄRBRINK M.Helicobacter pylori lipopolysaccharides preferentially induce CXC chemokine production in human monocytes[J].Infect Immun,2001,69(6):3800-3808.
[11]HUANGFU D,ANDERSON KV.Signaling from Smo to Ci/Gli:conser 2 vation and divergence of Hedgehog pathways from Drosophila to vertebrates[J].Development,2006,133(1):3-14.
[12]MARTIN J,DONNELLY JM,HOUGHTON J,et al.The Role of sonic hedgehog reemergence during gastric cancer[J].Dig Dis Sci,2010,55(6):1516-1524.
[13]SUZUKI H,MINEGISHI Y,NOMOTO Y,et al.Down-regulation of a morphogen(sonic hedgehog)gradient in the gastric.epithelium of Helicobacter pylori-infected Mongolian gerbils [J].J Pathol,2005,206(2):186-197.
[14]MA X L,SUN H J,WANG Y S,et al.Study of Sonic hedgehog signaling pathway related molecules in gastric carcinoma [J].World J Gastroenterol,2006,12(25):3965-3969.
[15]PIOTROWSKI J,PZOTROWSKI E,SKRODZAK D,et al.Induction of acute gastritis and epithelial apoptosis by Helicobacter pyloric lipopoly saccharide [J].Scand J Gustroenterol,1997,32:203-211.
[16]SMITH MF J R,MITCHELL A,LI G,et al.Tolllike Receptor(TLR)2 and TLR5,but Not TLR4,are required for Helicobacter pylori-induced NF-kappaB activation and chemokine expression by epithelial cells[J].J Biol Chem,2003,278(35):32552-32560.
[17]KIM J H,CHOI Y J,LEE S H,et al.Effect of Helicobacter pylori infection on the sonic hedgehog signaling pathyway in gastric cancer cell[J].Oncol Rep,2010,23(6):1523-1528.
[18]YANG Y,LI Q,DENG Z,et al.Protection from lipopolysaccharide-induced pulmonary microvascular endothelialcellinjury by activation of hedgehog signaling pathway[J].Mol Biol Rep,2011,38(6):3615-3622.
[19]LEE S Y,HAN H S,LEE K Y,et al.Sonic hedgehog expression in gastric cancer and gastric adenoma[J].Oncol Rep,2007,17(5):1051-1055.

