重型颅脑外伤局灶低温与全身低温疗效的对比研究
刘洪涛 马振芳 李国臣 于文娟
颅脑外伤是外界暴力直接或间接作用于头部所造成的损伤[1-2]。按损伤后脑组织是否与外界相通分为开放性和闭合性损伤。常见的脑外伤[3-4]有头皮裂伤、颅骨骨折、脑震荡、脑挫裂伤、颅内血肿等。受伤后有不同程度的头痛、呕吐、视乳头水肿及意识、思维、感觉、运动障碍。颅脑外伤病情复杂、变化快,易引起不良后果,部分患者需手术治疗。低温疗法是一种以物理方法将患者的体温降低到预期水平而达到治疗疾病目的的方法[5-6]。本文通过检测伤灶处以及与其相邻部位的脑组织内H2O、钠离子、钾离子的含量,并采用苏木素伊红染色[7](Hematoxylin and eosin staining)观察病理改变的相关程度,比较局灶低温治疗(Focal hypothermia therapy)与全身低温治疗(Systemic hypothermia treatment)两种方法的治疗效果,现报告如下。
1 资料与方法
1.1 一般资料 选取本院实验室提供的32只雄性SD大鼠(rat;rattus norregicus),重量 230~290 g,平均重量为 265.7 g。采用随机的方法将其分为全身低温组(A组)、假颅脑外伤模型组(B组)、局灶低温组(C组)以及颅脑外伤模型组(D组),每组8只,在伤后2 d收集标本。
1.2 方法 采用Feeney自由落体改良模型[8](free fall improved model)。对雄性SD大鼠行腹腔注射苯巴比妥钠[9](Sodium 5-ethyl-4)进行麻醉,将其俯卧固定,于头正中将皮肤切开并分离骨膜,使左侧顶骨得以暴露,再于矢状缝处开2.0~3.0 mm,于冠状缝后1~2 mm处钻半径约为2~3 mm的骨孔,使得硬脑膜得以显露,在其上方放置一垫片(与骨孔吻合即可)。将铁制圆柱体(重为50 g)从高为20 cm处放下行自由落体运动,造成脑组织挫裂伤。在雄性SD大鼠伤后25~35 min行降温治疗,局灶低温治疗是使用25 ℃的水降温,观察脑温监测仪随时调节水流速度;全身低温疗法是采用冰袋降温,冰袋放置于腹部,两组将受伤部位脑温降为32 ℃左右即可,同时保持这一脑温3 h,接着采用自然复温并将雄性SD大鼠消毒[10]。
1.3 脑组织H2O、钠离子、钾离子的含量测定 在伤后2 d收集标本,对雄性SD大鼠行腹腔注射苯巴比妥钠(Sodium 5-ethyl-4)进行麻醉,截取伤灶处以及与其相邻部位的大脑脑片,分别采用干湿法和原子吸光光谱法(Atomic Absorption Spectroscopy,AAS)测定H2O和钠离子、钾离子的含量。
1.4 统计学处理 应用SPSS 13.0统计软件分析数据,计量资料以(±s)表示,比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组受损神经元数比较 经检测发现,假颅脑外伤模型组受损神经元数为(2.2±0.4)个,全身低温组受损神经元数为(9.1±0.5)个,局灶低温组受损神经元数为(6.3±0.3)个,颅脑外伤模型组受损神经元数为(12.1±1.1)个;全身低温组和颅脑外伤模型组受损神经元数明显多于局灶低温组,差异具有统计学意义(P<0.01)。
2.2 各组脑组织H2O、钠离子、钾离子的含量比较 经检测发现,全身低温组和颅脑外伤模型组H2O、钠离子的含量显著高于局灶低温组,具有统计学意义(P<0.05),而钾离子的含量明显低于局灶低温组,具有统计学意义(P<0.01),见表1。
表1 各组脑组织H2O、钠离子、钾离子的含量比较(±s)
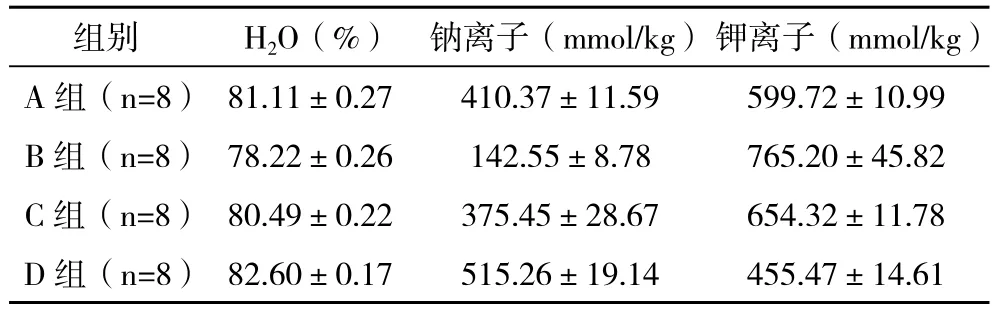
表1 各组脑组织H2O、钠离子、钾离子的含量比较(±s)
组别 H2O(%) 钠离子(mmol/kg)钾离子(mmol/kg)A组(n=8) 81.11±0.27 410.37±11.59 599.72±10.99 B组(n=8) 78.22±0.26 142.55±8.78 765.20±45.82 C组(n=8) 80.49±0.22 375.45±28.67 654.32±11.78 D组(n=8) 82.60±0.17 515.26±19.14 455.47±14.61
3 讨论
本次研究笔者就局灶低温疗法与全身低温疗法两种方法治疗重型颅脑外伤效果进行分析,结果表明,全身低温组和颅脑外伤模型组受损神经元数明显多于局灶低温组,具有统计学意义(P<0.01)。全身低温组和颅脑外伤模型组H2O、钠离子的含量显著高于局灶低温组,具有统计学意义(P<0.05),而钾离子的含量明显低于局灶低温组,具有统计学意义(P<0.01)。因此,笔者认为,局灶低温治疗相比较全身低温治疗在减少神经元损伤以及缓解脑水肿等方面具有明显优势,同时可以改善继发性脑损伤,提高患者的生活质量,值得临床借鉴使用。
[1]Matsushita Y,Bramlett H M,Alonso O,et al. Posttraumatic hypothermia is neuroprotective in a model of traumatic brain injury complicated by a secondary hypoxic insult[J].Crit Care Med,2011,29(11):2060-2066.
[2]江基尧,朱诚.亚低温与颅脑创伤临床研究进展[J].第二军医大学学报,2001,22(8):787-789.
[3]彭慕兰,王曙红,拉多夫斯基,等.亚低温脑复苏硬膜外压缩对犬模型脑损伤的影响[J].中华神经外科杂志,1993,79(2):241-251.
[4]Hashiguchi N,Shiozaki T,Ogura H,et al.Mild hypothermia reduces expression of heat shock protein 60 in leukocytes from severely headinjured patients[J].J Trauma,2003,55(6):1054-1060.
[5]魏晨斌,魏德,任红第.亚低温综合治疗42例重型颅脑外伤临床观察[J].福建医药杂志,2000,22(6):64.
[6]黎会,谭源福.弥漫性轴索损伤动物模型的现状及研究进展[J].微创医学,2001,24(1):55-58.
[7]陈锡群,龚孝淑,江基尧.低温对实验型颅脑损伤大鼠免疫功能的影响[J].中华神经外科杂志,2001,17(3):168.
[8]邓其峻,吴敏,王国福.亚低温治疗急性重型颅脑损伤的临床研究[J].中国急救医学,2000,20(7):416.
[9]刘莉,张光毅.低温保护缺血性脑损伤机制研究进展[J].国外医学:脑血管疾病分册,1998,6(6):329-332.
[10]王清波,谢波,谢沛建,等.细孔钻颅脑室外引流术的临床应用体会[J].中华神经外科杂志,2011,27(4):350.

