肺结核患者合并乙肝病毒感染与发生药物性肝炎关系的队列研究
许光辉 陈志宇 甄志斌 蒙是升 汤志强 黄广军
肺结核和慢性乙型肝炎在我国是严重危害人民健康的常见病和多发病。化疗方案中异烟肼(H)、利福平(R)、吡嗪酰胺(Z)是目前杀灭结核菌最强的药物,但在联合应用时容易发生药物性肝损伤,在合并慢性乙肝(HBV)的肺结核患者中,由于本身肝脏存在炎症坏死,肝损伤就更加严重,据研究报告发生率达50%左右或更高[1-4]。关于结核病患者的肝损害研究多数为回顾性分析,不能获得病因关系。因此,笔者使用队列分析的研究方法对本所治疗的结核患者进行了追踪分析,现报告如下。
1 资料与方法
1.1 一般资料 选择2009年10月1日-2012年2月1日在本所进行抗结核治疗的初治结核患者,年龄14~65岁,治疗前肝功能正常,并排除乙肝病毒外的其他病毒性肝炎感染和HIV感染。肺结核诊断标准参照2001年中华医学会的肺结核诊断和治疗指南。暴露因素为合并慢性乙肝病毒感染。暴露组人群为在研究人群内乙肝表面抗原阳性的肺结核患者,共计87例。对照人群:采取内对照随机1:1配对原则进行选取,共计87例(匹配因素为性别相同;年龄相差3岁以内,开始抗结核治疗时间相差不超过1周)。
1.2 实施方法
1.2.1 所有患者使用治疗方案 2HRZE(S)/4HR;间歇或每日疗法,药物剂量按指南规定使用。
1.2.2 在治疗前调查一般人口学特征 包括年龄、性别、职业、户籍、民族,并告知患者坚持治疗。治疗前均进行痰抗酸杆菌、肝功能、肝炎病毒标志物、HIV抗体、胸部X线等检查。治疗过程中强化期每2周复查一次肝功能,巩固期每一月复查一次,并同时询问患者是否出现恶心呕吐、乏力、纳差、厌油厌食、腹痛腹泻腹胀、发热皮疹关节痛、黄疸。当出现相关症状或其他不适时及时就诊并增加检查次数。
1.2.3 观察终点及终点事件 发生抗结核药物诱导的药物性肝炎;完成6个月的观察时间。
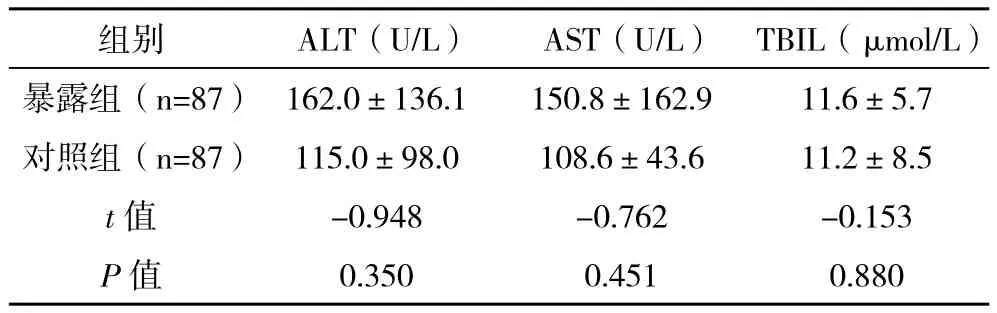
1.3 抗结核药物诱导肝炎诊断标准 药物性肝炎诊断标准[5-6]:治疗前肝功能正常;药物使用标准剂量;有或无肝炎症状;治疗后丙氨酸氨基转移酶(ALT)和/或天门冬酸氨基转移酶(AST)超过正常上限2倍,伴或不伴有血清总胆红素(TBIL)异常(正常上限:ALT:37 IU/L;AST:40 IU/L;TBIL:22.0 μmol/L);停药后肝功能正常或明显好转。排除发生其他原因引起的肝损伤。重度药物性肝炎:5 ULN≤ALT/AST或ULN 1.4 质量控制 1.4.1 对研究人群的患者进行准确的试验前检查避免部分患者不能进入试验,降低选择偏倚。详细告知和主动电话随访要求患者规则回访是本实验的关键。 1.4.2 由研究者本人进行每一次的对照组的随机匹配。参与研究人员为科研和临床经验丰富的医生。由本人对随访内容进行详细讲解,并制作成表,保证了对研究内容的正确和统一理解,减少信息偏倚,回收表时,由本人进行及时核查,发现错填、漏填情况时,随时更改或再次电话联系进行补充,确保调查信息的完整性和正确性。 1.4.3 实验室检查均在本单位进行,使用统一的仪器和标准,而且本单位实验室检测具有较好的质量控制。 1.4.4 数据录入时使用Epi-data 3.1软件建立数据库,资料由本人统一录入,并通过设计程序控制对录入的数据进行逻辑纠错;每录入一份调查表即进行核对,及时发现错误并纠正。 1.5 统计学处理 采用Epi-data建立数据库,所有资料经检查、核对后由本人统一录入计算机。所有数据采用SPSS 11.0软件包进行统计分析,正态连续型资料以(±s)表示,离散型资料用率或构成比描述,比较采用 字2检验,多组均数比较采用方差分析,均数两两比较采用LSD-t检验,检验水准α=0.05。 2.1 一般情况 入选暴露组病例87例,失访5例,失访率5.7%。男67例,女20例,男女性别比例为3.4:1,平均年龄(35.6±12.9)岁。对照组87例,平均年龄(35.8±12.2)岁。两组人群在户口地、民族、职业构成、痰抗酸杆菌、结核病影像严重程度方面差异无统计学意义(P>0.05)。详见表1。 表1 两组人群一般特点比较 2.2 抗结核药物诱导药物性肝炎的发病率 2.2.1 暴露组中26例患者发生药物性肝炎,发病率为29.9%,由于有失访,经校正后发病率为30.8%。对照组中9例发生患者发生药物性肝炎,发病率为10.3%,校正后发病率为10.7%。暴露组发生抗结核药物诱导肝炎的发病率高于对照组,差异有统计学意义( 字2=10.336,P=0.001)。相对危险度RR为2.9 ( 字2=10.28),95%的置信区间是(1.51,5.55),表明乙肝病毒感染与肺结核患者发生药物性肝炎之间存在关联。归因危险度AR为20.1,归因危险度百分比AR%为65.3%。但两组在发生重度肝炎和发生需要改变抗结核治疗方案的患者方面差异无统计学意义(P>0.05)。详见表2。 表2 两组发生重度肝炎和需要改变抗结核治疗方案方面比较 2.2.2 两组发生药物性肝炎时的转氨酶水平 慢性乙肝组的患者发生药物性肝炎时转氨酶水平均高于对照组,但差异无统计学意义(P>0.05)。详见表3 表3 两组患者发生药物性肝炎时的肝功能指标比较(±s) 表3 两组患者发生药物性肝炎时的肝功能指标比较(±s) 组别 ALT(U/L) AST(U/L) TBIL(μmol/L)暴露组(n=87) 162.0±136.1 150.8±162.9 11.6±5.7对照组(n=87) 115.0±98.0 108.6±43.6 11.2±8.5 t值 -0.948 -0.762 -0.153 P值 0.350 0.451 0.880 我国是世界结核病高负担国家,又是乙肝大国,两者合并感染率达13%[7]。标准的短程化疗方案是治疗结核病的基石,联合应用常常发生药物性肝炎。有学者认为抗结核药物是发展中国家诱发肝损害甚至急性肝衰竭最重要的原因,合并HBV会导致更容易发生肝损伤[8-10]。 多数学者认为,HBV感染者其肝功能指标即使在正常范围,但肝细胞均有不同程度炎性改变及少量肝细胞的点状坏死[11],当肝脏有病理改变时,肝血流灌注障碍,肝血流量减少,其解毒、排泄功能及储备和再生能力下降。同时肝病时药物与血浆白蛋白结合能力下降,药物的半衰期延长,游离药物浓度增高,增加了药物的肝脏毒性,而且双重感染患者的肝损害在病理上也比单一感染严重[12]。由于HRZ均具有潜在的肝毒性,那么在有基础肝病的患者中,各种进入肝脏的药物会加剧肝代谢负担,导致肝损害加重而发病。 在抗结核治疗过程中慢性乙肝患者是否更容易发生药物性肝损害仍然存在较大争议。De Castro等[13]的前瞻性研究发现肺结核患者合并HBV感染虽然表现出一定的发生药物性肝损伤危险度,但无统计学意义。国内陈志飞等[14]发现合并乙肝的患者更容易发生中重度肝损害,而在药物性肝炎发生率方面和无乙肝的结核病患者无统计学意义的差异。 笔者的研究使用前瞻性队列研究,可以获得发病率,同时使用了随机配对的原则选取对照,在入组时匹配了年龄、性别,而且两组人群在一般人口学特征和疾病本身特点方面的基线数据均无明显差异,进一步避免了多个混杂因素对病因的干扰。研究结果发现合并慢性乙肝的肺结核患者药物性肝炎发病率为30.8%,是对照组的2.9倍,明显高于乙肝表面抗原阴性的患者。同时笔者的研究发现,发生药物性肝炎时,合并慢性乙肝组的转氨酶的水平高于无乙肝的患者,但并无统计学差异。笔者的研究中药物性肝炎发病率偏低的原因:一是多数研究采用回顾性分析,二是采用的肝炎判定标准不同,三是入选病例基础肝功能状况及肝炎病毒载量构成不同。但是不同的研究均表明,乙肝病毒感染是发生药物性肝损害的危险因素[1-2,4,9,15]。 笔者的结果显示,两组发生重度肝炎与需要调整药物的差异方面无统计学意义,表明乙肝患者使用标准的治疗方案是可行的,与国内研究结果相似[14]。而且即使发生药物性肝炎后,可以使用双环醇、还原型谷胱甘肽、甘草酸制剂等来保护肝脏,必要时可以采用利福喷汀、喹诺酮类、氨基糖苷类等低肝毒性药物来保证治疗的持续性[3,14]。因此,提示在对待基础肝功能正常的慢性乙肝肺结核患者,制定抗结核治疗方案时仍应该坚持首选一线抗结核药物的原则,不能由于过度片面地担心肝炎的发生而导致不合理、不够强力的治疗措施,影响治疗效果,更会增加病患的经济负担。 通过本研究笔者发现,乙肝病毒感染是肺结核患者抗结核治疗过程中发生药物性肝炎的病因之一。对于肺结核患者抗结核治疗前进行乙肝标志物和肝功能的检验,以及在抗结核治疗期间严密监测,必要时联合护肝治疗是具有重要意义的。 [1]潘朝霞,段爱玲.HBV-M阳性肺结核患者抗结核治疗肝功能损害临床分析[J].中国防痨杂志,2009,31(7):413-414. [2]黄丽华,耿文奎,张静,等.781例初治肺结核患者抗结核组合药物间歇疗法肝损害的调查[J].中华流行病学杂志,2009,30(3):286-289 [3]蒋瑞华,许家琏.抗结核化疗对乙肝病毒标志物阳性者肝功能损害及对策[J].临床肺科杂志,2005,10(1):42-44. [4]潘越峻,张春兰,范慧敏,等.合并慢性乙型肝炎对抗痨治疗肺结核患者疗效的影响[J].实用肝脏病杂志,2008,11(3):171-173. [5]Dssing M,Wilcke J T R,Askgaard D S, et al.Liver injury during antituberculosis treatment :an 11-year study[J].Tubercle and Lung Disease,1996,77(4):335-340. [6]郭英江,崔德健.抗结核药所致肝损害[J].中华结核和呼吸杂志,1998,21(5):308-309. [7]李飞跃,申辉,杨华林,等.涂阳肺结核合并乙型肝炎流行病学分析[J].实用预防医学,2010,17(2):280-281. [8]Devarbhavi H.Antituberculous drug-induced liver injury: current perspective[J].Trop Gastroenterol,2011,32(3):167-174 [9]Huang L H, Geng W K, Zhang J,et al.Study on liver damage caused by anti-TB drug intermittent treatment on patients with HBV-TB coinfection[J].Zhonghua Liu Xing Bing Xue Za Zhi,2009,30(3):286-9 [10]李仁龙,刘靖元,马翔,等.抗结核化疗对乙型肝炎病毒阳性肺结核病人的肝功能影响[J].中国防痨杂志,2006,28(增刊):26-27. [11]Byoung Hoon Lee,Won-Jung Koh, Moon Seok Choi,et al. Inactive Hepatitis B Surface Antigen Carrier State and Hepatotoxicity During Antituberculosis Chemotherapy[J].Chest,2005,127(4):1304-1311. [12]许伟华,车晓文,姚桂芹,等.乙型肝炎病毒合并结核菌感染时的肝功能变化[J].中华传染病杂志,2002,20(2):116-117. [13]De Castro L,Do Brasil P E, Monteiro T P, et al.Can hepatitis B virus infection predict tuberculosis treatment liver toxicity? Development of a preliminary prediction rule[J]. Int J Tuberc Lung Dis,2010,14(3):332-340. [14]陈志飞,韩丹,孙学智.乙肝表面抗原携带状态结核患者抗结核治疗对肝损害的影响分析[J].中国防痨杂志,2007,29(4):343-345. [15]许光辉,陈维清,陈华,等.抗结核药物诱导肝损伤的影响因素探讨[J].药物流行病学杂志,2008,17(6):377-380.2 结果


3 讨论

