临床试验中生存分析的非劣效研究设计及R软件实现*
哈尔滨医科大学卫生统计教研室(150081) 吴 莹 侯 艳 李 康
近年,非劣效性临床试验在药品开发中已有广泛的应用,统计学上关于试验药物相对于阳性对照药物的非劣效性评价方法已有多种,但主要集中在终点指标为二分类或正态连续型数据的临床试验〔1〕。当观察指标为生存时间(survival time)时,可能包含截尾数据(censored data),则缺少相应的非劣效性评价方法,主要原因是生存分析设计背景下非劣效性的定义较为困难〔2〕。本文拟介绍一种基于生存时间指数分布模型,假设对照组死亡风险率λ0与试验组死亡风险率λ1之比为常数ρ,并在此基础上定义非劣效界值的分析方法,结合实例介绍其试验设计和统计检验方法,同时给出R软件实现程序。
非劣效界值的确定
假设研究计划用T年时间纳入病例,每位病例入组后均进行βρ年的随访观察,则基于指数分布的生存分析模型需作以下假定〔3〕:
(1)单位时间内患者的入组人数服从泊松分布,年入组率记为A人/年;
(2)病例从入组到发生失效事件(failure event)所经历的时间(生存时间)服从指数分布,其中阳性对照组的中位数记为M0,试验组的记为M1,则相应的死亡风险率(hazard rate)为 λi=(ln2)/Mi,i=0,1。
(3)病例从入组到失访,即产生截尾值(censored value)所经历的时间相互独立并服从指数分布,其中阳性对照组的失访率记为φ0,试验组的记为φ1。
为叙述简单,本文假定时间单位为年,在实际应用中可选择任意合适的时间单位。现令ρ=λ0/λ1=M1/M0,由于中位生存时间越长表示疗效越好,可将非劣效界值定义为ρ1(ρ1≤1),它代表临床上可接受的试验药疗效逊于阳性对照药的程度〔4〕。
假设检验与统计推断
针对上述非劣效界值ρ1,假设检验形式为

设第i(i=0,1)组病例观察到的失效事件数为Di,总的观察时间为Ti(暴露人年数),则λi的极大似然估计为^=Di/Ti。令,Bristol〔5〕提出统计量

近似服从标准正态分布,当 Z≥Z1-α时拒绝 H0,Z1-α为标准正态分布的1-α分位数,S(λ0,λ1)为lnρ的标准差估计值,即

检验效能与入组时间
生存分析的非劣效性检验在设计时一般不直接估计样本含量,而是根据平均年入组人数估计达到一定检验效能所需入组时间T,或者直接估计所需阳性事件数。下面给出基于入组时间的检验效能函数

ρ=ρ1时表示 H0成立,power=α;ρ=ρ2>ρ1时,(3)式表示正确接受H1的概率即检验效能。受疾病发病率及试验设计等因素影响,不同生存分析研究的单位时间内入组人数A不同,因此其样本含量大小取决于纳入患者的时间长度,即入组时间T,当要求检验效能达到1-β 时,Bristol〔5〕提出所需入组时间 T应满足
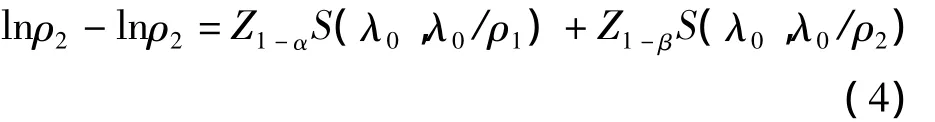
其中Z1-α和 Z1-β分别代表标准正态分布 1- α、1-β 的分位数,S(λ0,λ0/ρ1)和 S(λ0,λ0/ρ2)分别代表(2)式中 λ1= λ0/ρ1和 λ1= λ0/ρ2的情况。按上述理论方法编写的R软件实现程序见附录,输入不同参数设置值即可返回不同情况下所需入组时间。
实 例
欲考察某一新型放疗方法与传统疗法相比,对非小细胞肺癌患者的治疗效果是否具有非劣效性,主要指标为5年生存率,查阅相关文献及数据,假定阳性对照组中位生存时间为2.78年,当检验水准α=0.05,检验效能1-β=80%或90%时,根据本文方法,表1给出当非劣效界值 ρ1=0.8或0.9,失访率 φ0=φ1=0.06或0.01,H成立时两组死亡风险率之比ρ2=1.0或1.25,年入组人数A=20、30、40或50时所需入组时间T。

表1 不同试验条件下所需入组时间(T)
由表1可以看出,非劣效界值ρ1定义越大或者检验效能1-β要求越高,所需入组时间越长,而试验组相对疗效ρ2越高,年入组人数A越多或者失访率φ越低,所需入组T时间则越短,这与理论推导结果一致。在应用时研究者可以结合临床实际选择合适的参数配置进行试验。
小结与讨论
本文介绍了一种基于生存时间指数分布模型的非劣效性试验设计及统计推断方法。在介绍Bristol方法原理的基础上,结合实例探讨了如何计算试验入组时间以达到预计检验效能,并给出了R软件实现程序。实例结果表明,在其他条件一致的基础上,生存时间数据的非劣效设计所需入组时间与检验效能、非劣效性界值、年入组率及失访率有关。Bristol方法适用于生存分析中包含截尾值的非劣效研究的临床试验设计和统计分析。
基于指数分布模型的生存时间数据统计分析方法,提供了在安慰剂对照面临医学伦理问题,或阳性对照药物虽疗效略好于试验药,但在不良反应、药物成本等其他方面存在劣势时〔6〕,非劣效性设计的评价方法。对于同类型的试验设计,Stallard〔7〕等人亦提出了基于Weibull分布的参数评价方法,但其抽样方案仅限于动物致癌性数据,不适合应用于临床试验。此外,亦有学者提出了利用生存时间顺序统计量的非参数评价方法〔8-9〕,与本文介绍的参数方法相比,虽然损失了一定的样本信息,但适用于任意数据分布形式,因此在实际应用中需具体考察数据分布特征,选择合适的分析方法。



1.Freitag G.Methods for assessing noninferiority with censored data.Biometrical Journal,2005,47(1):88-98.
2.Fleming TR.Current issues in non-inferiority trials.Statistics in Medicine,2008,27:317-332.
3.Rubinstein LV,Gail MH,Santner TJ.Planning the duration of a comparative clinical trial with loss to follow-up and a period of continued observation.J Chron Dis,34:469-479.
4.Com-Nougue C,Rodary C,Patte C.How to establish equivalence when data are censored:a randomized trial of treatments for n non-hodgkin lymphoma.Statistics in Medicine,1993,12:1353-1364.
5.Bristol DR.Planning survival studies to compare a treatment to an active control.Journal of Biopharmaceutical Statistics,1993,3(2):153-158.
6.D'Agostino SRB.Non-inferiority trials:advances in concepts and methodology.Statistics in Medicine,2003,22:165-167.
7.Stallard N,Whitehead A.An alternative approach to the analysis of animal carcinogenicity studies.Regulatory Toxicology and Pharmacology,1996,23:244-248.
8.Freitag G,Lange S,Munk A.Non-parametric assessment of non-inferiority with censored data.Statistics in Medicine,2006,25:1201-1217.
9.Tangen CM,Koch GG.Non-parametric covariance methods for incidence density analyses of time-to-event data from a randomized clinical trial and their complementary roles to proportional hazards regression.Statistics in Medicine,2000,19:1039-1058.

