造纸废水微生物絮凝剂菌株的分离鉴定及特性
邹 娟,姚 蓉,黄 悦,刘胜贵
(怀化学院生命科学系,湖南怀化418000)
絮凝剂广泛用于水处理、食品加工业、化工和冶金等行业[1-3],能使浑浊液中的微细粒子凝聚,形成絮状团块而沉降,达到彼此分离的目的。目前广泛使用的絮凝剂有无机絮凝剂和有机高分子絮凝剂。无机絮凝剂中应用最普遍的有铝盐和铁盐絮凝剂,铝盐类絮凝剂处理水中残留高浓度Al3+,能引起铝中毒,表现为铝性脑病、铝性骨病和铝性贫血症等,其中老年性痴呆症是铝性脑病的一种[4];铁盐类絮凝剂对设备腐蚀性强,能腐蚀混凝土,且出水的残余铁含量易超标[5]。合成的高分子絮凝剂以聚丙烯酸胺类应用最广,具用量少、絮凝活性高、稳定性好以及成泥量少等优点,但是聚丙烯酞胺的单体具很强的神经毒性和“三致效应”(致畸、致癌、致突变)[6]。目前,美国、日本和欧洲等国对聚丙烯酰胺的使用剂量和应用范围进行了严格的限制。在传统絮凝剂对环境造成二次污染等问题日益显著的情况下,绿色环保型的新型絮凝剂成为了国内外研究和开发的热点。
微生物絮凝剂是由菌体产生或分泌的一类生物大分子物质,具絮凝性能好,可使混合液中难沉降的固体悬浮颗粒凝聚和沉淀[7-8]。与传统的无机絮凝剂和有机高分子絮凝剂相比,微生物絮凝剂具有高效、无毒、可生物降解性和无二次污染等优点,因而引起社会广泛关注,已成为国内外研究和开发的热点[9-11]。目前中国对高碱性造纸废水具絮凝潜能的微生物絮凝剂鲜有报道,筛选出适合造纸废水处理的微生物絮凝剂产生菌是处理高碱性造纸废水的关键技术之一。本研究从造纸废水处理厂的卡鲁赛尔(Carrousel)氧化沟的污泥中分离出具有絮凝性能的菌株,其分泌物在高碱性条件下,具有良好的絮凝活性,并对其进行了生理生化试验、16SrDNA基因序列分析以及絮凝活性研究,为进一步的应用研究打下了理论基础。
1 材料与方法
1.1 材料
采自造纸废水处理厂卡鲁赛尔(Carrousel)氧化沟中的活性污泥样品。
富集培养基(1000 mL):牛肉膏3.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,琼脂20 g/L,pH 值7.0 ~7.2。
筛选培养基:葡萄糖 20.0 g/L,尿素 0.5 g/L,(NH4)2SO40.2 g/L,K2HPO45.0 g/L,NaCl 3.0 g/L,MgSO4·7H2O 0.2 g/L,酵母膏 0.5 g/L,pH 值 7.0 ~7.2。
1.2 菌种分离与筛选
将活性污泥10倍梯度稀释,取10-2~10-6浓度梯度涂布于富集培养基平板上,30℃倒置培养2 d。观察富集培养基上微生物的生长情况,挑取表面光滑且湿润粘稠的单菌落作为目的菌种,在筛选培养基平板上划线分离纯化,并进行斜面菌种保藏。将分离到的菌株分别接种于5 mL液体筛选培养基,30℃、160 r/min摇床培养48 h,6000 r/min离心,取上清液测絮凝活性,筛选出絮凝活性较高的菌株[12-13]。
1.3 絮凝活性的测定
量取95 mL 5 g/L高岭土悬液于100 mL烧杯中,加入5.0 mL 1%(W/V)CaCl2溶液搅匀,再加入0.2 mL发酵上清液,先120 r/min搅拌3 min、60 r/min搅拌1 min,使其混合均匀,然后静置5 min,吸取50 mL处上清于550 nm测定吸光值。以不加发酵上清液的浊液吸光值为对照,絮凝活性的计算公式如下[14]:
絮凝活性=(A-B)/A×100%
式中:A为对照组550 nm处的吸光度;
B为样品组550 nm处的吸光度。
1.4 菌株的鉴定
菌落和菌体形态观察:菌株于LB平板培养基上30℃培养48 h,观察菌落形态;菌株于 LB培养基上30℃,培养24 h,进行革兰氏染色和芽胞染色,显微镜下观察菌体形态、大小、芽胞形状和着生部位。
菌株生理生化试验:参照周德平等[15]的试验方法。
对该菌的16S rRNA进行PCR扩增,目的片段为1500 bp左右,采用TAKARA公司生产的ExTaq聚合酶,扩增引物序列如下:
P1:5'-AGAGTTTGATCCPATGGCTCAG-3');
P2:5'GGTTACCTTGTTACGACTT3'
PCR 反应体系(50 μL):DNA 模板1 μL,正向引物和反向引物各 1 μL,Taq DNA 聚合酶 0.3 μL,dNTP 4 μL,10 ×PCR 缓冲液 5 μL,MgCl24 μL,最后用无菌超纯水补足反应体系。
PCR反应条件:94℃变性5 min;55℃退火1 min;72℃延伸1.5 min,30个循环;72℃延伸10 min;10℃维持。
将PCR产物进行1.0%琼脂糖凝胶电泳,EB染色15 min,通过凝胶成像分析系统显影。切胶回收PCR产物,测序工作由金思特科技(南京)有限公司完成。将测序结果与NCBI数据库中微生物16S rRNA序列进行BLAST比对,以确定菌种分类。
1.5 絮凝剂成份提取与分析
发酵液4℃,8000 r/min离心20 min取出上清液4℃预冷,加入2倍体积预冷的丙酮,轻摇,4℃放置24 h。收集沉淀后用蒸馏水洗涤后得到絮凝剂粗品,溶解于去离子水中,蒸馏水透析24 h,冷冻干燥,称重。配置成1 g/L絮凝剂溶液备用。以葡萄糖为标准液,通过蒽酮-硫酸法测定絮凝剂中总糖含量;以牛血清蛋白为标准液,测定絮凝剂中蛋白含量[6]。
2 结果与分析
2.1 絮凝剂产生菌的分离与鉴定
图1 菌株B-6的菌落形态Fig 1 The colonial morphology of strain B-6
2.1.1 菌株B-6的群体培养特征 从造纸废水Carrousel氧化沟的活性污泥样品中筛选并挑取了37株菌,其中具有絮凝活性的有8株,再经复筛和传代培养,通过测定絮凝率,得到1株具有稳定性和絮凝活性高的菌株,编号B-6。在LB琼脂平板上,该菌菌落不规则,中央隆起,米白色,边缘整齐、半透明,表面光滑湿润,较粘,不易挑起,不分泌色素(见图1)。
2.1.2 菌株B-6的个体形态特征 培养24 h的菌体呈柱状,大小为1.4 μm ×2.5 μm,革兰氏染色结果阳性,芽胞中生(见图2)。

图2 菌株B-6的显微摄影图(10×100)Fig 2 Microphotograph of strain B-6(10×100)
2.1.3 菌株B-6的生理生化特性 菌株B-6的部分生理生化试验结果见表1。

表1 菌株B-6的生理生化特征Table 1 Physiological and biochemical characteristics of strain B-6
2.1.4 菌株的16S rDNA序列分析与鉴定
通过PCR扩增,获得菌株B-6的16S rDNA序列,并与GeneBank中的相关菌株Blast比对,结果表明该菌株与Bacillus amyloliquefaciens多个菌株的序列相似性均为98%,其中与Bacillus amyloliquefaciens strain Dx-18的同源性最高,达到99%。参照第8版《伯杰氏细菌鉴定手册》,该菌株形态学特征和生理生化特征也与芽胞杆菌属相符合。综合菌株B-6的生理生化特征和16S rDNA序列比对分析结果,确定该菌株属Bacillus sp.。
2.2 菌株B-6的生长和絮凝剂分泌的关系
用液体筛选培养基培养菌株B-6,测得其生长曲线和离心后上清液对高岭土悬浊液的絮凝效果如图3所示。
从图3可知,菌株B-6在液体筛选培养基中呈现有规律的生长曲线,并对新环境的适应能力和繁殖速度强,生长周期短。上清液中的絮凝活性物是菌株B-6生长过程中产生并分泌到培养液中,随菌体的生长,上清液中的絮凝活性成分不断增加,絮凝活性逐渐升高,稳定期末期絮凝活性达到峰值(92.5%);培养36 h后,由于培养液中营养成分的消耗和有害物质的不断积累,菌株进入衰亡期,大量菌体代谢紊乱和裂解,培养液中的活性成分下降,导致上清液絮凝活性下降。
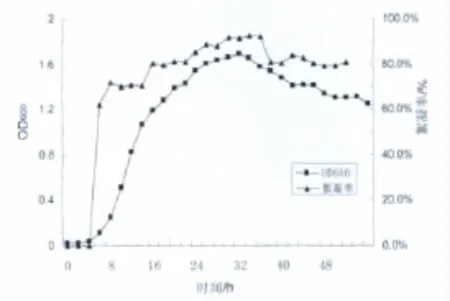
图3 菌株B-6生长及絮凝剂分泌曲线图Fig 3 Growth curve of strain B–6 and its bioflocculant production
2.3 pH值对絮凝性能的影响
pH值对絮凝剂絮凝性能的影响见图4。
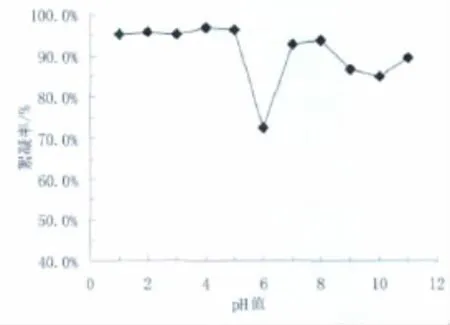
图4 pH值对絮凝剂絮凝性能的影响Fig 4 Effect of pH on flocculating activity
由图4可看出,菌株B-6分泌的絮凝性物质在较广的pH值范围内均具有较好的絮凝活性。pH值在1~5范围内时,上清液的絮凝效果较好,絮凝活性稳定在90%以上;pH值为6时,絮凝活性最低仅为72.5%;pH值在7~11之间时,絮凝活性维持在90%左右。从絮凝活性随pH值曲线可见,菌株B-6分泌的絮凝性物质在酸性和碱性条件下的絮凝活性高于其在中性pH值条件下的絮凝活性。絮凝剂在不同pH值下表现出不同的絮凝性能,是由于酸碱度的变化影响了生物聚合物的带电状态与电中和能力以及胶体颗粒表面的电荷。在合适的pH值范围内,胶体颗粒的表面电荷降低,使得颗粒之间的相互斥力减弱,从而有利于絮凝剂吸附到颗粒表面,促进颗粒之间的桥联作用,发生凝聚,从而从混合液中沉降分离出来。
2.4 上清液添加量对絮凝性能的影响
由图5可见,随上清液添加量的逐渐增加,絮凝活性上升:当上清液的添加量为0.8 mL时,絮凝率达到最高值95.4%,随后絮凝活性随添加量的进一步增大而下降,并且发现高岭土颗粒下沉变得缓慢,高岭土悬液的完全澄清所需的时间延长。这种现象是由于絮凝剂的过量添加,使絮凝剂包裹了高岭土颗粒,致使高岭土絮凝的结合位点被饱和,从而阻断了絮凝剂的桥联作用,阻碍以“高岭土-絮凝剂-高岭土”为单位的絮凝颗粒形成。

图5 絮凝菌液投加量对絮凝率的影响Fig 5 Effect of bioflocculant dosage on flocculating activity
2.5 絮凝剂成份提取与分析
测得葡萄糖标准曲线为:y=0.0077x+0.0153,R2=0.9993,根据待测液的A620平均值在标准曲线上查出葡萄糖的含量(μg),最终计算出样品中总糖含量为60.6%;测得牛血清蛋白的标准曲线为:y=0.0067x+0.043,R2=0.9994,根据标准曲线计算出样品中蛋白质含量为11.8%。由此看出该微生物所产絮凝剂的主要成分为多糖。
3 结论
从造纸废水Carrousel氧化沟的活性污泥样品中,通过随机筛选分离获得了絮凝效果较好且稳定的菌株B-6,结合该菌的生理生化特征和16S rDNA序列比对分析结果,可确定菌株B-6为Bacillus sp.。从菌株B-6的生长曲线和絮凝剂分泌试验,得知上清液中的絮凝性物质是菌株生长过程中形成并分泌到胞外,并且在稳定期末期絮凝活性达到峰值;该絮凝性物质在较宽广的pH值范围内均具有良好的絮凝活性,在pH值1~5和7~11范围内,其絮凝活性能维持在90%左右,证明该絮凝剂对处理酸性废水和高碱性造纸废水具有潜在的应用价值;优化絮凝条件,菌株B-6的发酵上清液对高岭土悬浮液的絮凝率最高可达95.4%。该微生物B-6所产絮凝剂中总糖含量为60.6%,蛋白质含量为11.8%,可知该絮凝剂的主要成分为多糖。综合研究结果表明,菌株B-6是一株具有研究开发价值的微生物絮凝剂产生菌株。
[1]芦 艳,孟丽丽,乔富珍.高效微生物絮凝剂对造纸废水的应用研究[J].水处理技术,2009,35(7):9-12.
[2]张淑娟,杨 宇.无机-有机复合絮凝剂PST处理印染废水效果研究[J].环境工程,2011,29:7-9.
[3]林 波,郭海蓉,任二芳,等.天然高分子絮凝剂分离澄清甘蔗糖蜜[J].食品研究与开发,2011,32(8):39-41.
[4]Polizzi S,Pira E,Ferrara M,et al.Neurotoxic effects of aluminum among foundry workers Alzheimer's disease [J].Neurotoxicology,2002,23:761-774.
[5]林红梅.造纸废水处理用淀粉基絮凝剂的研制及作用机理研究[D].福建:福建师范大学,2005,3-15.
[6]Matthys C,Bilau M,Govaert Y,et al.Risk assessment of dietary acrylamide intake in Flemish adolescents [J].Food and Chemcal Toxicology,2005,43:271-278.
[7]黎 忠,张修玉.一株高效微生物絮凝剂产生菌的筛选鉴定和培养条件优化[J].环境工程学报,2010,4(11):2515-2518.
[8]黎 忠,张修玉,秦建桥,等.微生物絮凝剂ZS-7的纯化及其结构特征研究[J].环境科学,2010,31(9):2184-2190.
[9]He J,Zou J,Shao Z Z,et al.Characteristics and flocculating mechanism of a novel bioflocculant HBF-3 produced by deep-sea bacterium mutant Halomonas sp.V3a'[J].World Journal of Microbiology &Biotechnology,2010,26:1135-1141.
[10]Li Z,Zhong S,Lei H Y,et al.Production of a novel bioflocculant by Bacillus licheniformis X14 and its application to low temperature drinking water treatment[J].Bioresource Technology,2009,100:3650-3656.
[11]王 融,刘云鹏,霍远涛,等.高效微生物絮凝剂产生菌XNJ1的筛选与絮凝条件优化[J].南京农业大学学报,2011,34(3):67-71.
[12]褚可成,石小霞,陈志梅,等.微生物絮凝剂产生菌的筛选及其特性研究[J].生物学杂志,2011,28(5):42-46.
[13]徐晓明,蒋丽春,唐绍明,等.微生物絮凝剂产生菌菌种的培养及筛选[J].武汉理工大学学报,2012,34(2):110-114.
[14]Liu W J,Wang K,Li B Z,et al.Production and characterization of an intracellular bioflocculant by Chryseobacterium daeguense W6 cultured in low nutrition medium [J].Bioresource Technology,2010,101:1044-1048.
[15]周德平,夏 颖,韩 如,等.三株菲降解细菌的分离、鉴定及降解特性的研究[J].环境科学学报,2001,23(1):124-128.

